疾病簡介
1856年,西班牙病理學家MaestredeSanJuan在世界上首次報導了腦內嗅球缺失和小睪丸在同一個人出現的情況。1944年,美國醫學遺傳學家Kallmann對性腺功能減退症伴嗅覺喪失的3個家系進行了研究,發現在所有受累的患者中,嗅覺喪失與性腺功能減退表現為連鎖不平衡的“共分離”現象,確定此病為遺傳性疾病。上個世紀50年代,瑞士解剖學家deMorsier報導了一些男性性腺功能減退症患者伴有嗅球和嗅束髮育不全或缺失。若干年後,這種性腺功能減退症歸因為GnRH的分泌缺陷。KS的流行病學特徵尚不清楚,粗略估計男孩的發病率為1/8000,女孩的發病率約為男孩的1/5。
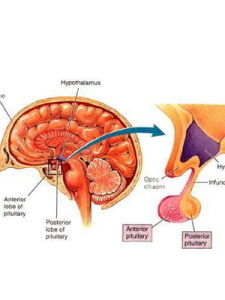
卡爾曼氏綜合徵患者的青春期會比同齡人晚,當年齡相近的人對異性開始感興趣時,他還懵懵懂懂。這種人的下丘腦無法製造正常數量的GNRH——促性腺激素釋放激素,GNRH能調節腦下垂體、腎上腺、睪丸、卵巢的性荷爾蒙分泌。人在胚胎階段GNRH神經細胞移入腦部的過程中如果出了差錯,下丘腦便無法傳遞適當的信息給內分泌系統,到了青春期便會因為缺少足夠的性荷爾蒙導致性發育退化。
目前尚無特效療法,患者需通過長期用藥維持體徵與身體穩態。
發病機制
KS發病機制尚不十分清楚。目前認為可能是起源於嗅基板的GnRH神經元因各種原因不能正常遷徙、定位於下丘腦而導致完全或部分喪失合成和分泌GnRH的能力,引起下丘腦-垂體-性腺軸功能低下,不能啟動青春期,而表現為青春期發育延遲。隨著對KS遺傳學研究的深入,陸續發現一些和KS發病相關的基因,如KAL1基因、成纖維細胞生長因子受體1基因(FGFRI)、成纖維細胞生長因子8基因(FGF8)、前動力蛋白2基因受體(PROKR2)、前動力蛋白2基因(PROK2),這些基因的功能可能和GnRH神經元的正常遷徙、嗅球的發育及GnRH神經元軸突向正中隆起的投射過程密切相關。但是僅30%的Kallmann綜合徵發病與上述基因相關,提示還有其他KS的發病相關基因尚未發現。
臨床表現
1、性腺功能減退:多數男性患者下部量大於上部量,呈類宦官體形,外生殖器幼稚狀態,陰莖短小,睪丸小或隱睪,青春期第二性徵發育缺如(無鬍鬚、腋毛、陰毛生長,無變聲)。女性患者內外生殖器發育不良,青春期時無乳房發育,無腋毛、陰毛生長,無月經來潮。
2、嗅覺缺失或減退:患者可表現為完全的嗅覺缺失,不能辨別香臭,但部分患者可能僅表現為嗅覺減退。
3、相關軀體異常表現:KS除了GnRH缺乏及嗅覺缺失,可伴有各種各樣的軀體異常,包括面中線發育缺陷如唇裂、齶裂,掌骨短及腎臟發育異常等。神經系統的表現包括感覺性聽力下降,鏡像運動(聯帶運動),眼球運動異常及小腦共濟失調。迄今,腎臟發育異常及鏡像運動僅在X連鎖的KS中發現。
診斷
目前實驗室無法檢測外周血GnRH的水平。常規的實驗室檢查包括:LH、FSH及T的水平檢測。KS的診斷基於:1)男性>18歲(選定18歲可排除一些在14-18歲才進入青春期的情況),2)有性腺功能減退症的臨床表現,3)LH、FSH、T(T<100ng/dl)的水平均低下,4)甲狀腺軸功能、腎上腺軸功能、生長激素軸功能及泌乳素正常,5)鞍區MRI未見下丘腦及垂體器質性異常,6)嗅球/嗅束MRI:嗅球、嗅束髮育不良或未發育,7)骨齡落後,8)GnRH興奮試驗表現為反應延遲,9)染色體核型正常。鑑別診斷
1、特發性低促性腺激素性性腺功能減退症
目前,一般將嗅覺正常、臨床上又找不到明確原因的性腺功能減退症,稱之為特發性低促性腺激素性性腺功能減退症(nIHH)。因為KS的嗅覺減退可表現為不同程度,所以有時不易截然區分KS和nIHH,尤其是性腺功能減退症的患者常無仔細的嗅覺功能評估。有遺傳學證據表明,編碼GnRH和Kisspeptin受體的基因和nIHH相關,而與GnRH神經內分泌細胞的遷徙無關(KS患者可能存在GnRH神經內分泌細胞的遷徙異常),提示KS和nIHH可能有不同的遺傳背景和發病機理。
2、體質性青春期發育延遲
由於GnRH脈衝發放器活動延遲,導致青春期啟動時間較兒童正常晚,多有生長發育延遲的家族史,臨床表現為:身材矮小,同時有性腺功能減退。常在18歲前有正常的青春期啟動,青春期過程正常,最終可獲得正常的性成熟。而KS患者不會有正常的青春期啟動。
3、Klinefelter綜合徵
該疾病為染色體異常病,典型的染色體核型為47,XXY。患者表現為先天性睪丸曲細精管發育不良,玻璃樣變性,青春期可有一定程度的性發育,但睪丸體積一般小於4ml。由於患者的促性腺激素不能有效地刺激睪丸產生睪酮,故第二性徵發育不全。但因下丘腦-垂體功能正常,而睪丸分泌睪酮不足,故對垂體產生LH、FSH細胞的負反饋抑制作用減弱,因此表現為高促性腺激素性性腺功能減退症,既血LH、FSH水平明顯升高,睪酮水平低於正常或為正常低限。
4、Turner綜合徵
女性KS患者原發性閉經,需與Turner綜合徵鑑別,Turner綜合徵是染色體數目異常疾病,常見核型為45,X0;臨床表現有原發性閉經,身材矮小,性幼稚,頸蹼、肘外翻、第4、5掌骨變短等。染色體核型檢查可予鑑別。
5、CHARGE綜合徵
估計CHARGE綜合徵的發病率約為1/8500-12000。該疾病的名稱是由以下臨床表現的首字母組成:眼缺損(coloboma),心臟畸形(heartanomalies),後鼻孔閉鎖(choanalatresia),生長和/或發育遲緩(retardationofgrowthand/ordevelopment),外生殖器畸形(genitalanomalies)及耳畸形(earanomalies)。由於大部分CHARGE綜合徵的患者也同時存在著嗅球不發育/發育不全和性腺功能減退症,而這正是KS的臨床特點,故當臨床上診斷KS時要考慮是否有CHARGE綜合徵可能。研究發現CHARGE綜合徵與CHD7基因相關。CHARGE的診斷如下:眼缺損和後鼻孔閉鎖為主要診斷標準,餘4項為次要診斷標準,符合4條診斷標準(至少1條主要診斷標準)即可診斷。
疾病治療
目前,對男性KS患者的主要治療方案有:
1、雄激素:對於暫無生育需求患者,14歲以後可予雄激素治療,以促進男性第二性徵發育,維持正常性功能、體脂成分、骨密度,同時有助於維持正常的情緒和認知,但是雄激素的治療不能恢復生育能力。使用雄激素過程中,要監測骨齡情況,避免骨骺早閉,影響患者成年後的終身高;需要提醒注意的是:雄激素治療6月後,可停藥觀察,並重新評價下丘腦-垂體-性腺軸的功能,如單側睪丸體積明顯增大到4ml以上,內源性睪酮水平明顯增高,則應繼續停藥隨診,考慮有性腺功能逆轉恢復正常的可能性。
2、促性腺激素:促性腺激素治療有可能恢復患者生育能力,給藥方式為HCG2,000-5,000U,每周2次肌內注射。依據睪酮水平和睪丸生長情況調整用藥,當睪酮水平達正常成年男性中值後,再加用HMG/FSH75-150U每周2-3次肌內注射。研究表明:產生精子的中位數時間為7個月。男性乳房發育是HCG治療常見不良反應。若調整HCG劑量,使血清睪酮維持在正常值下限以避免生成過多雌激素,可以避免乳房發育。
3、GnRH脈衝治療:當垂體前葉功能正常時,可考慮行GnRH脈衝治療。使用攜帶型輸注泵,以每1.5h-2h脈衝樣皮下輸注GnRH,模擬GnRH生理分泌模式,促進垂體前葉促性腺激素的合成和釋放,進而促進睪丸生長發育,分泌睪酮和生成精子。有報導稱:GnRH脈衝治療12個月,患者精子生成率高達77%。