基本資料
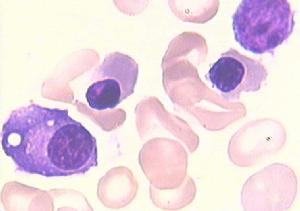
 先天性純紅細胞再生障礙性貧血
先天性純紅細胞再生障礙性貧血英文名:congenitalpureredcellaplasticanemia
別 名:先天性單純紅細胞再生障礙性貧血;先天性單純性紅細胞再生障礙性貧血;Diamond-Blackfan綜合徵;DBA;Diamond-Blackfananemia
由於DBA頗為少見,其確切的發病率難以確定。歐洲回顧性研究表明DBA在≤15歲兒童中年發病率約為1.5/100萬~5.0/100萬。
此病發生於嬰幼兒多數患兒出生後2周~2年後發病絕大多數(超過90%)患兒在1歲內確診,本病男女患者之比約為1.1∶1。
病因
 先天性純紅細胞再生障礙性貧血
先天性純紅細胞再生障礙性貧血發病機制:
常規集落培養顯示DBA患者骨髓紅系祖細胞(BFU-E及CFU-E)顯著減少或缺如。已有的實驗研究結果表明DBA患者體內不存在與紅系造血缺陷有關的細胞及體液免疫功能紊亂,且其骨髓基質支持造血功能良好。較為一致的觀點認為DBA患者紅系祖細胞有內在性的質的異常,從而導致其對多種調控紅系祖細胞分化與增殖的造血細胞生長因子(HGFs)反應性降低由於DBA存在與W/Wv及sl/sld小鼠較為相似的血液學異常人們推測DBA發病機制可能與c-kit受體/配體(KL)系統有關。另有研究發現,DBA患者CD34+細胞在單一或聯合的EPO,IL-3,IL-6及GM-CSF刺激下BFU-E產率仍低下或缺如,向上述培養體系中加入KL可以明顯增加BFU-E集落產率及體積,提示其CD34+細胞c-kit受體表達無異常。貧血的發生可能為體內KL生成不足或缺乏所致。有人認為多數DBA原發性缺陷不在於c-kit/KL系統,只部分患者存在c-kit/KL系統某些異常此點反映了本病的異質性,這些異常解釋部分患者病情發展與轉歸的不同。Fit-3配體(FL)體外並不協同KL刺激DBA患者骨髓BFU-E生長,且其體記憶體在與正常人相同的低水平FL提示某些DBA紅系生長不良與FL無關。
研究證實DBA患者並不存在SCL基因與GATA基因表達及其蛋白產物結構異常,但其E蛋白表達顯著低下,而KL體外可以糾正這一缺陷,因此從分子水平上揭示KL可能通過促進SCL/E蛋白異源二聚體形成發揮其刺激DBA紅系造血作用。E蛋白異常與DBA紅系造血缺陷間關係有待更進一步研究。
DBA患者EPO與EPO-R基因表達及其蛋白質結構均無異常,亦不存在抗EPO-R抗體,但尚不能完全除外DBA存在EPO與EPO-R結合後信號傳遞異常。與同等貧血程度的其他良性貧血(如缺鐵性貧血等)患者比較,DBA患者血清EPO水平升高更為顯著此變化對於保護體內殘存的紅系祖細胞避免過多過快凋亡可能具有重要的生理學意義。
臨床表現
 先天性純紅細胞再生障礙性貧血
先天性純紅細胞再生障礙性貧血併發症:
1.先天性純紅細胞再生障礙性貧血患者易並發多種惡性腫瘤文獻報導的先天性純紅細胞再生障礙性貧血患者480餘例,其中12例於確診後2~43年並發惡性腫瘤,其中急性髓細胞白血病(AML)6例急性淋巴細胞白血病(ALL)1例霍奇金病(HD)2例,骨髓增生異常綜合徵(MDS)2例及肝細胞癌1例。
2.長期套用激素治療者可合併發育障礙及繼發感染。
3.病情進展可導致心力衰竭晚期因輸血過多可繼發血色病或心源性肝硬化。
診斷
 先天性純紅細胞再生障礙性貧血患者
先天性純紅細胞再生障礙性貧血患者鑑別診斷:
應注意與Fanconi貧血,兒童一過性原始紅細胞缺乏症(TEC)慢性溶血性貧血並發B19微小病毒感染Pearson綜合徵及軟骨毛髮發育不良綜合徵相鑑別,其中先天性純紅細胞再生障礙性貧血與FA鑑別診斷尤為重要。
實驗室檢查:
1.外周血象呈正細胞正色素性貧血血紅蛋白10~90g/L,網織紅細胞絕對值減少,嬰幼兒患者一般不伴有外周血白細胞及血小板減少。繼發脾功能亢進可導致全血細胞減少且有巨幼樣變。
2.骨髓象增生良好但紅系顯著減少,其他骨髓細胞均正常。
3.紅細胞存活時間正常。
4.血清鐵及血清鐵飽和度增加,胎兒血紅蛋白增加,i抗原持續存在。
5.血膽紅素和糞膽原排泄正常。
其它輔助檢查:
治療
 學識研究
學識研究1.腎上腺皮質激素類藥物約75%患者對腎上腺皮質激素治療有反應,但僅少數患者可獲持續性緩解,超過80%有效患者成為腎上腺皮質激素依賴者。臨床上潑尼松治療先天性純紅細胞再生障礙性貧血的推薦劑量為2mg/(kg•d)連續1個月以上此後根據療效反應來調整潑尼松劑量與療程,無效者可試驗性套用大劑量甲潑尼龍(HDMP),100mg/(kg•d)靜脈輸注,連續3天,以後逐漸減量。有報導先天性純紅細胞再生障礙性貧血患者17例中9例經甲潑尼龍(HDMP)治療後無需維持劑量潑尼松而獲持久療效但鑒於甲潑尼龍(HDMP)毒副作用明顯臨床上對本療法應持慎重態度。有報導改用口服甲潑尼龍(HDMP)可減輕其毒副作用。
2.HGFs已有紅細胞生成素(rhEPO),rhIL-3及rh莫拉司亭(GM-CSF)單用,聯合或序貫治療先天性純紅細胞再生障礙性貧血,僅rhIL-3對部分患者有效。Bastion等套用rhIL-3治療先天性純紅細胞再生障礙性貧血患者25例劑量由2.5μg/(kg•d)逐漸遞增至10μg/(kg•d),連續8~12周,其中13例患者獲得持久性療效。
 藥物
藥物4.其他用雄激素,但須注意對患兒發育的影響。用環孢素(環孢素A),使血細胞比容增加,但不能持久。
新近有報告對1例因長期輸血導致血色病的先天性純紅細胞再生障礙性貧血患者套用重組人生長激素(rhGH)治療後,其生長速度明顯加快。
預後及預防
預後:
不同遺傳方式、多變的臨床表現以及各異的體外生物學反應等提示本病可能為不同病因所致的一組異質性疾患。患者存活期及存活質量取決於其臨床療效反應,為尋求療效更為確切的治療手段(如基因治療等),應進一步深入研究本病的分子生物學病理機制。