概述
 P53抗癌基因
P53抗癌基因結構及表達
P53基因在人類、
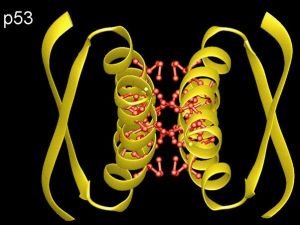
 p53
p53P53基因轉錄成2.5KbmRNA,編碼393個胺基酸蛋白, 分子量為53KD,P53基因的表達至少受轉錄及轉錄後二種水平的調控.在停泊生長或非轉化細胞中P53mRNA水平很低,但刺激胞液後mRNA顯著增加.持續生長的細胞,其mRNA 水平不隨細胞周期而出現明顯變化,但經誘導分化後mRNA水平降低,部分是轉錄後調 控.P53基因的轉錄由P1、P2二個啟動子控制.P1啟動子位於第一外顯子上游100~250bp, P2位於第一內含子內,在啟動子中包含1個NF1蛋白結合位點和一個轉錄因子AP1相關 蛋白的結合位點,對正常P53基因的轉錄,不僅需要二個啟動子的平衡作用,而且P53 基因內含子也起作用,如內含子中有正調控作用,其調控有組織特異性.
產物及功能
P53蛋白N一端為酸性區1~80位胺基酸殘基,C-端為鹼性區319~393位胺基酸殘 基,正常的P53蛋白在細胞中易水解,半衰期為20分鐘,突變性P53蛋白半衰期為1.4~ 7小時不等,P53蛋白N端有一個與轉錄因子相似的酸性結構域,與GAL4的DNA結合區重 組時,融合蛋白能激活GAL4操縱子轉錄,激活功能定位在P53第20~40位密碼子,P53 細胞定位及反式激活功能提示,P53蛋白可能直接或通過與其他蛋白作用參與轉錄控制.
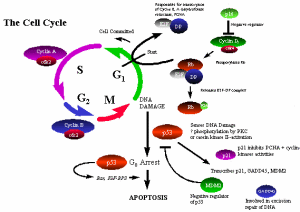
P53蛋白的DNA結合作用及反式激活作用還提示其參與細胞生長調控.通過流式細 胞儀測定單個細胞的細胞周期中P53的表達,發現激活的淋巴細胞比未激活者有較多 的P53表達,而且隨細胞從G1至S期再到G2,M期而增加,提示P53表達與細胞生長的相 關性比進入細胞周期或周期中特定時刻為高.以編碼反義P53RNA的質粒轉染非轉化細 胞導致細胞生長完全停止,P53抗體注入將進入生長周期的靜止細胞.可抑制細胞入S 期,提示P53可能為Go/G1-S轉換所必需,但P53抗體對細胞從分裂至S期無作用,G1期 細胞有抑制作用的二丁酸鈉也抑制P53合成,這些結果提示P53對細胞生長調控作用至 少表現在從G0-G1,或G1-S,但其作用機理尚未弄清楚.目前認為,P53蛋白可通過調 控Cipt基因表達而調控細胞生長,即P53蛋白可刺激Cipt基因產生分子量為21KD的蛋 白,這種蛋白能夠有效抑制某些促使細胞通過細胞周期進入有絲分裂的酶活性,從而 抑制細胞生長,此外,P53的抑制作用還伴隨細胞生長核抗原株表達的降低.細胞生 長、核抗原參與細胞DNA複製.因此,P53可能通過抑制與DNA複製相關的細胞基因或基 因產物而發揮作用.
失活機理
P53蛋白與其它蛋白的相互作用,P53基因突變,都可以導致正常生物功能的喪失.
1.P53與蛋白質的相互作用
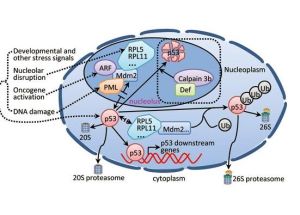
一些蛋白質能與P53蛋白作用,導致其正常生物學功能的喪失,DNA腫瘤病毒如 HPV16、18、SV40和腺病毒編碼癌蛋白,引起宿主細胞的惡性病變,這些癌蛋白如 SV40T抗原、腺病毒ELa、ELb、HPVE6能與Rb,P53結合.Scheffner證實,HPVE6結合 P53後,啟動細胞內蛋白酶降解P53,從而降低P53正常功能.而SV40T,腺病毒ELb沒有 發現這種降解作用方式.此外,P53還可以被細胞基因產物相互作用而失活,如MDM2可 結合P53而使其失活,在一些常見的人類肉瘤中,都有MDM2基因擴增,這種擴增可能 干擾P53的正常功能.
2.P53基因突變
P53正常功能的喪失,最主要的方式是基因突變,通過腫瘤中大量的突變體分 析,證實大部分突變是位於4個突變熱點之一的錯義突變.這4個突變熱點是aa129~146、 171~179、234~260、270~287:正對應於P53基因進化最保守區段,體外實驗證實突 變體失去特異位點的結合能力,此外,突變體還可以改變P53的球形構象.例如,一些 突變體可與熱體克蛋白結合,一些突變引起213~217肽段的暴露,另外,一些則引起 酸性激活結構域的改變,這些突變提示P53的微小改變可引起遠離突變位點區段甚至 整個蛋白構象的改變.構象的改變不僅影響突變體,還影響野生型的功能.實驗證明, 野生型突變體組成的四聚體不能與結合位點結合,也喪失對目的基因的方式激活作 用,突變體對野生型的結合失活.可以解釋內源野生型P53的負調控作用的解除,從而 引起細胞惡性病變,隨著研究的深入,對P53突變有了新的認識,Dan等認為腫瘤中 P53突變可分為三類:①零突變:即突變體無功能,不參與相互作用;②負突變:即失去 負調控功能,並能使野生型失活,但並不直接參與致癌;③正突變:失去負調控功能, 並獲得轉化能力,這種突變體可直細胞惡性轉化中代替癌基因起啟動作用.
目前認為,P53失活機理是,野生型P53以四聚體形式與特異位點結合,反式激活 下游生長抑制基因的表達,一系列的方式能使P53失活,在一些腫瘤中,單一或兩個 P53位點的喪失降低四聚體濃度,無義突變造成P53翻譯中斷,C端酸性結構域的丟失 影響四聚體形成;最常見的是錯義突變,野生型與突變體形成更穩定的四聚體,喪失正常功能.
突變與腫瘤
P53基因與人類50%的腫瘤有關,目前發現的有肝癌、乳腺癌、膀胱癌、胃癌、結 腸癌、前列腺癌、軟組織肉瘤、卵巢癌、腦瘤、淋巴細胞腫瘤、食道癌、肺癌、成骨 肉瘤等,人類腫瘤中P53突變主要在高度保守區內,以175、248、249、273、282位點 突變最高,不同種類腫瘤不同,如結腸癌和乳腺癌有相似的流行病學(包括地區分布 和危險因素),但P53突變譜並不一致.結腸癌G:CA:T轉換占79%,而且多數CpG,二核 苷酸位點,50%以上轉換突變發生在第3~5結構域的CpGC位於碼子175、248、273);在 乳腺癌中,只發現13%的轉換在CpG位點.此外,G-T顛換在乳腺癌占1/4,但在結腸癌T 分罕見.淋巴瘤和白血病的P53,突變方式與結腸癌相似,即大部分突變為CPG位點的 轉換,G→T顛換較低,A:T→G:C在A:T位點突變較高.佰基特淋巴瘤與其它B細胞淋巴 瘤和T淋巴細胞惡性病變的P53突變譜相似,但佰基特淋巴瘤的轉換突變較高.在非小 細胞肺癌中G:C→T:A最普遍,食道癌顛換率很高,與肺癌不同的是,G:C和A:T位點有 相似的突變率.我國啟東地區50%為249癌碼子的G→C、G→T顛換,而南非肝癌80%為G→T 顛換.骨肉瘤中P53突變率為75%,主要集中在5~9外顯子.