簡介
根據過去的研究報告顯示,與高酪胺酸血症有關的酵素至少有三種:酪胺酸胺基轉移(tyrosine aminotrasferase;TAT)、ρ-羥基-苯基-焦葡萄酸氧化(ρ-hydroxyphenylpyruvate dioxygenase;4HPPD)及延胡索醯乙醯乙酸水解(fumarylacetoacetate hydrolase;FAH),其中,TAT的缺乏會造成眼睛和皮膚的高酪胺酸血症,稱為酪胺酸血症第二型(Tyrosinaemia type II),又稱為Richner-Hanhart症候群(Richner-Hanhart syndrome),主要特徵為手掌腳掌角質化的白化症(palmoplantar keratosis)。4HPPD的缺乏會產生許多異常的代謝產物,包括ρ-羥基-苯基-焦葡萄糖酸、ρ-羥基-苯基-焦乳酸和ρ-羥基-苯基-焦醋酸,這種情況又稱為酪胺酸尿症。而FAH的缺乏則會造成肝臟及腎臟的病變,稱為酪胺酸血症第一型(Tyrosinaemia type I),又稱為酪胺酸病(tyrosinosis),可分成急性與慢性兩種。
早產的新生兒常有暫時性的酪胺酸血症(Trainsient neonatal tyrosinaemia),偶而再足月的新生兒亦可看到。這可能是新生兒4HPPD的尚未成熟或暫時缺乏、高量苯丙胺酸及酪胺酸的攝取、或是維他命C缺乏所造成。此種缺陷會隨著嬰兒的成長,4HPPD逐漸成熟而獲得改善,亦可經由服用維他命C而很快地矯正。
生化原理
遺傳性高酪胺酸血症第一型主要是因為FAH的缺乏所造成。在整個酪胺酸代謝成延胡索酸(fumarate)和乙醯乙酸(acetoacetate)共需五個反應步驟:
1. 由轉胺作用形成ρ-羥基苯丙酮酸(ρ-hydroxyphenylpyruvate)。 2. 將含三個碳的支鏈同時氧化並轉移,並且脫羧形成黑尿酸(homogentisate)。 3. 將黑尿酸氧化成順丁烯二酸單醯乙醯乙酸(maleylacetoacetate)。 4. 將順丁烯二酸單醯乙醯乙酸行異構作用成延胡索醯乙醯乙酸(fumarylacetoacetate)。 5. 將延胡索醯乙醯乙酸水解成延胡索酸和乙醯乙酸。 FAH參與了第五個反應的進行。當FAH缺乏時,整個酪胺酸的代謝會受到阻礙,使得延胡索醯乙醯乙酸會大量累積,順丁烯二酸單醯乙醯乙酸也可能受到影響而累積在體內,造成肝及腎臟的傷害。這些代謝產物會被還原(reduce)及去羧基化(decarboxylate)成琥珀醯丙酮(succinylacetone;SA),並聚集在病患的血漿及尿液中。因此,檢驗病患體內的SA濃度,可作為診斷高酪胺酸血症的重要依據。
目前已知FAH基因位於人體第15對染色體的長臂上(15q23-q25),屬於自體隱性遺傳。對病患肝細胞的DNA序列進行定序分析顯示,有34個基因突變點與FAH的缺乏有關。
臨床特徵
1、 急性高酪胺酸血症
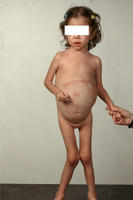
這種情況的嬰兒病程進行快速,若不及時治療,病人將會迅速死亡。發作通常在1至6個月大的時候,病人常有食欲不振、嘔吐、腹瀉、腹脹及低血糖等病徵,並會造成生長遲緩、焦慮不安、發燒及肝腫大的現象,同時會有黑便、吐血、血尿和淤血等溶血的表現,接著會造成腎小管功能失調(renal tubular dysfunction)。由於肝臟發生病變,使得病人逐漸出現佝僂症(rickets)、肝脾腫大等症狀。有些病患會有神經方面的疾病及低張力的現象。這些神經方面的疾病可能伴隨著更嚴重的併發症,例如有時會有類似急性間歇性咯紫質沉積症(acute intermittent porphyria)之症狀發生、神經末梢病變所造成的肌肉無力症和高血壓。隨著病情的加劇,黃疸、水腫、腹部積水、嗜睡、昏迷、肝衰竭、甚至死亡等現象都會發生。
2、慢性高酪胺酸血症
大多數慢性高酪胺酸血症的病童都在一歲以後才發展出病狀。生長遲緩、腸胃道症狀、進行性肝硬化、多重腎缺損和佝僂症都是臨床的表現。在疾病的早期可能只有酪胺酸升高,而較晚才會表現出甲硫胺酸(methionine)的升高。通常在10歲以前死亡,屍體解剖時常可看見肝腫瘤。
臨床診斷
產前檢查
1. 如父母已知造成高酪胺酸血症的基因突變點,可抽孕婦的羊水細胞,進行基因突變點的分析。
2. 亦可檢測羊水中SA的濃度,看是否過高。
3. 採取孕婦的絨毛膜或羊水細胞,加以增殖培養。待收取一定數量的細胞後,測量細胞內FAH的活性,看是否有FAH缺乏的現象。
血液檢測
高酪胺酸血症目前最具公信力的檢驗法是定量血液及尿液中的SA及其前趨物的濃度。這個方式雖然敏銳,但仍有少部分病患的SA濃度偏低,此時,就要以檢測培養細胞的FAH活性來作為診斷的輔助。受到基因多變性的影響,一個健康個體的培養細胞也可能出現FAH低活性的現象。同樣地,病人的肝臟檢體也可能因為細胞培養時出現基因回復(reversed)的情形,以致於獲得了高活性FAH的假象。因此,FAH酵素活性檢測法僅能作為診斷時的參考,而不能作為診斷的唯一憑據。
除了SA的濃度可以作為高酪胺酸血症的診斷工具外,一些生化方面的檢測亦可適用於一般患者。例如:血清中的酪胺酸濃度會增加,但甲硫胺酸的濃度則沒有明顯的提升。尿液中的ρ-羥基-苯基-焦葡萄糖酸、ρ-羥基-苯基-焦乳酸和ρ-羥基-苯基-焦醋酸濃度都會提高。當腎小管出現損壞時,則會表現出范康尼氏症候群(Fanconi syndrome),意即在尿中有高量的胺基酸、葡萄糖和磷酸鹽。當肝臟細胞受到破壞,並且影響到蛋白質的生成時,也會出現一些多樣的生化表現,可作為診斷的依據。例如:依賴維他命K的凝結因子在急性病患中的濃度相當高,而慢性病患體內的濃度也是不正常的。相對於肝臟其他酵素的活性而言,病患體內γ-Glutamyltransferase 的活性會提高。α-fetoprotein的濃度在急性病患的體內有明顯的增加,但在慢性病患中則呈現正常的濃度。
治療
NTBC的治療(NTBC treament)
NTBC(2-(2-nitro-4-trifluoro-methylbenzoyl)-1,3-cyclo-hexanedione)是4HPPD的良好抑制劑,可以阻止ρ-羥基苯丙酮酸轉變成黑尿酸,減少SA的產生,是最新用來治療高酪胺酸血症的方法。根據研究報告顯示:病人在每天口服0.6毫克/公斤的NTBC後,除了ρ-羥基苯丙酮酸與酪胺酸的濃度會增加外,其他生化上的異常都會變成正常,且臨床的症狀也會戲劇化地獲得改善。NTBC亦可用以治療此並在神經方面類似?咯紫質沉積症的症狀。由於酪胺酸的濃度會因為NTBC的使用而增加,因此,飲食的控制仍是必須的。
長時期使用NTBC的相關研究已經被提出討論,特別是NTBC與肝癌發生率間的關聯性,目前尚無定論。愈早使用NTBC,則嚴重的異常就愈不易出現。到目前為止,NTBC尚無任何副作用的報導。
肝臟移殖(Liver Transplantation)
以肝贓移殖來治療第一型高酪胺酸血症約有10年的發展時程,由於本型的病患會有肝臟方面的嚴重損害,因此,當接受者若能擁有提供者肝臟的正常表現時,病患的酵素缺失現象都會獲得改善,血液及尿液中的不正常代謝產物都會消失。獲得肝臟移殖後的病患可以正常的飲食,並不需要特別控制酪胺酸與苯丙胺酸的攝取量。雖然如此,病患尿液中SA的濃度仍然會有增加,推測是由於腎臟的問題所造成。肝臟移殖後對腎臟的長時期預後的仍不清楚。
飲食控制(Dietary treament)
飲食控制是最早用於治療高酪胺酸血症的方法,其觀念在於限制酪胺酸與苯丙胺酸的攝取量,使其量低到只提供身體正常生長所需即可。這樣的食物必須來自於特殊的配方,主要是利用蛋白質的水解產物或不含酪胺酸與苯丙胺酸的胺基酸混合物,再添加極少量的天然蛋白質以補充適當的酪胺酸與苯丙胺酸。當病人分別對酪胺酸與苯丙胺酸的每天攝取量維持在15-20毫克/公斤時,體內SA的濃度就難以被偵測出來。藉由飲食的控制,因腎小管功能障礙所產生的病症,幾乎可以完全回復成正常。但肝臟的疾病與惡性瘤的產生則無法藉此來獲得治療與預防,因此當肝臟嚴重受損或腫瘤產生時,仍需用肝臟移植等方法來改善病況。
支持性的治療(Supportive treament)
對於急性發病的病患而言,支持性的處理是必要的。病患通常缺乏鉀離子與磷酸鹽,因此,需要適時適量的補充。此外,凝血因子、鈣離子、白蛋白、磷酸鹽、電解質和酸鹼的平衡都需要受到嚴密的監控與矯正。當病患處於急性發作的情況下,酪胺酸與苯丙胺酸的攝取量就必須儘量降低到最少。增加維生素D可用來治療佝僂症;病患如有感染,需要馬上控制感染並加以處理。