病因
糖原是由葡萄糖構成的高分子多糖,主要貯存在肝臟和肌肉中作為備用能量,正常肝和肌組織中分別含有約4%和2%糖原。攝入體內的葡萄糖在葡萄糖激酶、葡糖磷酸變位酶和尿苷二磷酸葡糖焦磷酸化酶的催化下形成尿苷二磷酸葡萄糖(UD-PG)。然後在糖原合成酶和分支酶的作用下,形成樹狀結構的糖原大分子。糖原的分解主要由磷酸化酶和脫支酶的反覆作用下形成葡萄糖,或在葡萄糖苷酶的催化下分解為麥芽糖等低聚糖。上述糖原合成和分解過程中任一酶的缺陷即導致不同臨床表現的各型糖原貯積病。GSD-Ⅰ是由於肝、腎等組織中葡萄糖-6-磷酸酶系統活力缺陷,造成過多的糖原貯積於其中,不僅導致其體積增大,而且功能也遭受損害。
臨床表現
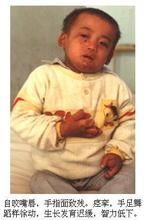
本型患兒臨床表現輕重不一,重症在新生兒期即可出現嚴重低血糖、酸中毒、呼吸困難和肝臟增大等症狀;輕症病例則常在嬰幼兒期因生長遲緩、腹部膨脹等而就診。由於慢性乳酸酸中毒和長期胰島素/胰高糖素比例失常,患兒身材明顯矮小,骨齡落後,骨質疏鬆。腹部因肝臟持續增大而顯著膨隆;肌肉鬆弛,四肢伸側皮下常有黃色瘤可見;但身體各部比例和智慧型等都正常。患兒時有低血糖發作和腹瀉發生。少數嬰幼兒在重症低血糖時尚可伴發驚厥,但亦有血糖降至0.56mmol/L(10mg/dl)以下而無明顯症狀者,隨著年齡的增長,低血糖發作次數可以減少。由於血小板功能不良,患兒常有鼻出血等出血傾向。檢查
1.空腹血生化檢測生化異常包括低血糖、酮症酸中毒、乳酸血症及高脂血症。重症低血糖常伴有低磷血症。三醯甘油、膽固醇脂肪酸和尿酸均顯著增高
2.糖耐量試驗
呈現典型的糖尿病特徵。患兒空腹血糖低而果糖耐量試驗和半乳糖耐量試驗特異性增高。由於患兒不能使半乳糖或果糖轉化為葡萄糖,因此在半乳糖或果糖耐量試驗中血葡萄糖水平不見升高。
3.腎上腺素試驗
皮下注射1∶1000腎上腺素0.02ml/kg,注射前和注射後10,20,30,40,50,60分鐘,分別測血糖,正常者血糖上升40%~60%;糖原貯積病患兒血糖無明顯上升。
4.胰高血糖素試驗
胰高糖素或腎上腺素試驗亦不能使患兒血糖明顯上升。糖肌注胰高血糖素30µg/kg(最大量1mg),於注射後0,15,30,45,60,90,120分鐘分別取血測血糖。正常時15~45分鐘內血糖升高1.5~2.8mmol/L,原貯積病葡萄糖-6-磷酸酶缺乏時在空腹或餐後均無血糖升高。
5.黏多糖檢查
(1)血黏多糖檢查黏多糖末梢血白細胞,淋巴細胞和骨髓血細胞中可見到異染的大小不等、形狀不同的深染顆粒,有時呈空泡狀,顆粒稱Reilly氏顆粒,經證實為黏多糖。
(2)尿黏多糖酸檢查患兒尿中排出大量酸性黏多糖,可超過100mg/24小時(正常為3~25mg/24小時),尿中排出硫酸皮膚素和類肝素。
6.活組織檢查
(1)肝臟活組織檢查可見肝細胞增大糖原增加;葡萄糖-6-磷酸活性酶降低或消失。
(2)肌肉活組織檢查糖原含量稍增加糖原結構正常血小板中葡萄糖-6-磷酸活性酶亦可降低或消失。
7.酶檢查
可測定尿中各種酶的活性,各型黏多糖增多症均有相應的酶活性降低。患兒白細胞成纖維細胞或肝細胞,尿中缺乏α-艾杜糖醛酸酶。
8.基因檢測
可通過外周血白細胞DNA分析進行基因檢測。
9.血小板膜檢查
血小板膜釋放ADP能力減低,因此其黏附率和聚集功能低下。多數患兒肝功能正常。
10.影像學檢查
X線檢查可見骨質疏鬆和腎臟腫大。背柱、頭顱X線示僅有輕微改變。
B超和CT掃描可發現肝、腎腫大,少數病程較長患兒肝臟並發有單個或多個腺瘤。
診斷
根據病史、體徵和血生化檢測可供做出初步臨床診斷,糖代謝功能試驗可能有助於診斷。以肝組織的糖原定量和葡萄糖-6-磷酸酶活性測定作為確診依據。治療
在空腹低血糖時,由於胰高糖素的代償機制促進了肝糖原分解,導致患兒體內6-磷酸葡萄糖累積和由此生成過量的乳酸、三酸甘油酯和膽固醇等一系列病理生化過程。因此,從理論上講,任何可以保持正常血糖水平的方法即可阻斷這種異常的生化過程並減輕臨床症狀。1.藥物治療
維生素類藥物,如B族維生素、維生素C等。有感染給抗生素治療。
2.手術治療
做門-腔靜脈吻合術改善本病的生化異常。
3. 特異性的酶替代治療及基因治療
最有希望治療黏多糖增多症的方法是特異性的酶替代治療及基因治療,二者可改善患兒的臨床表現以及生存情況。
特異性酶替代治療可有兩種不同的形式。一種是直接給體內輸入經過微包裹的酶,此為直接法。另一種則為間接法,即利用反轉錄病毒進行轉基因處理,使患兒自體的周圍血淋巴細胞或骨髓造血祖細胞逆向轉化為含有正常酶基因的細胞,或通過骨髓移植給患兒體內植入含有正常酶基因的骨髓細胞,從而使患兒體內可以自身合成所缺乏的黏多糖代謝酶。