概述
 毛細血管
毛細血管肺出血-腎炎綜合徵(Goodpasturessyndrome)系病毒感染或吸入某些化學性物質引起原發性肺損害。由於肺泡壁毛細血管基膜和腎小球基底膜存在交叉反應抗原,故可以引起繼發性腎損傷。肺出血腎炎綜合徵的特徵為咯血、肺部浸潤、腎小球腎炎、血和累及的組織中有抗基底膜抗體。
廣義的肺出血-腎炎綜合症,泛指凡是有咯血及腎炎並存的一大組臨床現象,而具備肺出血-腎炎及抗腎小球基底膜抗體(血及腎)陽性的一類疾病,則專稱為肺出血-腎炎綜合症-抗基底膜抗體型。在肺出血腎炎綜合徵中肺出血及腎臟受累的程度各輕重不一,如果只有腎臟受累而無肺受累者應屬新月體腎炎1型-原發性抗腎小球基底膜型新月體腎炎;如只有肺受累而無腎受累臨床表現者則屬特發性肺出血。
介紹
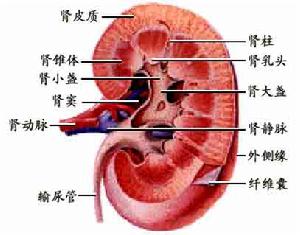 腎
腎臨床表現
 咯血
咯血發病前不少患者有呼吸道感染,以後有反覆咯血,大多數出現在腎臟病變之前,長者數年(最長可達12年),短者數月,少數則在腎炎後發生。X線檢查見兩肺有瀰漫性或結節狀陰影,自肺門向周圍擴散,肺尖及近膈肌處清晰,常一側較重,有的無咯血史,但經痰含鐵血黃素及胸片檢查證實有出血。在咯血時肺彌散功能減退,出現低氧血症,貧血常見。
腎臟表現
每例均有蛋白尿、紅細胞及管型,可有肉眼血尿。腎功能減退,然而進展速度不一,有的患者可在1~2日內呈現急性腎功能衰竭,大多數在數周至數月內發展至尿毒症,少數演變較慢,有穩定在原水平或緩解以後又復發者。
血清學檢查
抗腎小球基膜抗體效價均增高而其他自身抗體均陰性,個別病例有免疫球蛋白增高,抗基膜抗體濃度不一定和肺、腎病變的嚴重度成比例。
病理病因
病因
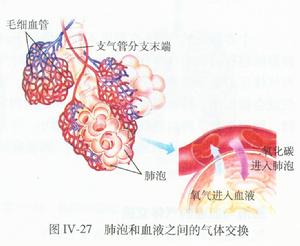 肺泡
肺泡已公認腎臟發病原理為抗基底膜抗體型腎炎的免疫反應過程。由於某些發病因素原發性損傷肺泡間隔和肺毛細血管基膜,後者刺激機體產生抗肺基膜抗體,在補體等作用下引起肺泡一系列免疫反應。由於肺泡壁基膜和腎小球基底膜間存在交叉抗原,故內源性抗肺基膜抗體又能與腎小球基底膜起免疫反應,損傷腎小球。
發病前不少患者有呼吸道感染,以後有反覆咯血,大多數出現在腎臟病變之前,長者數年(最長可達12年),短者數月,少數則在腎炎後發生。X線檢查見兩肺有瀰漫性或結節狀陰影,自肺門向周圍擴散,肺尖及近膈肌處清晰,常一側較重,有的無咯血史,但經痰含鐵血黃素及胸片檢查證實有出血。在咯血時肺彌散功能減退,出現低氧血症,貧血常見。
病理改變
肺表面瀰漫性出血,切面可見水腫和陳舊的出血。鏡檢見肺泡內出血,肺泡腔內常有吞噬含鐵血黃素的吞噬細胞,局灶性肺泡纖維組織增殖。免疫螢光檢查顯示肺泡間隔和肺毛細血管基膜有免疫球蛋白和C3呈線狀沉積,腎臟病理改變似急進性腎小球腎炎。此外,早期腎小球毛細血管呈局灶和節段性壞死,後期腎小球周圍有淋巴細胞浸潤為一特點。
治療診斷
診斷
根據反覆咯血、血尿、X線徵象及痰中含鐵血黃素細胞陽性即可作出診斷,單純有肺部表現則要和特發性肺含鐵血黃素沉著症鑑別。候腎臟症狀出現後診斷較易,但要和壞死性血管炎有肺及腎表現者、尿毒症伴咯血者鑑別。
診斷依據
典型病例有明顯的肺出血、腎小球腎炎,再加上抗基膜抗體陽性,一般可做出診斷。但有部分患者,其臨床表現不典型,以某一症狀為突出表現,易被忽略,導致漏診或誤診。因此,凡是原因不明的咯血患者,尤其是青年男性,如伴有血尿、蛋白尿、肺部光改變,特別是短期內出現貧血,進行性腎功能減退者,應高度考慮肺出血腎炎綜合徵的可能,腎或肺活體組織檢查可助確診。
治療
 環磷醯胺
環磷醯胺治療的關鍵在於早期確診,及時施予有效的治療。
(1)腎上腺皮質激素和免疫抑制劑:兩者聯合套用,能有效地抑制抗基膜抗體的形成,可迅速減輕肺出血的嚴重性和控制威脅生命的大咯血。一般可用甲基強的松龍衝擊治療,同時加用免疫抑制劑,如環磷醯胺或硫唑嘌呤;亦可一開始即口服強的松加用免疫抑制劑如環磷醯胺或硫唑嘌呤。病情控制後,可停用免疫抑制劑,強的松緩慢減至維持量5~15mg/d繼續治療。
(2)血漿置換療法:血漿置換治療,聯合套用免疫抑制劑和中等劑量的皮質激素療法,可有效地抑制肺出血和改善腎功能。對於急進性患者,如能在尚未發生少尿、血肌酐<530.4μmol/L之前進行,則療效更佳。已進入終末腎臟病期,血肌酐高於530.4μmol/L需要透析治療維持生命者,則療效欠佳。每日置換血漿2~4L,時間和頻度可根據循環抗基膜抗體水平而定。再加上口服劑量的強的松(60mg/d)和免疫抑制劑,80%的病人腎功能改善;對曾予衝擊治療而難於控制的肺出血,經血漿置換後,均有不同程度的緩解。
(3)腎臟替代治療:對於常規治療無效或治療較遲而進入終末期腎臟病者,應予血透或腹透以維持生命。如病情穩定,血循環抗基膜抗體降低,可考慮腎移植。腎移植後可有復發者,其精確的發生率尚難估計,可能復發率不高。有人認為腎移植前先行雙側腎切除術,但是否能減少腎移植後復發,目前尚無足夠的證據。
(4)其他:確診為肺出血腎炎綜合徵的患者,如腎活檢證明為非可逆性損害,大劑量激素衝擊療法和血漿置換法難於控制的肺出血,可考慮雙側腎切除。既往認為抗凝治療對病情有一定的改善作用,但新近也有學者認為抗凝治療有加重肺出血的可能性而不宜採用。此外,應加強支持療法和控制感染。
病例
 血紅蛋白
血紅蛋白肺出血-腎炎綜合徵又稱Good-Pasture綜合徵,屬少見病,近幾年國內有散在報告。此病原因未明,目前多數學者認為與自身免疫有關,即病人體記憶體在抗-GBM抗體,而病人肺毛細血管基底膜與腎小球基底膜有交叉反應性抗原,從而引起肺泡毛細血管基底膜和腎小球基底膜病變,導致肺出血及腎炎表現。血清抗-GBM抗體陽性,或組織活檢見沿腎小球和肺泡基底膜有IgG沉積,為肺出血腎炎綜合徵的3個診斷依據。臨床上有許多疾病同時表現為肺出血和腎炎,如系統性紅斑狼瘡、韋格肉芽腫和增殖性腎小球腎炎等,但這些疾病都不同時具備上述三方面的條件。
本例發病前有呼吸道感染,以反覆咯血為主要表現,咯血程度不一,且隨著咯血量的不同,肺部X線影像隨之改變,激素治療吸收快。隨著病情的發展,又出現蛋白尿,痰中可見含鐵血黃素巨噬細胞,血中抗-GBM抗體陽性,其過程均符合肺出血-腎炎綜合徵的變化規律。
通過對本例的分析,作者認為有以下幾點值得注意:①不能將肺浸潤性病變簡單地與肺炎、肺結核聯繫在一起,而忽略了一些少見病;②應動態觀察臨床表現的變化特點,在抗炎、抗結核無效的情況下,應拓寬診斷思路;③動態觀察肺部影像變化,對於病變的多發性、遊走性、反覆性及對治療的反應性都應給予高度重視,認真分析;④應將臨床症狀的變化與X線胸片變化緊密聯繫起來,發現其內在的聯繫;⑤儘量用一元論解釋所有臨床症狀。

