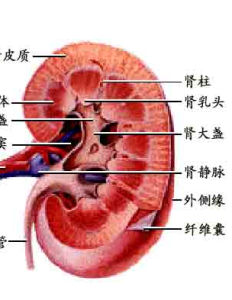
概述 腎炎綜合徵
腎炎綜合徵
 腎炎綜合徵
腎炎綜合徵經典腎炎綜合徵包括血尿,高血壓,腎功能不全和水腫.常常綜合徵的個別表現缺乏.腎炎綜合徵可能是急性和暫時性的(如感染後腎小球腎炎),以迅速腎衰形式暴發(如急進性腎小球腎炎,RPGN)或無症狀的(如IgA腎病).病理改變和因此而導致的臨床表現經常隨時間而改變.
病因
免疫或者炎症介導的腎小球基底膜正常結構破壞導致紅細胞、白細胞等血漿成分進入尿液中。這種炎性反應既可以由於循環中的抗體對於腎小球基底膜固有成分的免疫攻擊,也有循環中的免疫負荷物在腎小球濾過時“羈留”,並導致補體的激活以攻擊腎小球並趨化炎性細胞。臨床表現
1.血尿可有肉眼血尿,或者僅表現為鏡下血尿,亦可於尿常規中見到紅細胞管型。
2.蛋白尿
與腎病綜合徵相比蛋白尿程度輕。
3.高血壓
除外其他原因導致的高血壓。
4.水腫
主要是外周水腫。
5.氮質血症
腎功示尿素氮肌酐值升高,乏力、噁心、嘔吐。
6.少尿
尿量<400ml/天。
急性腎炎綜合徵
(急性腎小球腎炎;感染後腎小球腎炎)一種病理學表現為腎小球內瀰漫性炎性改變,臨床表現為突然起病的血尿,紅細胞管型,輕度蛋白尿,時常伴有高血壓,水腫和氮質血症為特徵的綜合徵.
病因學
急性腎炎綜合徵的原型是鏈球菌後腎小球腎炎(PSGN),因為感染了A組β-溶血性鏈球菌的某些致腎炎菌株,如12型(伴咽炎)和49型(伴膿皰病).PSGN在美國和歐洲的發病率正在下降.在世界上其他許多地區流行發生,大約5%~10%伴有咽炎,約25%伴有皮膚感染的患者發生PSGN.此疾病在大於3歲的兒童和年輕人中最常見,但也有5%的病人年齡超過50歲.從感染至腎小球腎炎起病有1~6周的潛伏期(平均2周).
病理學和發病機制
 腎炎綜合徵
腎炎綜合徵損害主要局限於腎小球,表現為體積增大,細胞增多.開始浸潤的為中性粒細胞或嗜酸性細胞,其後為單核細胞.上皮細胞增生是常見的早期,暫時性表現.如果損害嚴重,可能出現微血栓形成.血液動力學改變導致少尿,常伴有上皮細胞新月體(包氏囊腔內由增生上皮細胞形成,可能由活化的巨噬細胞產生的生長因子介導).內皮和系膜細胞數量增加,系膜區經常因水腫而大大增寬,含有中性粒細胞,死亡細胞,細胞碎片和上皮下電子緻密物質沉積.
免疫螢光顯微鏡通常可顯示免疫複合物IgG和補體呈顆粒狀沉積.電子顯微鏡下,這些沉積物為半月形或駝峰狀,位於上皮下區域.這些沉積物的存在開始補體介導的炎症反應(參見第231節),並導致腎小球損害.儘管有人推測免疫複合物中含有與鏈球菌有關的抗原,但此類抗原還未被找到.
症狀和體徵
腎炎綜合徵
在10%的成人和1%的兒童中,急性腎炎綜合徵可發展成急進性腎
小球腎炎.疾病緩解的病人,腎的細胞增生在幾周內消失,但炎症反應的嚴重性變化很大,剩餘小球硬化常見.大多數兒童(85%~95%)保持或重新獲得正常的腎功能,特別是在鏈球菌感染時得病者.偶爾,某些散在病例和成年人僅部分恢復腎功能.尿液分析中血尿或蛋白尿可能持續多年.
實驗室檢查和診斷
尿蛋白排泄可每日>0.5~2g/m2 ;任意尿蛋白/肌酐比值可能<2(正常0.1~0.3).尿沉渣中含異形紅細胞,白細胞和腎小管細胞,管型包括紅細胞管型和血紅蛋白管型是特徵性的,白細胞管型和顆粒管型(蛋白滴)較常見.
抗致病感染因子的抗體滴度通常在1~2周內上升.針對鏈球菌抗原產物的抗體增多能被測到:抗鏈球菌溶血素-O(ASO)是上呼吸道感染最好的指示,及膿皮病的抗透明質酸酶和抗脫氧核糖核酸酶B.在疾病活動期C3和C4通常降低(表224-1).在80%的PSGN病例補體水平6~8周內可恢復正常,而實際上無一例膜增生性腎小球腎炎(MPGN)會如此.冷球蛋白血症常常持續數月,而循環免疫複合物只能在幾周內檢測到.
小管功能時常因間質中的炎症改變而紊亂,導致尿濃縮能力和泌酸能力下降,腎單位溶質交換障礙.因為具有某些內在的腎小球肥大的能力,故小管功能缺陷通常發生在GFR明顯降低前.隨著腎小球功能紊亂逐漸進展,總濾過面積明顯減少,GFR下降,氮質血症出現.GFR可從血清肌酐濃度或尿肌酐清除率估計,儘管GFR通常在1~3個月內恢復正常,蛋白尿可能持續6~12個月,鏡下血尿可長達數年.輕度上呼吸道感染時尿沉渣的短暫變化可能再次發生.
在本綜合徵起病1~6周前,有喉嚨痛,膿皰病或培養證實的鏈球菌感染的病史,及抗鏈球菌抗體血清滴度的升高可有助於診斷.紅細胞管型在任何腎小球腎炎中都可見,但當與臨床表現相聯繫時,強烈提示急性腎炎綜合徵.超聲檢查可幫助鑑別急性疾病(通常腎臟體積正常或稍大)與慢性疾病加重(腎臟縮小).
預後
預後取決於病人的年齡,感染是散發的還是流行性的及當炎症刺激緩解後腎臟損害所處的階段.如果最初的腎臟損害不嚴重,抗原血症的來源能減少或被清除,則預後通常較好.在大多數病人,症狀和體徵逐漸減輕.嚴重的病例,可發生高血壓伴或不伴心衰及高血壓腦病.GFR顯著降低或腎病綜合徵發生(約30%病人,特別是那些有許多上皮下沉積物者)伴廣泛新月體形成和壞死預示會快速進展至終末期腎衰.少數病人,起病時伴無尿,嚴重高血容量和高鉀血症,除非病人行透析,否則可能死亡.
治療
PSGN發生前對感染行抗微生物治療似乎不能預防PSGN.如果在診斷時細菌感染存在,則應行抗微生物治療,其他任何繼發原因(表224-2)應該治療(表224-3).免疫抑制藥物是無效的,
皮質類固醇激素可能使情況變壞.如果氮質血症和代謝性酸中毒存在,飲食蛋白質需限制.當循環過負荷,水腫或嚴重高血壓存在時,鈉攝入應減少.利尿劑(如噻嗪類,袢利尿劑)可能對於控制擴充的細胞外液容量有幫助.高血壓需有力的治療(參見第199節).嚴重腎衰可能有透析必要(參見第223節).
急性腎炎綜合徵的非細菌性繼發原因
急性腎炎綜合徵也可能發生在病毒,寄生蟲,偶爾在真菌感染之後.這些另外形式的臨床和腎臟病理表現與PSGN相似(上皮下駝峰)或Ⅰ型MPGN(有系膜和內皮下沉積物).腎臟受累的一系列表現存在;系統表現經常與其他疾病混淆(如結節性多動脈炎,腎臟栓子,抗微生物藥誘導的急性間質性腎炎),狼瘡性腎小球腎炎可能發生但更常見為腎病綜合徵(見下文).
這些急性腎炎綜合徵的其他形式較PSGN容易診斷,因為它們的潛伏期較短或者在感染明顯時發生腎小球腎炎.然而,細菌性心內膜炎導致的腎炎診斷困難,特別當血培養是陰性時.
臨床表現的嚴重性與感染持續時間有關,如繼發於人工血管感染後的急性腎炎綜合徵如果感染(通常是表皮葡萄球菌)能被根除則預後較好,這通常需要除去移植物和抗生素治療.然而,當病人原有腎臟疾病或治療被延誤時,腎功能衰竭可能不可逆,損害為廣泛性的(新月體,壞死).
急進性腎小球腎炎
一種以病理學表現為多數腎小球局灶節段壞死和上皮細胞增生(新月體),臨床表現為暴發性腎功能衰竭伴有蛋白尿,血尿和紅細胞管型為特徵的綜合徵.
病因學,發病率和分類
急進性腎小球腎炎(RPGN)不常見,致病機制常常不明,直接原因可不同(表224-4和圖224-1).儘管某些病例實驗室發現提示不止一個綜合徵,免疫螢光顯微鏡檢查和活檢能將RPGN分類.
寡免疫性RPGN在所有RPGN病例中占50%.其特徵表現為在腎小球組織中缺乏免疫複合物或補體沉積
 腎炎綜合徵
腎炎綜合徵免疫複合物型RPGN占RPGN病例的40%,似為特髮型的,但青黴胺,梅毒和惡性疾病與有些病人相關.通常有系統性疾病的證據,如SLE,過敏性紫癜和混合性冷球蛋白血症.一些病人中,RPGN可能重疊於其他原發性腎臟疾病(如MPGN,IgA腎病,膜性腎病).
抗GBM抗體疾病自身免疫性占RPGN病例的10%,並且是特發性的.主要抗原是Ⅳ型膠原的成分.自身反應性T細胞亦可能促進抗GBM抗體作用於腎小球和肺泡.抗GBM抗體存在於血液,在免疫螢光顯微鏡下可於基底膜上見到.在60%~90%的病人中,與肺泡基底膜抗體交叉反應可引起肺泡炎導致肺出血(參見第77節).腎損害伴肺累及(如流感,接觸碳氫化合物,長期抽菸)提示並存肺損傷,可使循環抗體進入肺泡.
病理學
局灶增生腎小球上皮細胞,有時有許多中性粒細胞散在分布,形成新月體性細胞塊,充滿了50%~100%的包氏囊腔.腎小球毛細血管叢通常表現為細胞減少和塌陷.毛細血管叢內壞死或累及新月體常見,可能是最明顯的異常.在這類病人,應尋找血管炎的組織學證據.
間質水腫常常是最顯著的早期表現,為彌散性伴有各類炎性細胞浸潤.當水腫廣泛時,單核細胞浸潤突出,小管最初改變包括空泡形成和透明滴,在遠端小管內,偶見紅細胞和透明管型.隨著疾病的進展,發生萎縮和GBM增厚.間質瀰漫性纖維化,炎性細胞數目減少.
IgG(通常伴有C3節段狀排列)沿GBM線狀沉積是螢光顯微鏡下最突出的異常,但這種類型並不一定出現且非特異.在糖尿病腎病和纖維樣腎小球腎炎中亦可出現.然而,在這些情況下,IgG沉積是非特異的,無新月體和循環抗GBM抗體,其他組織學發現較明顯(糖尿病腎小球硬化,纖維樣腎小球腎炎時電鏡下見纖維細絲).
在嚴重免疫複合物型RPGN,可觀察到IgG和C3的瀰漫不規則沉積,常伴腎小球內細胞增生和新月體形成.在其他病例中,IgG或補體沉積不能測到.然而,不管螢光下類型如何,在新月體中可出現纖維蛋白.
症狀和體徵
臨床表現可能與急性非進行性疾病相似,但其起病常更隱匿.虛弱,疲乏和發熱最突出,噁心,嘔吐,厭食,關節痛和腹痛也常見.約50%病人有水腫及在腎衰起病前4周內有急性流感樣疾病的病史,常隨之出現嚴重少尿.一些病人有蛋白尿病史.高血壓不多見,常不嚴重.偶爾,RPGN伴肺部表現(肺腎綜合徵-見表224-5).
實驗室檢查和診斷
不同程度的氮質血症為典型表現.血尿總是存在,常常是肉眼血尿.總有紅細胞管型,沉渣中的白細胞,顆粒,蠟樣及寬管型常見.經常發現有貧血,有時很嚴重.白細胞增多常見.
高ANCA滴度提示為寡免疫性RPGN病人.在90%Wegener肉芽腫病例中有C-ANCA,而特發性壞死性腎小球腎炎中約80%病例有P-ANCA.鏡下多動脈炎C-ANCA和P-ANCA分布相對均等.
鏈球菌抗體滴度上升,循環免疫複合物或冷球蛋白血症提示免疫複合物型RPGN.低補體血症在免疫複合物型RPGN中常見但在抗GBM抗體疾病中少見.血清循環抗GBM抗體測定陽性有助,此抗體在3~6個月內逐漸消失.超聲檢查或放射線檢查(無造影劑增強)時,腎臟開始可增大但進行性變小.
懷疑RPGN時早作腎活檢對於診斷確立,估計預後,制訂治療方案是必需的.也應實行血清學檢查和尋找感染疾病.
預後和治療
如果綜合徵是特發性的,自發性消退少見;80%未治療病人在6個月內進展至終末期腎衰.不可逆的無尿常見,不透析,可在幾周內死亡.然而,如病因為感染後腎小球腎炎,SLE,Wegener肉芽腫或結節性多動脈炎,治療可改善腎功能.恢復正常腎功能的病人有組織學改變,大多在腎小球,主要為腎小球毛細血管叢或上皮細胞內細胞增生,幾乎無硬化及間質少量纖維化.60歲以上伴少尿性腎衰的病人或75%腎小球有環狀新月體者預後差.
當腎活檢發現嚴重新月體疾病但無廣泛腎小球荒廢,小管間質損害,或在多系統,感染性疾病時,藥物治療宜早期進行(血清肌酐<5mg/dl,<440μmol/L),這時療效最好.無抗GBM抗體疾病,最初需透析的病人亦能從這種治療中受益.甲基強的松龍衝擊治療(1g/d30分鐘內靜脈用,3~5天后口服強的松每日1mg/kg)可降低血清肌酐水平,在寡免疫性或免疫複合物型病人中50%可推遲透析超過3年.ANCA陽性病人可從加服環磷醯胺每日1.5~2mg/kg中獲益.每月環磷醯胺衝擊可減少不良反應,但它的作用還未肯定.
當藥物治療無效或是不完全時,套用血漿置換以去除游離抗體,完整的免疫複合物和炎症介體(如纖維蛋白原,補體).抗GBM抗體疾病治療選擇是血漿置換每日4L交換共14天.一般,對於寡免疫性或免疫複合物型RPGN,每日3~4L交換共4~6天.強的松的環磷醯胺減少新抗體生成.血漿置換時嚴密監測非常必需,因為可能發生潛在危及生命的感染和不良藥物作用.
此後行維持透析替代原發性腎臟病治療.腎移植後原有疾病有在移植腎中發生的危險性.
原發性腎臟血尿-蛋白尿綜合徵
一組通常以反覆發作的肉眼血尿,輕度蛋白尿和腎小球改變為特徵的疾病.
IgA腎病,最重要的原發性腎臟疾病.發生在各個年齡,但以兒童和年輕人最常見.其中男性發病率為女性的6倍,黑人中少見.與所有原發性腎小球疾病相比,它的流行率在美國為5%,南歐和澳大利亞為10%~20%,亞洲為30%~40%.其他疾病亦可表現為無症狀性血尿-蛋白尿綜合徵(表224-6).
發病機制
約50%反覆發作腎性血尿的病人,表現為明顯的系膜區IgA沉積.約一半的病人血清中IgA升高.T細胞亞型改變已有報導.
有證據顯示IgA腎病發病是由於系膜區多聚IgA-抗原複合物的產生增多或清除減少,並激活經典補體途徑.多聚IgA可能起源於富含IgA的黏膜表面.
症狀,體徵和實驗室檢查
最常見的表現是持續性或反覆發作肉眼血尿(兒童中90%)或無症狀性鏡下血尿伴輕度蛋白尿(非腎病範圍).血尿可以是輕度或嚴重但通常是異形的,蛋白尿發生有時不伴血尿.儘管當尿異常首次被檢測到時許多病人並非真正的無症狀,但與腎臟有關的症狀很少.
髒疾病可能發生.一些病人表現為急性或慢性腎衰,嚴重高血壓或腎病綜合徵.原發性腎臟血尿-蛋白尿綜合徵通常發生在發熱
腎功能最初正常,但症狀性腎黏膜(上消化道,竇道,腸道)疾病後1~2天,因此與急性腎炎綜合徵易混淆,除非血尿起病與發熱性疾病同步並伴有腰痛.典型的是輕度蛋白尿(<1g/d),但在≤20%的IgA腎病病人中可發生腎病綜合徵.鏡下血尿總有,通常為異形紅細胞,但紅細胞管型不常見,至少在開始時是這樣.尿中排泄repligen和IL-6增多,血清肌酐和補體濃度通常是正常的,但IgA濃度常增高.血清IgA-纖維連線蛋白複合物可能增多,但這項發現價值還未確定.高血壓在診斷時不常見.
診斷
肉眼血尿是IgA腎病和Alport綜合徵的常見特徵,而持續性鏡下血尿在薄基底膜腎病中更多見.系膜增生性腎小球腎炎的腎小球損傷以不同程度的系膜細胞增生或系膜基質增寬為特徵.通常免疫複合物在系膜區沉積可測到.許多其他特徵性的家族遺傳性,免疫性和感染性疾病(表224-6)與此形態學描述相符.
IgA腎病可藉助腎活檢組織免疫螢光檢查與其他導致原發性腎性血尿的疾病鑑別,發現IgA和C3在增寬的系膜區顆粒狀沉積伴局灶節段增生或壞死性損害.然而,系膜區IgA沉積亦可發生在其他疾病(如過敏性紫癜,慢性酒精性肝硬化).
預後和治療
IgA腎病通常進展緩慢,15%~20%的病例10年內出現腎功能不全和高血壓,20年後25%的病人進展至終末期腎衰.當IgA腎病在兒童時診斷,預後通常較好.然而,持續性血尿總會導致高血壓,蛋白尿和腎功能不全.起病時年齡較大,高血壓,持續大量蛋白尿,無反覆發作肉眼血尿,血清肌酐水平上升,晚期腎小球硬化或新月體形成和小管間質疾病是預後不良的表現.
治療不是很有效,對於預後差的病人仍需進行.大劑量魚油,小劑量華法林和雙嘧達莫聯合使用,最大耐受劑量的ACE抑制劑可能延緩終末期腎衰的發展.其他對於兒童和年輕人,其初始腎功能正常者可能有效的治療為小劑量,長期,隔日用強的松.對於RPGN者靜脈套用免疫球蛋白或血漿置換.環孢素,細胞毒性藥物-強的松聯合和抗生素是無用的.
尿毒症治療將在第222節慢性腎功能衰竭中討論.儘管常有IgA腎病復發的免疫學證據,腎移植成功.長期腎臟科隨訪是必要的.
慢性腎炎性-蛋白尿綜合徵
(慢性腎小球腎炎;緩慢進展性腎小球疾病)
由不同病因的幾種疾病造成,以病理學表現為腎小球瀰漫性硬化,臨床表現為蛋白尿,管型尿,血尿,通常伴高血壓,數年後腎功能隱匿性減退為特徵的綜合徵.
一般人群中發病率不明,但在屍檢中占0.5%~1%.
病因學
病因各異.在約50%的終末期腎衰病人(行雙側腎切除)中證實為原發性腎小球疾病.組織學改變提示局灶及節段性硬化為28%,非特異性腎小球腎炎為28%,MPGN為25%,廣泛新月體疾病為15%,嚴重膜性腎小球腎炎(MGN)為4%.
組織學證實免疫球蛋白和補體在腎小球內不定分布,間接提示其免疫病因.未發現感染,中毒性或代謝性病因.與腎內凝血有關因在尿,血,偶爾腎實質中發現有纖維肽類,它來自凝血系統的激活.然而,究竟這是原因或繼發於損傷還不清楚.
病理學
在許多腎小球中,有細胞外物質包括系膜基質,GBM和塌陷毛細血管袢的增加,無明顯的細胞增生.機化腎小球粘連(上皮細胞在包氏囊腔內粘附)經常出現,可能累及至50%的腎小球.螢光顯微鏡不一定總能檢測到免疫球蛋白沉積,有時可能缺乏.
間質受影響取決於疾病所處階段,但常常較早累及有廣泛浸潤和纖維化.小管萎縮亦存在.血管損害是非特異性的,與腎硬化改變相似,可能因高血壓造成.嚴重瀰漫性腎小球硬化,數個腎小球粘連,間質病變與腎小球病變程度不成比例和細胞外物質顯著增多預示不可逆和進展性腎臟疾病.
症狀和體徵
此綜合徵可保持多年無症狀,因此許多病人不知患病.病人可表現為終末期腎衰的尿毒症症狀(噁心,嘔吐,呼吸困難,瘙癢,疲勞).綜合徵的整個病程中,肉眼血尿(少見)和蛋白尿可復發,可能代表為進行性IgA腎病或其他形式的特發性腎性血尿,緩慢進行性疾病的急性發作或急性腎炎綜合徵不相關發病.因腎病綜合徵可出現下部水腫,常伴中度腎衰.不同程度的高血壓常見,常伴腎功能不全,偶爾發生於明顯的氮質血症前.
實驗室檢查
蛋白尿是一貫的表現,常在非腎病範圍內.異形紅細胞和紅細胞管型經常出現,但甚至在已確診疾病中可能不存在.根據損傷的嚴重性,尿沉渣中常存在中等量細和粗顆粒狀小管細胞管型和透明管型.蠟樣和寬大管型僅在嚴重間質瘢痕和小管萎縮伴擴張時出現.當有功能腎實質損害≥50%時,BUN和血清肌酐升高.隨著疾病的進展,貧血,代謝性酸中毒,高磷血症和其他生化結果伴慢性腎功能衰竭的發生出現.
診斷和治療
此病在常規內科檢查時發現,當病人除蛋白尿和(可能)血尿外無症狀,腎功能正常時.在腎功能明顯損害之前,活檢可有助鑑別特發性復發性血尿,非腎小球疾病(小管間質疾病)和慢性腎炎-蛋白尿綜合徵.局灶節段性腎小球硬化,MGN,MPGN和IgA腎病是最常與此綜合徵混淆的疾病.當腎髒縮小和瘢痕化時,因為學檢查很少能提供病因信息,故很少有腎活檢指征.
無治療被證實能防止疾病進展,足夠降壓藥物治療和謹慎按需攝入鈉可能有效.飲食控制(減少磷酸鹽和蛋白)和ACE抑制劑可能延緩一些腎臟疾病惡化,可能對多數慢性腎小球疾病有幫助.尿毒症症狀的控制在第222節慢性腎功能衰竭中討論.