概述
 鹽酸
鹽酸鹽酸是重要的無機化工原料,廣泛用於染料、醫藥、食品、印染、皮革、冶金等行業。鹽酸能用於製造氯化鋅等氯化物(氯化
隨著有機合成工業的發展,鹽酸(包括氯化氫)的用途更廣泛。如用於水解澱粉制葡萄糖,用於製造鹽酸奎寧(治療瘧疾病)等多種有機藥劑的鹽酸鹽等。鋅是一種焊藥),也能用於從礦石中提取鐳、釩、鎢、錳等金屬,製成氯化物。
研究歷史
在公元800年的一個鍊金師阿布·穆薩·賈比爾·伊本·哈揚(JabiribnHayyan)混合了氯化鈉和硫酸第一次製取了鹽酸。賈比爾發現過許多常見的化學品,並寫下了21本書來記述他的理論。在這些書上寫的許多化學基礎知識現在還在使用。
物理性質
外觀:無色液體,有腐蝕性。為氯化氫的水溶液(工業用鹽酸會因有雜質三價鐵鹽而略顯黃色)。有刺激性氣味。由於濃鹽酸具有揮發性,揮發出的氯化氫氣體與空氣中的水蒸氣作用形成鹽酸小液滴,所以會看到酸霧。
pKa值:-7
密度:1.18g/cm3
熔點:-27.32℃ (38%溶液)
沸點:110°C(20.2%溶液);48°C(38%溶液)
相對蒸氣密度(空氣=1):1.26
飽和蒸氣壓(kPa):30.66(21℃)
黏度:1.9mPa·s,25°C(31.5%溶液)
溶解性:與水混溶,濃鹽酸溶於水有熱量放出。溶於鹼液並與鹼液發生中和反應。能與乙醇任意混溶,氯化氫能溶於苯。
化學性質
強酸性
 鹽酸化學反應
鹽酸化學反應1、和鹼反應生成氯化物和水
HCl + NaOH = NaCl + H2O
2、能與碳酸鹽反應,生成二氧化碳
K2CO3 + 2HCl = 2KCl+ CO2↑ + H2O
3、能與活潑金屬單質反應,生成氫氣
Fe+ 2HCl =FeCl2+ H2↑
4、能與金屬氧化物反應,生成鹽和水
MgO+2HCl=MgCl2+H2O
5、能用來製取弱酸
CaCO3+2HCl=CaCl2+H2O+CO2↑(不用Na2CO3因為反應速率過快,實驗室常用鹽酸於製取二氧化碳的方法)
CH3COONa+HCl=CH3COOH+NaCl
6、能和鹽反應,生成新酸和新鹽
2HCl+Na2SO3=SO2↑+H2O+2NaCl
Na2S2O3+2HCl=2NaCl+H2O+SO2↑+S↓
另外,鹽酸能與硝酸銀溶液反應,生成不溶於稀硝酸的氯化銀,氯化銀極微溶於水,產生白色的凝乳狀沉澱。
HCl+AgNO3===HNO3+AgCl↓
還原性
2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O
4HCl(濃)+MnO2=加熱=MnCl2+2H2O+Cl2↑
14HCl(濃)+K2Cr2O7==3Cl2(氣體)+2CrCl3+2KCl+7H2O
NaClO+2HCl=NaCl+Cl2+H2O
電離方程式
HCl===H+ +Cl-
製備方法
主要是用水吸收氯化氫而得。製取鹽酸有許多方法:
實驗室製取
實驗室中一般以濃硫酸和氯化鈉反應生成氯化氫。總反應式為: 2NaCI(s)+H2SO4(濃)=加熱=Na2SO4+2HCI
主要裝置:分液漏斗,圓底燒瓶或錐形瓶,倒扣漏斗(防止倒吸)防止凍傷、燒手,還有夾子。(防止冷凝水倒流)
直接合成
工業製取鹽酸,很多使用兩種物質直接合成鹽酸,在電解食鹽水生產燒鹼的同時,可得到氯氣和氫氣,經過水分離後的氯氣和氫氣,通入合成爐進行燃燒生成氯化氫氣體,經冷卻後用水吸收製得鹽酸成品。 反應式:
2NaCl+2H2O=電解=2NaOH+Cl2↑+H2↑
H2+Cl2=點燃=2HCl
這種方法可以獲得較純的鹽酸。
有機物合成
常用於鹵化有機物,反應式:
 有機物合成方法知趣鹽酸
有機物合成方法知趣鹽酸主要用途
生活用途
1、人體用途
人類和其他動物的胃壁上有一種特殊的腺體,能把吃下去的食鹽變成鹽酸。鹽酸是胃液的一種成分(濃度約為0.5%),它能使胃液保持激活胃蛋白酶所需要的最適合的pH值,它還能使食鹽中的蛋白質變性而易於水解,以及殺死隨食物進入胃裡的細菌的作用。此外,鹽酸進入小腸後,可促進胰液、腸液的分泌以及膽汁的分泌和排放,酸性環境還有助於小腸內鐵和鈣的吸收。
2、日常用途
製取潔廁靈,除銹劑等產品。
工業用途
1、用於稀有金屬的濕法冶金
例如,冶煉鎢時,先將白鎢礦(鎢酸鈣礦)與碳酸鈉混合,在空氣中焙燒(800℃~900℃)生成鎢酸鈉。
CaWO4+Na2CO3=Na2WO4+CaO+CO2↑
將燒結塊浸在90℃的水中,使鎢酸鈉溶解,並加鹽酸酸化,將沉澱下來的鎢酸濾出後,再經灼熱,生成氧化鎢。
Na2WO4+2HCl=H2WO4↓+2NaCl
H2WO4=WO3+H2O↑
 鹽酸
鹽酸最後,將氧化鎢在氫氣流中灼熱,得金屬鎢。WO3+3H2=W+3H2O↑
2、有機合成
例如,在180℃~200℃的溫度並有汞鹽(如HgCl2)做催化劑的條件下,氯化氫與乙炔發生加成反應,生成氯乙烯,再在引發劑的作用下,聚合而成聚氯乙烯。
3、漂染工業
例如,棉布漂白後的酸洗,棉布絲光處理後殘留鹼的中和,都要用鹽酸。在印染過程中,有些染料不溶於水,需用鹽酸處理,使成可溶性的鹽酸鹽,才能套用。
4、金屬加工
例如,鋼鐵製件的鍍前處理,先用燒鹼溶液洗滌以除去油污,再用鹽酸浸泡;在金屬焊接之前,需在焊口塗上一點鹽酸等等,都是利用鹽酸能溶解金屬氧化物這一性質,以去掉銹。這樣,才能在金屬表面鍍得牢,焊得牢。
5、食品工業
例如,制化學醬油時,將蒸煮過的豆餅等原料浸泡在含有一定量鹽酸的溶液中,保持一定溫度,鹽酸具有催化作用,能促使其中複雜的蛋白質進行水解,經過一定的時間,就生成具有鮮味的胺基酸,再用苛性鈉(或用純鹼)中和,即得胺基酸鈉。製造味素的原理與此差不多。
6、無機藥品及有機藥物的生產
鹽酸是一種強酸,它與某些金屬、金屬氧化物、金屬氫氧化物以及大多數金屬鹽類(如碳酸鹽、亞硫酸鹽等),都能發生反應,生成鹽酸鹽。因此,在不少無機藥品的生產上要用到鹽酸。在醫藥上好多有機藥物,例如奴佛卡因、鹽酸硫胺(維生素B1的製劑)等,也是用鹽酸製成的。
7、用作酸性清洗腐蝕劑,可與雙氧水配合使用。以鹽酸為主劑進行化學清洗具有作用力強、速度快、效果明顯、使用方便、所需費用低等優點,適用於碳素鋼、銅,但不能用於奧氏體不鏽鋼、鈦等材質的化學清洗。
鑑別檢查
游離氯或溴檢查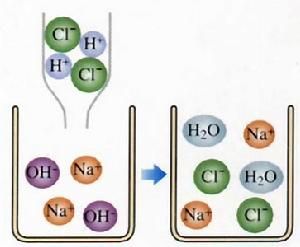 鹽酸
鹽酸硫酸鹽檢查
取該品25g(21ml) ,加碳酸鈉試液2 滴,置水浴上蒸乾;殘渣加水20ml溶解後,依法檢查,與標準硫酸鉀溶液1.25ml製成的對照液比較,不得更濃(0.0005%)。
亞硫酸鹽檢查取新沸過的冷水50ml,加碘化鉀1g、碘滴定液(0.01mol/L)0.15ml 與澱粉指示液1.5ml ,搖勻;另取本品5ml,加新沸過的冷水50ml稀釋後,加至上述溶液中,搖勻,溶液的藍色不得完全消失。熾灼殘渣 取本品100g(85ml),加硫酸2滴,蒸乾後,依法檢查,遺留殘渣不得過2mg(0.002%) 。
鐵鹽檢查取該品10g(8.5ml),置水浴上蒸乾後,殘渣加水25ml,依法檢查(附錄Ⅷ G),與標準鐵溶液1.0ml 製成的對照液比較,不得更深(0.0001%)。
重金屬檢查取該品10g(8.5ml),置水浴上蒸乾後,加醋酸鹽緩衝液(pH3.5)2ml與水適量使成25ml,依法檢查(附錄Ⅷ H第一法),含重金屬不得過百萬分之二。
砷鹽檢查取該品2.0g(1.7ml) ,加水22ml稀釋後,加鹽酸5ml ,依法檢查,應符合規定(0.0001%)。
含量測定取該藥品約3ml,置貯有水約20ml並已精密稱定重量的具塞錐形瓶中,精密稱定,加水25ml與甲基紅指示液2 滴,用氫氧化鈉滴定液(1mol/L)滴定。每1ml氫氧化鈉滴定液(1mol/L)相當於36.46mg 的HCl 。
安全性
危險概述健康危害: 接觸其蒸氣或煙霧,可引起急性中毒,出現眼結膜炎,鼻及口腔黏膜有燒灼感,鼻衄、齒齦出血,氣管炎等。誤服可引起消化道灼傷、潰瘍形成,有可能引起胃穿孔、腹膜炎等。眼和皮膚接觸可致灼傷。慢性影響:長期接觸,引起慢性鼻炎、慢性支氣管炎、牙齒酸蝕症及皮膚損害。
環境危害: 對環境有危害,對水體和土壤可造成污染。
燃爆危險: 本品不燃,具強腐蝕性、強刺激性,可致人體灼傷。
操作防護 鹽酸
鹽酸工程控制: 密閉操作,注意通風。儘可能機械化、自動化。提供安全淋浴和洗眼設備。
呼吸系統防護: 可能接觸其煙霧時,佩戴自吸過濾式防毒面具(全面罩)或空氣呼吸器。緊急事態搶救或撤離時,建議佩戴氧氣呼吸器。
眼睛防護: 呼吸系統防護中已作防護。
手防護: 戴橡膠耐酸鹼手套。身體防護: 穿橡膠耐酸鹼服。
其他防護: 工作現場禁止吸菸、進食和飲水。工作完畢,淋浴更衣。單獨存放被毒物污染的衣服,洗後備用。保持良好的衛生習慣。
應急處理1、泄漏應急處理
應急處理: 迅速撤離泄漏污染區人員至安全區,並進行隔離,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿防酸鹼工作服。不要直接接觸泄漏物。儘可能切斷泄漏源。小量泄漏:用砂土、乾燥石灰或蘇打灰混合。也可以用大量水沖洗,洗水稀釋後放入廢水系統。大量泄漏:構築圍堤或挖坑收容。用泵轉移至槽車或專用收集器內,回收或運至廢物處理場所處置。
2、消防措施
危險特性: 能與一些活性金屬粉末發生反應, 放出氫氣。遇氰化物能產生劇毒的氰化氫氣體。與鹼發生中合反應,並放出大量的熱。具有較強的腐蝕性。
有害燃燒產物: 氯化氫。
滅火方法: 用鹼性物質如碳酸氫鈉、碳酸鈉、消石灰等中和。也可用大量水撲救。
3、急救措施
皮膚接觸: 立即脫去污染的衣著,用大量流動清水沖洗至少15分鐘。就醫。
眼睛接觸: 立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
吸入: 迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入: 用水漱口,給飲牛奶或蛋清。就醫。
儲存運輸
1、儲存注意事項
儲存於陰涼、通風的庫房。庫溫不超過30℃,相對濕度不超過85%。保持容器密封。應與鹼類、胺類、鹼金屬、易(可)燃物分開存放,切忌混儲。儲區應備有泄漏應急處理設備和合適的收容材料。
2、廢棄處置
廢棄處置方法:用鹼液-石灰水中和,生成氯化鈉和氯化鈣,用水稀釋後排入廢水系統。
3、運輸信息
危險貨物編號:81013UN編號:1789包裝類別:O52
包裝方法:耐酸壇或陶瓷瓶外普通木箱或半花格木箱;玻璃瓶或塑膠桶(罐)外普通木箱或半花格木箱;磨砂口玻璃瓶或螺紋口玻璃瓶外普通木箱;螺紋口玻璃瓶、鐵蓋壓口玻璃瓶、塑膠瓶或金屬桶(罐)外普通木箱。
運輸注意事項:本品鐵路運輸時限使用有像膠襯裡鋼製罐車或特製塑膠企業自備罐車裝運,裝運前需報有關部門批准。鐵路運輸時應嚴格按照鐵道部《危險貨物運輸規則》中的危險貨物配裝表進行配裝。起運時包裝要完整,裝載應穩妥。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與鹼類、胺類、鹼金屬、易燃物或可燃物、食用化學品等混裝混運。運輸時運輸車輛應配備泄漏應急處理設備。運輸途中應防曝曬、雨淋,防高溫。公路運輸時要按規定路線行駛,勿在居民區和人口稠密區停留。
藥用輔料
| 藥用輔料是指在製劑處方設計時,為解決製劑的成型性、有效性、穩定性、安全性加入處方中除主藥以外的一切藥用物料的統稱。藥用輔料是藥物製劑的基礎材料和重要組成部分,是保證藥物製劑生產和發展的物質基礎,在製劑劑型和生產中起著關鍵的作用。 |

