基本介紹
二氧化碳
 二氧化碳
二氧化碳中文別名:碳酸氣;碳酸酐;碳酐;乾冰
英文名稱 :Carbonic acid gas; carbon dioxide; carbon dioxide; dry ice
別名:碳酸氣
EINECS:204-696-9
相對密度:1.101(-37 ℃)
沸點(攝氏度):-56.6(0.52MPa)
熔點(攝氏度):-78.5(升華)
CAS號 :124-38-9
EINECS204-696-9
共有3個原子核,22個質子。
收集方法:因其密度比空氣大,且與水反應生成碳酸,所以通常用向上排空氣法收集二氧化碳。
臨界溫度31.1℃ 臨界壓力 7.382MPa
安全術語:
S9Keep container in a well-ventilated place.
保持容器置於良好通風處。
歷史沿革
17世紀初,比利時化學家范·海爾蒙特(J.B. Van. Helmont 1577~1644)在檢測木炭燃燒和發酵過程的副產氣時,發現二氧化碳。
1757年,J. Black第一個套用定量的方法研究這種氣體。
1773年,拉瓦錫(A. L. Lavoisier) 把碳放在氧氣中加熱,得到被他稱為“碳酸”的二氧化碳氣體,測出質量組成為碳23.5~28.9%,氧71.1~76.5%。
1823年,麥可·法拉第(M. Faraday)發現,加壓可以使二氧化碳氣體液化。1835年,M. Thilorier製得固態二氧化碳(乾冰)。
1884年,在德國建成第一家生產液態二氧化碳的工廠。
組成結構
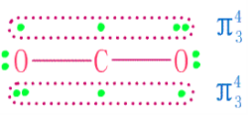 二氧化碳分子結構
二氧化碳分子結構C原子以sp雜化軌道形成δ鍵。分子形狀為直線形。非極性分子。在CO₂分子中,碳原子採用sp雜化軌道與
氧原子成鍵。C原子的兩個sp雜化軌道分別與兩個O原子生成兩個σ鍵。
二氧化碳在常溫常壓下為無色無嗅的氣體。CO₂分子有16個價電子,基態為線性分子,屬D∞h 點群。CO₂分子中碳氧鍵鍵長為116pm,介於碳氧雙鍵(乙醛中C=O鍵長為124pm)和碳氧三鍵(CO分子中C≡O鍵長為112.8pm)之間,說明它已具有一定程度的叄鍵特性。因此,有人認為在CO₂分子中可能存在著離域的大π鍵,即碳原子除了與氧原子形成兩個鍵外,還形成兩個三中心四電子的大π鍵。
C原子上兩個未參加雜化的p軌道與sp雜化軌道成直角,並且從側面同氧原子的p軌道分別肩並肩地發生重疊,生成兩個∏三中心四電子的離域鍵。因此,縮短了碳—氧原子間地距離,使CO₂中碳氧鍵具有一定程度的叄鍵特徵。決定分子形狀的是sp雜化軌道,CO₂為直線型分子式。
空氣中有微量的二氧化碳,約占0.039%。二氧化碳略溶於水中,形成碳酸,碳酸是一種弱酸。
有關方程
由於碳酸很不穩定,容易分解:
 二氧化碳
二氧化碳 二氧化碳
二氧化碳所以,
二氧化碳能與水反應形成碳酸:
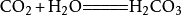 二氧化碳
二氧化碳向澄清的石灰水加入二氧化碳,會使澄清的石灰水變渾濁,生成碳酸鈣沉澱:
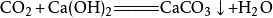 二氧化碳
二氧化碳如果二氧化碳過量會有:
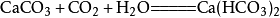 二氧化碳
二氧化碳二氧化碳會使燒鹼變質:
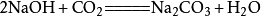 二氧化碳
二氧化碳如果二氧化碳過量:
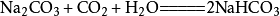 二氧化碳
二氧化碳即:
 二氧化碳
二氧化碳二氧化碳和金屬鎂反應:
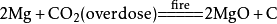 二氧化碳
二氧化碳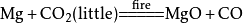 二氧化碳
二氧化碳工業製法:高溫煅燒石灰石:
 二氧化碳
二氧化碳實驗室製法:
 二氧化碳
二氧化碳 二氧化碳
二氧化碳二氧化碳的固定:
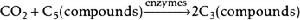 二氧化碳
二氧化碳在光合作用中的暗反應階段,一分子的CO₂和一分子的五碳化合物反應生成兩分子的三碳化合物。
二氧化碳與一氧化碳的互相轉化:
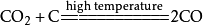 二氧化碳
二氧化碳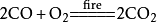 二氧化碳
二氧化碳產生途徑
在自然界中二氧化碳含量豐富,為大氣組成的一部分。二氧化碳也包含在某些天然氣或油田伴生氣中以及碳酸鹽形成的礦石中。大氣里含二氧化碳為0.03~0.04%(體積比),總量約2.75×1012t,主要由含碳物質燃燒和動物的新陳代謝產生。
⑴凡是有機物(包括動植物)在分解、發酵、腐爛、變質的過程中都可釋放出CO₂。
⑵石油、石臘、煤炭、天然氣燃燒過程中,也要釋放出CO₂。
⑶石油、煤炭在生產化工產品過程中,也會釋放出CO₂。
⑷所有糞便、腐植酸在發酵,熟化的過程中也能釋放出CO₂。
⑸所有動物在呼吸過程中,都要吸氧氣吐出CO₂。
⑹所有綠色植物都吸收CO₂釋放出氧氣,進行光合作用。CO₂氣體,就是這樣,在自然生態平衡中,進行無聲無息的循環。
⑺一切工業生產,城市運轉,交通等都離不開排放二氧化碳。
⑻常用關於二氧化碳的化學方程式:
 二氧化碳
二氧化碳碳在充足的氧氣中燃燒:
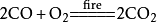 二氧化碳
二氧化碳煤氣工作原理:
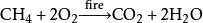 二氧化碳
二氧化碳天然氣工作原理:
 二氧化碳
二氧化碳實驗室用大理石和鹽酸製取二氧化碳:
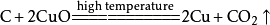 二氧化碳
二氧化碳碳還原氧化銅:
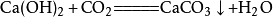 二氧化碳
二氧化碳熟石灰檢驗二氧化碳:
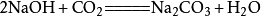 二氧化碳
二氧化碳氫氧化鈉與二氧化碳反應:
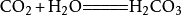 二氧化碳
二氧化碳與水反應:
(參考資料來源:
)
所占比重
二氧化碳CO平均約占大氣體積的387ppm。大氣中的二氧化碳含量隨季節變化,這主要是由於植物生長的季節性變化而導致的。當春夏季來臨時,植物由於光合作用消耗二氧化碳,其含量隨之減少;反之,當秋冬季來臨時,植物不但不進行光合作用,反而製造二氧化碳,其含量隨之上升。二氧化碳常壓下為無色、無味、不支持燃燒、不可燃的氣體,二氧化碳不供給呼吸。是一種溫室氣體因為它傳送可見光,但在強烈吸收紅外線。二氧化碳的濃度於2009年增長了約二百萬分之一。
海洋是地表最重要的儲水庫,也是全球碳的第二大循環系統。通過對海洋循環以及CO₂溶于海水的系統模擬證實,化石燃料燃燒產生的約40%的CO₂會被海洋吸收。海洋中吸收與釋放的CO₂的量旗鼓相當。因此,海洋可被視為地球上最大的CO₂水池,其循環迴路見圖。海洋不僅從大氣中吸收CO₂,同時將其自身儲存的CO₂釋放至大氣中,海洋能作為CO₂的存儲池也是因為其吸收CO₂的量略大於釋放的量。同樣由上文所述,海洋中的碳循環系統巨大,是由許多次級系統組成,容易受環境、人類活動和火山噴發等行為影響。該系統也是也是一個耗能結構,通過消耗太陽能使其能耗維持在一個很高的水平。 海洋可被視作從大氣中吸收CO₂同時釋放出有機碳和碳酸鹽沉澱的非線性的動力系統。由於海洋可以儲存CO₂並輸出CO₂及其鹽類,同時緩衝由於大氣中CO₂濃度的增加所帶來的影響,所以其輸入及輸出關係是非線性的。該系統是自發循環的,生物處理在這樣一個自主的系統中不可或缺。海洋對於CO₂的反饋作用利弊都有,它可以調整大氣的CO₂濃度及熱平衡。因此研究海洋中CO₂的反應過程至關重要。 如果海洋碳庫可被作為一個獨立的系統,土地和大氣看做是環境,河道和大氣中的CO₂及其鹽類,以往由於人類活動造成的污染帶入的碳類以及化石燃料燃燒和森林砍伐所促成的CO₂及其鹽類可認為是系統的碳輸入量。因為該系統規模巨大,成分複雜,很難用傳統的方法來描述其中的過程。
理化性質
物理性質
 二氧化碳
二氧化碳常溫下是一種無色無味氣體,
密度比空氣略大(1.977g/L,所以實驗室收集二氧化碳可用向上排空氣法),能溶於水,沒有閃點,無色無味。
液體狀態表面張力:約3.0dyn/cm
密度:1.816kg/m
粘度:比四氯乙烯粘度低得多,所以液體二氧化碳更能穿透纖維。
二氧化碳分子結構很穩定,化學性質不活潑,不會與織物發生化學反應。
它沸點低(-78.5℃),常溫常壓下是氣體。加壓降溫可得無色CO液體,再降溫可得雪花狀固體,再壓縮可得乾冰,乾冰達到-78.5℃,會升華成為氣體CO,不會形成CO液體。乾冰不是冰,是固態二氧化碳。
化學性質
碳氧化物之一,是一種無機物,不可燃,通常不支持燃燒,無毒性。
和水反應
二氧化碳可以溶於水並和水反應生成碳酸,而不穩定的碳酸容易分解成水和二氧化碳:
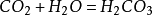 二氧化碳
二氧化碳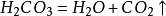 二氧化碳
二氧化碳和鹼性物質反應
二氧化碳可以和氫氧化鈣反應生成碳酸鈣沉澱和水:
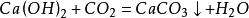 二氧化碳
二氧化碳該反套用於檢驗二氧化碳(將氣體通入澄清石灰水中,澄清石灰水變渾濁)
當二氧化碳過量時,生成碳酸氫鈣:
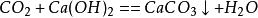 二氧化碳
二氧化碳第一步:
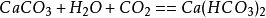 二氧化碳
二氧化碳第二步:
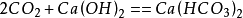 二氧化碳
二氧化碳總方程式:
由於碳酸氫鈣溶解性大,可發現沉澱漸漸消失(長時間往已渾濁的石灰水中通入二氧化碳,沉澱消失)。
和氫氧化鈉反應生成碳酸鈉和水,二氧化碳過量時,生成碳酸氫鈉:
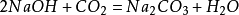 二氧化碳
二氧化碳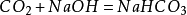 二氧化碳
二氧化碳和活潑金屬在點燃下的反應
二氧化碳本身不支持燃燒,但是會和部分活潑金屬在點燃的條件下反應(如鈉、鉀、鎂)生成相對應的金屬的氧化物和碳:
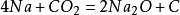 二氧化碳
二氧化碳 二氧化碳
二氧化碳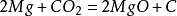 二氧化碳
二氧化碳配伍禁忌
儘管二氧化碳可與多種金屬氧化物或還原性金屬,如鋁、鎂、鈦和鋯發生劇烈的反應,但可與大多數物質配伍。與鈉和鉀的混合物受震時爆炸。
主要危害
人體危害
二氧化碳密度較空氣大,當二氧化碳少時對人體無危害,但其超過一定量時會影響人(其他生物也是)的呼吸,原因是血液中的碳酸濃度增大,酸性增強,並產生酸中毒。空氣中二氧化碳的體積分數為1%時,感到氣悶,頭昏,心悸;4%-5%時感到眩暈。6%以上時使人神志不清、呼吸逐漸停止以致死亡。
因為二氧化碳比空氣重,所以在低洼處的濃度較高。以人工鑿井或挖孔樁時,若通風不良則會造成井底的人員窒息。CO₂的正常含量是0.04%,當CO₂的濃度達1%會使人感到氣悶、頭昏、心悸,達到4%~5%時人會感到氣喘、頭痛、眩暈,而達到10%的時候,會使人體機能嚴重混亂,使人喪失知覺、神志不清、呼吸停止而死亡。應避免之物質:
各種金屬粉塵(例如鎂、鋯、鈦、鋁、錳):當懸浮在二氧化碳中易點燃而爆炸。
水:會形成碳酸。
人吸入高濃度的二氧化碳所出現的昏迷及腦缺氧情況,一般大氣中二氧化碳含量超過1%時,人即有輕度頭暈反應;當超過3%時,開始出現呼吸困難;超過6%時,就會重度缺氧窒息甚至死亡。
| 職業接觸限值 | |
| 中國MAC(mg/m3): | 18000 |
| 前蘇聯MAC(mg/m3): | 未制定標準 |
| TLVTN: | OSHA 5000ppm,9000mg/m3; ACGIH 5000ppm,9000mg/m3 |
| TLVWN: | ACGIH 30000ppm,54000mg/m3 |
| 監測方法: | |
| 工程控制: | 密閉操作。提供良好的自然通風條件。 |
| 呼吸系統防護: | 一般不需要特殊防護,高濃度接觸時可佩戴空氣呼吸器。 |
| 眼睛防護: | 一般不需特殊防護。 |
| 身體防護: | 穿一般作業工作服。 |
| 手防護: | 戴一般作業防護手套。 |
| 其他防護: | 避免高濃度吸入。進入罐、限制性空間或其它高濃度區作業,須有人監護。 |
中毒反應
主要症狀有:頭痛、頭愫暈、耳鳴、氣急、胸悶、乏力、心跳加快,面頰發紺、煩躁、譫妄、呼吸困難,如情況持續,就會出現嗜睡、淡漠、昏迷、反射消失、瞳孔散大、大小便失禁、血壓下降甚至死亡。
二氧化碳的濃度達到1%以上,就會使人頭暈目眩。達到4~5%,人便會噁心嘔吐,呼吸不暢。超過10%,人便會死亡。
二氧化碳在室外是全球暖化;全球變暖的元兇之一,在室內對人體健康影響及行車安全顧慮更是不容忽視的主因之一。生活當中二氧化碳是人類無時無刻 在製造卻經常被忽略的氣體,21新世紀大眾生活型態的改變,尤其現代人害怕噪音再加上戶外空氣品質不佳,人們為求隔絕噪音並享受居住空間或辦公室空間空調系統帶來的舒適便利,長時間將室內窗戶密閉以致於室內二氧化碳濃度含量遠高於室外平均值,更有醫學報導在冷氣房內睡覺連續八小時,由於空氣有適足對流 有助塵蟎滋生,早上會出現鼻塞、皮膚紅癢等「病態建築物症候群」(Sick Building Syndrome)的症狀。
二氧化碳濃度含量會影響人類的生活作息,整理出二氧化碳濃度含量與人體生理反應如下:
·350~450ppm:同一般室外環境
·350~1000ppm:空氣清新,呼吸順暢。
·1000~2000ppm:感覺空氣渾濁,並開始覺得昏昏欲睡。
·2000~5000ppm:感覺頭痛、嗜睡、呆滯、注意力無法集中、心跳加速、輕度噁心。
·大於5000ppm:可能導致嚴重缺氧,造成永久性腦損傷、昏迷、甚至死亡。
血清(血漿)中檢測CO₂的含量是代謝性酸鹼中度的指標之一,基本上代表了血漿中酸鹼鹼儲備的情況。
環境危害
主要是溫室效應。因為二氧化碳具有保溫的作用,會逐漸使地球表面溫度升高。近100年,全球氣溫升高0.6℃,照這樣下去,預計到21世紀中葉,全球氣溫將升高1.5——4.5℃。由溫室效應所引起的海平面升高,也會對人類的生存環境產生巨大的影響。兩極海洋的冰塊也將全部融化。所有這些變化對野生動物而言無異於滅頂之災。
截至2013年5月,地球大氣層中的二氧化碳濃度已超過400 ppm(百萬分之400)。2000至2009年間的濃度增長率為每年2.0 ppm,且逐年加速。濃度比工業化之前的280 ppm濃度高得多,而人為因素是導致二氧化碳濃度急劇上升的主要原因。釋放出的二氧化碳中,57%進入大氣層,其餘的則進入海洋,造成海洋酸化。
多達四成的地面二氧化碳排放是由於火山爆發。據估計,每年火山爆發釋放約130-230萬公噸(145-255萬噸)二氧化碳到大氣中。溫泉等也產生大量二氧化碳。在義大利的一個城市,當地的二氧化碳濃度一夜之間上升到75%以上,足以殺死昆蟲和小動物,但在白天當陽光照射因為升溫相當快,導致氣體對流而分散。人類排放的二氧化碳超過火山爆發排放量130倍以上:一年270億公噸。
 二氧化碳的危害
二氧化碳的危害地球上氣溫越來越高,是因為二氧化碳增多造成的。因為二氧化碳具有保溫的作用,這一群體的成員越來越多,使溫度升高,近100年,全球氣溫升高0.6℃,照這樣下去,預計到2
1世紀中葉,全球氣溫將升高1.5——4.5℃。
海平面升高,也是二氧化碳增多造成的,近100年,海平面上升14厘米,到21世紀中葉,海平面將會上升25——140厘米,海平面的上升,亞馬遜雨林將會消失,兩極海洋的冰塊也將大部分融化。所有這些變化對野生動植物而言無異於滅頂之災。
空氣中一般含有約0.03%二氧化碳,但由於人類活動(如化石燃料燃燒)影響,二氧化碳含量猛增,導致溫室效應、全球氣候變暖、冰川融化、海平面升高……旨在遏制二氧化碳過量排放的《京都議定書》已經生效,有望通過國際合作遏制溫室效應。
預防措施
打開門窗、通風孔,搶救者才可進入。將病人救出後,在空氣新鮮處進行人工呼吸,心臟按摩,吸氧(避免高壓、高流量、高濃度給氧,以免呼吸中樞更為抑制),開始1~2L/分,隨病人呼吸好轉逐漸增大給氧量(4--5L/分),以至採用高壓氧治療。(最好是純氧)
吸入興奮劑:多種興奮劑交替、聯合使用,如洛貝林、等
防止腦和肺水腫:套用脫水劑、激素,限制液量和速度,吸入鈉的份量亦應限制
對症治療:給予多種維生素、細胞色素C、能量合劑、高滲糖,以防感染
搶救同時要留意有沒有其他有毒氣體存在,如一氧化碳等。
製取方法
工業製法
高溫煅燒石灰石
 二氧化碳
二氧化碳實驗製取
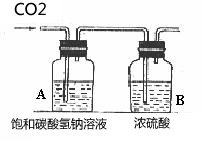
大理石或石灰石和鹽酸反應通常需要對氣體進行除雜乾燥,鹽酸反應時會揮發出氯化氫(HCl)氣體,所以要通過飽和碳酸氫鈉(NaHCO3)溶液除去氣體中的氯化氫。溶液中的反應,氣體溢出時會帶出水蒸氣,所以要求嚴格或必要時要對氣體進行乾燥,通常用裝有濃硫酸的洗氣瓶進行乾燥。由於二氧化碳密度比空氣大,易溶於水,所以採用向上排空氣法。
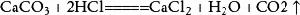 二氧化碳
二氧化碳 二氧化碳
二氧化碳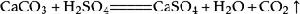 二氧化碳
二氧化碳另外,不能用碳酸鈉和鹽酸反應製取,因為反應速率太快,不易收集;不能用碳酸鈣和濃鹽酸反應,因為濃鹽酸易揮發出大量氯化氫氣體,使碳酸氫鈉無法完全去除,製得的二氧化碳純度會下降;也不能用碳酸鈣和稀硫酸反應收集,因為反應會生成難溶的硫酸鈣,硫酸根會附著在碳酸鈣表面,使碳酸鈣無法與酸接觸,影響反應的繼續。附:
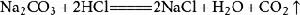 二氧化碳
二氧化碳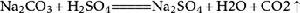 二氧化碳
二氧化碳(上文實驗室不適用的三種方法)
化學詩歌
實驗室制二氧碳,大理石與稀鹽酸。兩種蘇打皆不用,速度太快控制難。
不用硫酸代鹽酸,鎂鹽不如鈣鹽廉。硝酸見光易分解,驗滿瓶口火不燃。
 二氧化碳
二氧化碳反應式:
解釋:
 title
title1、實驗室制二氧碳,
大理石與稀鹽酸:“二氧碳”指二氧化碳。意思是說在實驗室中是用大理石(CaCO₃)和稀鹽酸反應來製取二氧化碳。
2、兩種蘇打皆不用,速度太快控制難:“兩種蘇打”特指蘇打(Na₂CO₃)和小蘇打(NaHCO₃)。這兩句的意思是說不能用Na₂CO₃和NaHCO₃代替CaCO₃跟鹽酸反應來製取CO₂,是因為Na₂CO₃和NaHCO₃跟鹽酸反應的速度太快,產生的CO₂很快逸出,不易控制,也不便於操作。
3、不用硫酸代鹽酸:意思是說不能用稀硫酸代替鹽酸。因為稀硫酸跟大理石(CaCO₃)反應,則生成了微溶入水的硫酸鈣(CaSO₄)沉澱復蓋在大理石的表面上,阻礙了反應的繼續進行,而使反應非常緩慢。
4、鎂鹽不如鈣鹽廉:“鎂鹽”指MgCO₃;“鈣鹽”指CaCO₃,意思是說不能用MgCO₃代CaCO₃,因為雖然MgCO₃跟鹽酸與CaCO₃跟鹽酸反應相似,但由於MgCO₃的來源較少,不如CaCO₃廉價易得。
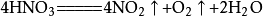 二氧化碳
二氧化碳5、硝酸見光易分解:意思是說不能用硝酸代替鹽酸,因為硝酸見光易分解(
),若用硝酸代替鹽酸,則製得的CO₂中就會有少量的NO₂和O₂。此外,硝酸的價格較鹽酸貴,故通常不用硝酸代替鹽酸。
6、鑑別火柴不能燃:意思是說因為CO₂能滅火,故可以將燃著的火柴置於集氣瓶口檢驗,若火焰熄滅,則證明CO₂已經充滿了集氣瓶。
民間製法
小蘇打(碳酸氫鈉)和白醋反應
 二氧化碳
二氧化碳臨界萃取
現國內外正在致力於發展一種新型二氧化碳利用技術── CO₂超臨界萃取技術。運用該技術可生產高附加值的產品,可提取過去用化學方法無法提取的物質,且廉價、無毒、安全、高效。它適用於化工、醫藥、食品等工業。
二氧化碳在溫度高於臨界溫度(Tc)31℃、壓力高於臨界壓力(Pc)3MPa的狀態下,性質會發生變化,其密度近於液體,粘度近於氣體,擴散係數為液體的100倍,因而具有驚人的溶解能力,用它可溶解多種物質,然後提取其中的有效成分,具有廣泛套用。
傳統提取有效成份的方法如水蒸汽蒸餾法、減壓蒸餾法、溶劑萃取法等,但工藝複雜、純度不高,而且易殘留有害物質。而二氧化碳超臨界萃取廉價、無毒、安全、高效,可以生產極高附加值的產品。用超臨界CO₂萃取法可以從許多種植物中提取其有效成分,而這些成分過去用化學方法是提取不出來的。除了用在化工、化工等工業外,還可用在菸草、香料、食品等方面。如食品中,可以用來去除咖啡、茶葉中的咖啡因,可提取大蒜素、胚芽油、沙棘油、植物油以及醫藥用的鴉片、阿托品、人參素、蝦青素(英文稱astaxanthin,簡稱ASTA)及銀杏葉、紫杉中的有價值成分。以下舉例簡單介紹一下該技術的套用。
提取辣椒中的紅色素
用超臨界方法萃取的紅色素沒有一絲辣味,副產品主要是辣味素,只要加入90%的熟植物油即可製成辣椒油。一年能收回投資。1991年以來,在日本每年需要辣椒紅色素30噸,每公斤價3萬日元,年銷售額9億日元。中國化學方法生產的辣椒紅色素每年60噸,但色價太低又有辣味,出口困難。中國色素套用也呈直線上升趨勢,因此生產色素有極光明的前景。除辣椒色素外,設備還可使用於紅花色素、蝦青素等。
提取茶葉中的茶多酚
安徽、雲南、四川、湖北等省盛產茶葉,可以將質次的碎茶葉末或次茶生產茶多酚及咖啡因。茶多酚是極優良的抗氧化劑,廣泛用於食品和化妝品等方面,已發現茶多酚有抗齲殺菌作用,在醫學方麵茶多酚可以有降膽固醇、降血壓、降血脂、延緩衰老作用,因此是一種優良的天然食品添加劑。用化學方法提取的茶多酚比不上用CO₂超臨界萃取法生產的茶多酚純淨,因此在大量種植茶葉的地區上此項目,一定有較大的經濟效益。此外咖啡因也是常用的藥品,這將使過去認為無用的次品,轉變成高附加值的產品。100噸茶葉末可以提取5噸茶多酚,產值近千萬元。
提取銀杏黃酮、內酯
用超臨界萃取設備杏從銀可粗提物中精提銀杏黃酮、內酯。銀杏葉粗提物成本年需2000萬元,超臨界萃取設備工藝投資300萬元,產值就可達到2900萬元。一年內可收回投資並有600萬元收益,第二年可獲毛利900萬元。
提取桂花精和米糖油
如用超臨界萃取技術提取桂花精油,每千克油在國際市場上售價可達3000美元。一瓶25mL裝的香水只需桂花精油5~6滴。由超臨界流體浸制的米糠油是一種相當純的天然高品質油。米糠油中所含的甾醇(高達0.75%)可化學合成甾醇激素,其產品包括:雄性荷爾蒙、雌性荷爾蒙、避孕藥、利尿劑、抗癌劑。這些產品在醫藥工業中占有重要的地位和極高的經濟價值。甾族藥物的生產,在世界範圍內是一個40億美元的產業,而米糠油是合成甾醇藥的最佳原料。
國外在生產香精和啤酒花方面已採用了CO₂超臨界萃取技術。中國有豐富的自然資源,超臨界萃取技術有極大的推廣價值。有些交通不發達的山區,特產資源十分豐富,尤其盛產中草藥材。處理這些藥材,要用相當大的裝置,且運輸不便,如能在這些山區建立CO₂超臨界萃取設備,可用以提取中藥中最為有用的精華部分,這不僅減少了大量的運輸成本,而且極大地增加了中藥的附加值,可開發生產出更多的醫藥新產品。五超臨界CO₂流體提取蝦青素的工藝研究。
用超臨界 CO₂流體萃取技術從蝦殼中提取蝦青素,通過試驗得到最佳萃取工藝參數為萃取壓力40MPa,萃取溫度60℃提取率可達到805%,皂化反應KOH的濃度為100mg/mL,反應時間是3h,通過液相色譜分離技術可以得到高純度的蝦青素。
蝦青素(astaxanthin)是一種天然的油溶性色素在食品添加劑、水產養殖、化妝品、保健品和醫藥工業方面有廣闊的套用前景[1~6]。蝦青素的提取方法很多,如乙醇提取、丙酮提取、二氯甲烷提取等但這些方法存在有機溶劑殘留,對人體健康造成傷害。超臨界CO₂流體提取法操作簡便無環境污染。(見擴展閱讀)六採用CO₂超臨界萃取技術可利用的資源。國內外採用CO₂超臨界萃取技術可利用的資源有:紫杉、黃芪、人參葉、蝦青素、大麻、香獐、青蒿草、銀杏葉、川貝草、桉葉、玫瑰花、樟樹葉、茉莉花、花椒、八角、桂花、生薑、大蒜、辣椒、桔柚皮、啤酒花、芒草、香茅草、鼠尾草、迷迭香、丁子香、豆蔻、沙棘、小麥、玉米、米糠、魚、菸草、茶葉、煤、廢油等。北京、山東、湖南、廣西、浙江、江蘇、湖北(荊州市天然蝦青素有限公司)等地的一些科研所、院校和醫藥、食品企業都在積極進行超臨界萃取技術的研究套用,並取得了一批可喜的成果。中科院廣州化學研究所與南方麵粉集團聯合設計、製造、安裝的200L大型超臨界和工業試驗裝置,作為“八五”國家科技投資項目,已於1996年1月24日通過國家科委組織驗收,正式投入運行。
加工方法
目前最普遍的乾洗技術是採用烴類(石油類)、氯代烴(如四氯乙烯)作為溶劑。但石油溶劑閃點低,易爆易燃,乾燥慢;氯代烴氣味刺鼻,毒性較高(一般在空氣中的含量限制在50ppm以下)。乾洗行業特別是歐美一些國家一直在尋找一種既清潔衛生安全高效的洗滌溶劑,煤炭最新推出的有綠色大地(Greenearth)、RYNEX、以及液體二氧化碳等新型清洗劑。Greenearth是一種清澈無味的液體,KB值(洗淨率)與石油溶劑接近,但低於四氯乙烯,而且價格昂貴;RYNEX的KB值與四氯乙烯差不多,但含水量較高,而且蒸發太慢,不容易再生和回收,乾洗周期長;液體二氧化碳KB值比石油溶劑高,略低於四氯乙烯,但在滲色、防污物再凝集等方面比四氯乙烯更好。
二氧化碳作為生命活動的代謝產物和工業副產品存在於自然界中,主要來源於火力發電、建材、鋼鐵、化工、汽車尾氣及天然二氧化碳氣田,它是造成“溫室效應”的主要氣體。液體二氧化碳乾洗溶劑是一種工業副產品,只是在其回歸自然之前被利用一下,並沒有增加大氣中二氧化碳的濃度。中國二氧化碳排放量為全球第二(大約30億噸),為了充分利用這一資源,中國成立了許多研究課題。
衍生產品
聚合材料
一種正在研究的新型合成材料,以二氧化碳為單體原料在雙金屬配位PBM型催化劑作用下,被活化到較高的程度時,與環氧化物發生共聚反應,生成脂肪族聚碳酸酯(PPC),經過後處理,就得到二氧化碳樹脂材料。在聚合中加入其它反應物,可以得到各種不同化學結構的二氧化碳樹脂。二氧化碳共聚物具有柔性的分子鏈,容易通過改變其化學結構來調整其性能;較易在熱、催化劑、或微生物作用下生分解,但也可以通過一定的措施加以控制:對氧和其它氣體有很低的透過性。可開發出以下用途的產品:1.從脂肪族聚碳酸酯與多異氰酸酯製備聚氨酯材料,優於普通聚酯聚氨酯的耐水解性能。2.用順丁烯二酸酐作為第三單體進行三元共聚;產物是一種含碳酸酯基和酯基的不飽和樹脂,可交聯固化,亦能與纖維之類固體複合,是類似於普通不飽和聚酯使用的一種新材料。3.脂肪族聚碳酸酯可以與各種聚合物共混而獲得各種不同的性能。可以用作環氧樹脂、PVC塑膠等的增韌劑、增塑劑或加工助劑。4.二氧化碳、環氧乙烷等的共聚物,二氧化碳、環氧丙烷和琥珀酸酐的三元共聚物能被微生物徹底分解,不留殘渣,是一類有希望的生物降解材料。5.二氧化碳共聚物有優異的生物體相容性。特別設計的共聚物可望用作抗凝血材料或用作藥物緩釋劑。6.某些型耐油橡膠的成本可比用純丁腈降低10%左右,每噸產品的成本可降低1000元以上。
氣體肥料
一定範圍內,二氧化碳的濃度越高,植物的光合作用也越強,因此二氧化碳是最好的氣肥。美國科學家在新澤西州的一家農場裡,利用二氧化碳對不同作物的不同生長期進行了大量的試驗研究,他們發現二氧化碳在農作物的生長旺盛期和成熟期使用,效果最顯著。在這兩個時期中,如果每周噴射兩次二氧化碳氣體,噴上4~5次後,蔬菜可增產90%,水稻增產70%,大豆增產60%,高粱甚至可以增產200%。
氣肥發展前途很大,但目前科學家還難以確定每種作物究竟吸收多少二氧化碳後效果最好。
德國地質學家埃倫斯特發現,凡是在有地下天然氣冒出來的地方,植物都生長得特別茂盛。於是他將液化天然氣通過專門管道送入土壤,結果在兩年之中這種特殊的氣體肥料都一直有效。原來是天然氣中的主要成分甲烷燃氣起的作用,甲烷用於幫助土壤微生物的繁殖,而這些微生物可以改善土壤結構,幫助植物充分地吸收營養物質。
乾冰
介紹
固態二氧化碳壓縮後又叫乾冰,零下75℃乾冰升華,可以吸收周圍的熱量,使周圍水汽凝結,就生成了一種雲霧繚繞的景象,同時周圍溫度迅速降低,因此乾冰常用於低溫保存物品。
乾冰的使用範圍廣泛,在食品、衛生、工業、餐飲中、人工降雨有大量套用。主要有:
1.乾冰在工業模具的套用範圍
輪胎模具、橡膠模具、聚氨酯模、聚乙烯模、PET模具、泡沫模具、注塑模具、合金壓鑄模、鑄造用熱芯盒、冷芯盒,可清除余樹脂、失效脫膜層、炭化膜劑、油污、打通排氣孔,清洗後模具光亮如新。
 乾冰
乾冰線上清洗,無需降溫和拆卸模具,避免了化學清洗法對模具的腐蝕和損害、機械清洗法對模具的機械損傷及劃傷,以及反覆裝卸導致模具精度下降等缺點。關鍵的是,可以免除拆卸模具及等待模具降溫這兩項最耗時間的步驟,這樣均可以減少停工時間約80%-95%。
乾冰清洗益處:乾冰清洗可以降低停工工時;減少設備損壞;極有效的清洗高溫的設備;減少或降低溶劑的使用;改善工作人員的安全;增進保養效率;減少生產停工期、降低成本、提高生產效率。
2.乾冰在石油化工的套用範圍
清洗主風機、氣壓機、煙機、汽輪機、鼓風機等設備及各式加熱爐、反應器等結焦結炭的清除。清洗換熱器上的聚氯乙烯樹脂;清除壓縮機、儲罐、鍋爐等各類壓力容器上的油污、銹污、烴類及其表面污垢;清理反應釜、冷凝器;複雜機體除污;爐管清灰等。
3.乾冰在食品製藥的套用範圍
可以成功去除烤箱中烘烤的殘渣、膠狀物質和油污以及未烘烤前的生鮮製品混合物。有效清潔烤箱、混合攪拌設備、輸送帶、模製品、包裝設備、爐架、爐盤、容器、輥軸、冷凍機內壁、餅乾爐條等。
乾冰清洗的益處:排除有害化學藥劑的使用,避免生產設備接觸有害化學物和產生第二次垃圾;擬制或除掉沙門氏菌、利斯特菌等細菌,更徹底的消毒、潔淨;排除水刀清洗對電子設備的損傷;最小程度的設備分解;降低停工時間。
4.乾冰在印刷工業的套用範圍
清除油墨很困難,齒輪和導軌上的積墨會導致低劣的印刷質量。乾冰清洗可去除各種油基、水基墨水和清漆,清理齒輪、導軌及噴嘴上的油污、積墨和染料,避免危險廢物和溶液的排放,以及危險溶劑造成的人員傷害。
5.乾冰在電力行業的套用範圍
可對電力鍋爐、凝汽器、各類換熱器進行清洗;可直接對室內外變壓器、絕緣器、配電櫃及電線、電纜進行帶電載負荷(37kV以下)清洗;發電機、電動機、轉子、定子等部件無破損清洗;汽輪機、透平上葉輪、葉片等部件銹垢、烴類和粘著粉末清洗,不需拆下槳葉,省去重新調校槳葉的動平衡。
乾冰清洗的益處:使被清洗的污染物有效地分解;由於這些污染物被清除減少了電力損失;減少了外部設備及其基礎設備的維修成本;提高電力系統的可靠性;非研磨清洗,保持絕緣體的完整;更適合預防性的維護保養。
6.乾冰在汽車工業的套用範圍
清洗門皮、蓬頂、車廂、車底油污等無水漬,不會引致水污染;汽車化油器清洗及汽車表面除漆等;清除引擎積碳。如處理積碳,用化學藥劑處理時間長,最少要用48小時以上,且藥劑對人體有害。乾冰清洗可以在10分鐘以內徹底解決積碳問題,即節省了時間又降低了成本,除垢率達到100%。
7.乾冰在電子工業的套用範圍
清潔機器人、自動化設備的內部油脂、污垢;積體電路板、焊後焊藥、污染塗層、樹脂、溶劑性塗復、保護層以及印刷電路板上光敏抗腐蝕劑等清除。
8.乾冰在航空航天的套用範圍
飛彈、飛機噴漆和總裝的前置工序;複合模具、特殊飛行器的除漆;引擎積碳清洗;維修清洗(特別是起落架-輪倉區);飛機外殼的除漆;噴氣發動機轉換系統。可直接在機體工作,節省時間。
9.乾冰在船舶業的套用範圍
船殼體;海水吸入閥;海水冷凝器和換熱器;機房、機械及電器設備等,比一般用高壓水射流清洗更乾淨。
10.乾冰在核工業的套用範圍
核工業設備的清洗若採用水、噴砂或化學淨化劑等傳統清洗方法,水、噴砂或化學淨化劑等介質同時也被放射性元素污染,處理被二次污染的這些介質需要時間和資金。而使用乾冰清洗工藝,乾冰顆粒直接噴射到被清洗物體,瞬間升華,不存在二次污染的問題,需要處理的僅僅是被清洗掉的有核污染的積垢等廢料。
11.乾冰在美容行業的套用範圍
有的皮膚科醫生用乾冰來治療青春痘,這種治療就是所謂的冷凍治療。因為它會輕微的把皮膚冷凍。
有一種治療青春痘的冷凍材料就是混合磨碎的乾冰及乙酮,有時候會混合一些硫磺。液態氮及固態乾冰也可以用來作冷凍治療的材料。冷凍治療可以減少發炎,前段時間新聞報導劉翔就是用這種冷凍療法來治療臉上的青春痘的。這種方法可以減少青春痘疤痕的產生,但並不用來去除疤痕。
12.乾冰在食品行業的套用範圍
a 在葡萄酒、雞尾酒或飲料中加入乾冰塊,飲用時涼爽可口,杯中煙霧繚繞,十分怡人。
b 製作冰淇淋時加入乾冰,冰淇淋不易融化。乾冰特別適合外賣冰淇淋的冷藏。
c 星級賓館、酒樓製作的海鮮特色菜餚,在上桌時加入乾冰,可以產生白色煙霧景觀,提高宴會檔次,如製作龍蝦刺身。
d 龍蝦、蟹、魚翅等海產品冷凍冷藏。乾冰不會化水,較水、冰冷藏更清潔、乾淨,在歐、美、日本等國得到廣泛套用。
13.乾冰在冷藏運輸領域的套用範圍
a 低溫冷凍醫療用途以及血漿、疫苗等特殊藥品的低溫運輸。
b 電子低溫材料,精密元器件的長短途運輸。
c 高檔食品的保鮮運輸如高檔牛羊肉等。
14 、乾冰在娛樂領域的套用範圍
廣泛用於舞台、劇場、影視、婚慶、慶典、晚會效果等製作放煙,如國家劇院的部分節目就是用乾冰來製作效果的。
15.乾冰在消防行業的套用範圍
乾冰用來作消防滅火,如部分低溫滅火器,但乾冰在這一塊的套用較少,也即市場程度較低。
乾冰使用注意事項:
切記在每次接觸乾冰的時候,一定要小心並且用厚綿手套或其他遮蔽物才能觸碰乾冰,如果是在長時間直接碰觸肌膚的情況下,就可能會造成細胞冷凍而類似輕微或極度嚴重凍傷的傷害。
滅火器
二氧化碳滅火器 的使用方法
 滅火器
滅火器滅火時只要將滅火器提到或扛到火場,在距燃燒物5米左右,放下滅火器拔出保險銷,一手握住喇叭筒根
部的手柄,另一隻手緊握啟閉閥的壓把。對沒有噴射軟管的二氧化碳滅火器,應把喇叭筒往上板70-90度。使用時,不能直接用手抓住喇叭筒外壁或金屬連線管,防止手被凍傷。滅火時,當可燃液體呈流淌狀燃燒時,使用者將二氧化碳滅火劑的噴流由近而遠向火焰噴射。如果可燃液體在容器內燃燒時,使用者應將喇叭筒提起。從容器的一側上部向燃燒的容器中噴射。但不能將二氧化碳射流直接衝擊可燃液面,以防止將可燃液體衝出容器而擴大火勢,造成滅火困難。
推車式二氧化碳滅火器一般由兩人操作,使用時兩人一起將滅火器推或拉到燃燒處,在離燃燒物10米左右停下,一人快速取下喇叭筒並展開噴射軟管後,握住喇叭筒根部的手柄,另一人快速按逆時針方向鏇動手輪,並開到最大位置。滅火方法與手提式的方法一樣。
使用二氧化碳滅火器時,在室外使用的,應選擇在上風方向噴射。在室外內窄小空間使用的,滅火後操作者應迅速離開,以防窒息。
滅火原理及適用火災類型
適用於撲救一般B類火災,如油製品、油脂等火災,也可適用於A類火災,但不能撲救B類火災中的水溶性可燃、易燃液體的火災,如醇、酯、醚、酮等物質火災;也不能撲救C類和D類火災(其主要依靠窒息作用和部分冷卻作用滅火)。
氣體二氧化碳用於制鹼工業、製糖工業,並用於鋼鑄件的淬火和鉛白的製造等。
二氧化碳在焊接領域套用廣泛。
如:二氧化碳氣體保護焊,是目前生產中套用最多的方法
 鎂在二氧化碳中燃燒
鎂在二氧化碳中燃燒固態二氧化碳俗稱乾冰,升華時可吸收大量熱,因而用作製冷劑,如人工降雨,也常在
舞台中用於製造煙霧。二氧化碳一般不燃燒也不支持燃燒,常溫下密度比空氣略大,受熱膨脹後則會聚集於上方。也常被用作滅火劑但Mg、Na、K等燃燒時不能用CO2來滅火,因為:
、
、
。
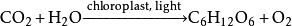 二氧化碳
二氧化碳二氧化碳是綠色植物光合作用不可缺少的原料,溫室中常用二氧化碳作肥料。光合作用總反應:
(chloroplast是葉綠體)。注意:光合作用釋放的氧氣全部來自水,光合作用的產物不僅是糖類,還有胺基酸(無蛋白質)、脂肪,因此光合作用產物應當是有機物。
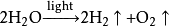 二氧化碳
二氧化碳各步分反應:
(水的光解) 、
(遞氫)、
(遞能) 、
(二氧化碳的固定)、
、
(有機物的生成)
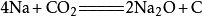 二氧化碳
二氧化碳二氧化碳還可用於製取金剛石,反應的化學方程式為
,反應的條件為440℃及800個大氣壓,在這樣的條件下,二氧化碳會形成超流體,能夠吸附在鈉的表面,加速電子從鈉傳遞至二氧化碳的過程。當溫度降低至400℃時,就沒有金剛石的產生了,當壓力下降時,生成物也主要以石墨為主。
液體二氧化碳密度1.1g/cm³。液體二氧化碳蒸發時或在加壓冷卻時可凝成固體二氧化碳,俗稱乾冰,是一種低溫致冷劑,密度為1.56克/厘米。二氧化碳能溶於水,20℃時每100體積水可溶88體積二氧化碳,一部分跟水反應生成碳酸。化學性質穩定,沒有可燃性,一般不支持燃燒,但活潑金屬可在二氧化碳中燃燒,如點燃的鎂條可在二氧化碳中燃燒生成氧化鎂和碳。二氧化碳是酸性氧化物,可跟鹼或鹼性氧化物反應生成碳酸鹽。跟氨水反應生成碳酸氫銨。無毒,但空氣中二氧化碳含量過高時,也會使人因缺氧而發生窒息。綠色植物能將二氧化碳跟水在光合作用下合成有機物。二氧化碳可用於製造碳酸氫銨、小蘇打、純鹼、尿素、鉛白顏料、飲料、滅火器以及鑄鋼件的淬火。二氧化碳在大氣中約占總體積的0.03%,人呼出的氣體中二氧化碳約占4%。實驗室中常用鹽酸跟大理石反應製取二氧化碳,工業上用煅燒石灰石或釀酒的發酵氣中來獲得二氧化碳。
固態的二氧化碳(或乾冰)在常溫下會氣化,吸收大量的熱,因此可用在急速的食品冷凍。
二氧化碳也可用作焊接用的保護氣體,其保護效果不如其他惰性氣體(如氬),但價格相對便宜許多。
二氧化碳雷射是一種重要的工業雷射來源。二氧化碳是植物光合作用的主要碳源,可以用作植物溫室的氣體肥料和水草缸水族箱的肥料。
二氧化碳可用來釀酒,二氧化碳氣體創造一個缺氧的環境,有助於防止細菌在葡萄生長。
二氧化碳可控制pH值,游泳池加入二氧化碳以控制pH值,加入二氧化碳從而保持pH值不上升。
二氧化碳可用於制鹼工業和製糖工業。
二氧化碳可用於塑膠行業的發泡劑。
乾冰可以用於人造雨、舞台的煙霧效果、食品行業、美食的特殊效果等。
乾冰可以用於清理核工業設備及印刷工業的版輥等。
乾冰可以用於汽車、輪船、航空、太空與電子工業。
冷媒
減少二氧化碳這一種溫室氣體的排放,能有助於減輕地球的溫室效應。但二氧化碳同時也是製冷空調行業的天然製冷劑之一,其在製冷行業的廣泛使用,恰恰能減少溫室效應(GWP=1),還不破壞臭氧層。如此看似矛盾的雙重身份,其實一點也不矛盾,但二氧化碳被作為製冷劑使用,已經有百多年的歷史了。
而二氧化碳的套用發展也來越成熟,全球零部件與系統供應商,包括丹佛斯、卡樂、恩布拉科、路偉、愛默生以及GMCC美芝等,都順應了這個潮流,已經為商業部門提供了二氧化碳解決方案。
二氧化碳的研究和套用主要集中於三個方面:一方面是汽車空調領域,由於製冷劑排放量大,對環境的危害也大,必須儘早採用對環境無危害的製冷劑;第二方面是熱泵熱水器,二氧化碳在超臨界條件下放熱存在一個相當大的溫度滑移,有利於將熱水加熱到一個更高的溫度;第三方面是考慮到二氧化碳良好的低溫流動性能和換熱特性,採用它作為復疊製冷循環低溫級製冷劑。
套用領域
在國民經濟各部門,二氧化碳有著十分廣泛的用途。二氧化碳產品主要是從合成氨制氫氣過程氣、發酵氣、石灰窯氣、酸中和氣、乙烯氧化副反應氣和煙道氣等氣體中提取和回收,商用產品的純度不低於99%(體積)。
二氧化碳可注入飲料中,增加壓力,使飲料中帶有氣泡,增加飲用時的口感,像汽水、啤酒均為此類的例子。
固態的二氧化碳(或乾冰)在常溫下會氣化,吸收大量的熱,因此可用在急速的食品冷凍。
二氧化碳的重量比空氣重,不助燃,因此許多滅火器都通過產生二氧化碳,利用其特性滅火。而二氧化碳滅火器是直接用液化的二氧化碳滅火,除上述特性外,更有滅火後不會留下固體殘留物的優點。
二氧化碳也可用作焊接用的保護氣體,其保護效果不如其他稀有氣體(如氬),但價格相對便宜許多。
二氧化碳雷射是一種重要的工業雷射來源。
二氧化碳可用來釀酒,二氧化碳氣體創造一個缺氧的環境,有助於防止細菌在葡萄生長。
二氧化碳可控制pH值,游泳池加入二氧化碳以控制pH值,加入二氧化碳從而保持pH值不上升。
二氧化碳可用於制鹼工業和製糖工業。
二氧化碳可用於塑膠行業的發泡劑。
乾冰可以用於人造雨、舞台的煙霧效果、食品行業、美食的特殊效果等。
乾冰可以用於清理核工業設備及印刷工業的版輥等。
乾冰可以用於汽車、輪船、航空、太空與電子工業。液體二氧化碳通過減壓變成氣體很容積和織物分離,完全省去了用傳統溶劑帶來的複雜後處理過程。液體CO₂和超臨界CO₂均可作為溶劑,儘管超臨界CO₂具有比液體CO₂更高的溶解性(具有與液體相近的密度和高溶解性,併兼備氣體的低粘度和高滲透力)。但它對設備的要求比液體CO₂高。綜合考慮機器成本與作CO₂為溶劑,溫度控制在15℃左右,壓力在5MPa左右。
藥用功能
藥理
低濃度時為生理性呼吸興奮藥。當空氣中該品含量超過正常(0.03%)時,能使呼吸加深加快;如含量為1%時,能使正常人呼吸量增加25%;含量為3%時,使呼吸量增加2倍。但當含量為25%時,則可使呼吸中樞麻痹,並引起酸中毒, 故吸入濃度不宜超過10%。
適應症
臨床多以該品5~7%與93~95%的氧混合吸入, 用於急救溺斃、嗎啡或一氧化碳中毒者、新生兒窒息等。乙醚麻醉時,如加用含有3~5% 該品的氧氣吸入,可使麻醉效率增加,並減少呼吸道的刺激。
用法用量
遵醫囑。25%高濃度吸入可使呼吸中樞麻痹,引起酸中毒。吸入濃度不超過10%。
不良反應
25%高濃度吸入可使呼吸中樞麻痹引起酸中毒.吸入濃度不超過10%。
二氧化碳導致呼吸性中毒
⑴低濃度的二氧化碳可以興奮呼吸中樞,便呼吸加深加快。高濃度二氧化碳可以抑制和麻痹呼吸中樞。
⑵由於二氧化碳的彌散能力比氧強25倍,故二氧化碳很容易從肺泡彌散到血液造成呼吸性酸中毒。
臨床上很少見單純的二氧化碳中毒,由於空氣中二氧化碳增多,常伴隨氧濃度降低。比如:地窖中儲存的蔬菜、水果呼吸時產生二氧化碳,同時消耗了氧氣。無防護措施進入地窖所發生之中毒,是高濃度二氧化碳和缺氧造成的。試驗證明氧充足的空氣中二氧化碳濃度為5%時對人尚無害;但是,氧濃度為17%以下的空氣中含4%二氧化碳,即可使人中毒。缺氧可造成肺水腫、腦水腫、代謝性酸中毒、電解質紊亂、休克、缺氧性腦病等。
測定方法
節選自國家標準《公共場所空氣中二氧化碳測定方法 GB/T 18204.24-2000》
1、範圍
本標準規定了公共場所空氣中二氧化碳濃度的測定方法。
本標準適用於公共場所空氣中二氧化碳濃度的測定。
第一法不分光紅外線氣體分析法
2、 原理
二氧化碳對紅外線具有選擇性的吸收。在一定範圍內,吸收值與二氧化碳濃度呈線性關係。根據吸
收值確定樣品中二氧化碳的濃度。
3、 試劑和材料
3.1變色矽膠:於12℃乾燥2h
3.2無水氯化鈣D分析純。
3.3 高純氮氣D純度99.99%。
3.4燒鹼石棉D分析純。
3.5塑膠鋁箔複合薄膜採氣袋0.5L或1.0L。
3.6 二氧化碳標準氣體(0.5%)貯於鋁合金鋼瓶中。
4、 儀器和設備
4.1 二氧化碳不分光紅外線氣體分析儀
4.2 儀器主要性能指標如下:
測量範圍0-0.5%;0-1.5%兩檔。
重現性≦±1%滿刻度
零點漂移:≦±3%滿刻度/4h
跨度漂移:≦±3%滿刻度/4h
溫度附加誤差(在10-80℃)≦±2%滿刻度/10℃
一氧化碳干擾:1000ml/m3(1000 ppm)co≤±2%滿刻度。
供電電壓變化時附加誤差:220v±10%≤±2%滿刻度。
啟動時間:30min
抽氧流量:>0.5L/min
回響時間D指針指示到滿刻度的90%的時間<15s。
二氧化碳—揮髮油的測定—揮髮油測定法。
套用範圍:
該方法採用揮髮油測定法測定二氧化碳中揮髮油的含量。
該方法適用於姜科植物溫鬱金Curcuma wenyujin Y.H.Chen et C.Ling的乾燥根莖。
方法原理:
供試品於揮髮油測定器中加水適量,加熱至沸並保持微沸至5小時後,讀取測定器中揮髮油的量,計算其含量。
試劑:
無特殊試劑
儀器設備:
二氧化碳吸收器:1000mL(或500mL、2000mL)的硬質圓底燒瓶,上接揮髮油測定器,揮髮油測定器的上端連線回流冷凝管。以上各部均用玻璃磨口連線。測定器應具有0.1mL的刻度。全部儀器應充分洗淨,並檢查接合部分是否嚴密,以防揮髮油逸出。
註:裝置中揮髮油測定器的支管分岔處應與基準線平行。
試樣製備:
操作步驟:
稱取供試品粉末(過二~三號篩,24—50目)適量(約相當於含揮髮油0.5~1.0mL) (準確至0.01g)置燒瓶中,加水300~500mL與玻璃珠數粒,振搖混合後,連線揮髮油測定器與回流冷凝管。自冷凝管上端加水使充滿揮髮油測定器的刻度部分,並溢流入燒瓶時為止。置電熱套中或用其他適宜方法緩緩加熱至沸,並保持微沸約5小時,至測定器中油量不再增加,停止加熱,放置片刻,開啟測定器下端的活塞,將水緩緩放出,至油層上端到達刻度0線上面5mm處為止。放置1小時以上,再開啟活塞使油層下降至其上端恰與刻度0線平齊,讀取揮髮油量,並計算供試品中揮髮油的含量(%)。
參考文獻:
中華人民共和國藥典,國家藥典委員會編,化學工業出版社,2005年版,一部p.12。
統計數據
2014年年4月北半球大氣中月均二氧化碳濃度首次超過400ppm(1ppm為百萬分之一)。
這一現象可視為溫室氣體水平不斷升高的另一警告,必須採取緊急行動遏制新增溫室氣體排放。
自2012年以來,加拿大、美國、挪威和芬蘭位於北極圈內觀測站的記錄顯示春季月平均二氧化碳濃度已超400ppm,但北半球更低緯度的觀測站記錄也顯示出該趨勢。
世界氣象組織位於維德角、德國、愛爾蘭、日本、西班牙與瑞士的觀測站均報告說,2012年3月至4月記錄的月均二氧化碳濃度超過400ppm。
2014年年4月,世界氣象組織全球大氣觀測網中,所有位於北半球的觀測站監測到的二氧化碳濃度均創當地春季最高值。2012年全球年均大氣二氧化碳濃度為393.1ppm, 而工業化以前是278ppm。
發展狀況
 二氧化碳
二氧化碳因為國際間碳排放政策的影響,各個國家間的CO₂交易會涉及到非常複雜的碳排放稅和國際間政治問題,故CO₂的全球性貿易極度蕭條。並且由於CO₂的儲存運輸成本較高,不適宜遠距離運輸,故進出口量均較少,出口量不到國內總產量的1%,所以二氧化碳進出口貿易情況對國內市場供需平衡影響很小。因CO₂的運輸方式與國際碳排放政策環境在可預測的未來若干年內不會發生大的變化,因而進出口格局在也不會發生大的改變。從2012年數據來看,主要進口地為中國台灣省、韓國、日本等周邊國家和地區,主要出口目的地為菲律賓、中國香港、新加坡、印尼、中國澳門等地,此外東北地區企業每年有少量出口到俄羅斯。表3為2006~2012年的年海關統計數據
。
二氧化碳相關方程式
1、氫氧化鈉溶液與硫酸銅溶液反應:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4
2、甲烷在空氣中燃燒:CH4+2O2點燃CO2+2H2O
3、酒精在空氣中燃燒:C2H5OH+3O2點燃2CO2+3H2O
4、一氧化碳還原氧化銅:CO+CuO加熱Cu+CO2
5、一氧化碳還原氧化鐵:3CO+Fe2O3高溫2Fe+3CO2
6、二氧化碳通過澄清石灰水(檢驗二氧化碳):Ca(OH)2+CO2====CaCO3↓+H2O
7、氫氧化鈉和二氧化碳反應(除去二氧化碳):2NaOH+CO2====Na2CO3+H2O
8、石灰石(或大理石)與稀鹽酸反應(二氧化碳的實驗室製法):CaCO3+2HCl===CaCl2+H2O+CO2↑
9、碳酸鈉與濃鹽酸反應(泡沫滅火器的原理):Na2CO3+2HCl===2NaCl+H2O+CO2↑
C+O2點燃====CO2現象:生成能使純淨的石灰水變渾濁的氣體
Ca(OH)2+CO2===CaCO3↓+H2O現象:生成白色的沉澱,用於檢驗二氧化碳
CaCO3+CO2+H2O===Ca(HCO3)2現象:白色固體逐漸溶解
Ca(HCO3)△====CaCO3↓+CO2↑+H2O現象:生成白色的沉澱,同時有能使純淨的石灰水變渾濁的氣體生成
Cu2(OH)2CO3△====2CuO+H2O+CO2↑現象:固體由綠色逐漸變成黑色,同時有能使純淨石灰水變渾濁的氣體生成
2NaOH+CO2===Na2CO3+H2O(也可為KOH)現象:不明顯
CaCO3高溫====CaO+CO2↑現象:有能使純淨石灰水變渾濁的氣體生成
跟一氧化碳有關的,但同時也跟二氧化碳有關:
Fe3O4+4CO====3Fe+4CO2現象:固體由黑色變成銀白色,同時有能使純淨石灰水變渾濁的氣體生成
高溫
FeO+CO===Fe+CO2現象:固體由黑色逐漸變成銀白色,同時有能使純淨石灰水變渾濁的氣體生成
高溫
Fe2O3+3CO====2Fe+3CO2現象:固體由紅色逐漸變成銀白色,同時有能使純淨石灰水變渾濁的氣體生成
高溫
CuO+CO====Cu+CO2現象:固體由黑色變成紅色,同時有能使純淨石灰水變渾濁的氣體生成
無機化學
| 無機化學是除碳氫化合物及其衍生物外,對所有元素及其化合物的性質和他們的反應進行實驗研究和理論解釋的科學,是化學學科中發展最早的一個分支學科。現在讓我們來認識一下這部分化學知識吧。 |

