元素介紹
氧(Oxygen)是一種化學元素,其原子序數為8,相對原子質量為16.00。由符號“O”表示過氧化氫分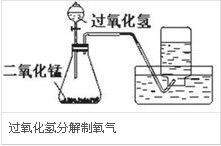
構成有機體的所有主要化合物都含有氧,包括蛋白質、碳水化合物和脂肪。構成動物殼、牙齒及骨骼的主要無機化合物也含有氧。由藍藻、藻類和植物經過光合作用所產生的氧氣化學式為O2,幾乎所有複雜生物的細胞呼吸作用都需要用到氧氣。動物中,除了極少數之外,皆無法終身脫離氧氣生存。但是對於厭氧性生物比如破傷風桿菌來說,氧氣是有毒的。這類厭氧型生物曾經是早期地球上的主要生物,直到25億年前氧氣開始在大氣層中逐漸積累。氧元素的另一個同素異形體是臭氧。在高海拔形成的臭氧層能夠隔離來自太陽的紫外線輻射。但是接近地表的臭氧則是一種污染,這些臭氧主要存在於光化學煙霧中。
發現歷史
氧元素是由英國化學家約瑟夫·普利斯特里與瑞典藥劑師及化學家舍勒於1774年分別發現。但是普利斯特里卻支持燃素學說。另有說法認為氧氣首先由中國人馬和首先發現。1777年,法國化學家拉瓦錫提出燃燒的氧化學說,指出物質只能在含氧的空氣中進

在1608年,CorneliusDrebbel證明了加熱硝石(硝酸鉀,KNO₃)能釋放氣體。這就是氧氣,然而並沒有對它進行鑑定。
因發現氧而獲得的榮譽由3位化學家分享:一個英國人,一個瑞典人,還有一個法國人。JosephPriestley是第一位發布氧元素聲明的人,在1774年由聚焦陽光到氧化汞(HgO),然後收集釋放出的氣體實現。他注意到蠟燭在這裡燃燒的更明亮了,而且能使呼吸變得更簡單。Priestley不知道的是,CarlWilhelmScheele在1771年6月就製取了氧。他寫下了他的發現說明,但直到1777年才發布。AntoineLavoisier也聲稱發現了氧,並且他提議這種新的氣體叫做oxy-gène,意思是形成酸的,因為他認為這種元素是所有酸性物質的基礎。
元素分布
氧元素占整個地殼質量的48.6%,是地殼中含量最多的元素,它在地殼中基本上是以氧化合物的形式存在的。每一千克的海水中溶解有2.8毫克的氧氣,而海水中的氧元素差不多達到了89%.就整個地球而言,氧的質量分數為15.2%。無論是人、動物還是植物,他們的生物細胞都有類似的組成,其中氧元素占到了65%的質量。存在形式
單質
氧氣,空氣主要組分之一,比空氣重,標準狀況(0℃和大氣壓強101325帕)下密度為1.429克/升。無色、無味。在水中溶解度很小,273k時溶解度為49.1mol/L。壓強為101kPa時,氧氣在約-183攝氏度時變為淡藍色液體,在約-218攝氏度時變成雪花狀的淡藍色固體。氧分子具有順磁性。
臭氧,在常溫下,它是一種有魚腥臭味的藍色氣體。臭氧主要存在於距地球表面20~35公里的同溫層下部的臭氧層中。在常溫常壓下,穩定性極差,在常溫下可自行分解為氧氣。臭氧具有強烈的刺激性,吸入過量對人體健康有一定危害。熔點21K,沸點160.6K,溶解度較大,273k時為494mol/L。具有反磁性。
化合物
氧化物,之前提到的幾乎所有元素都能與氧氣反應,得到的化合物中只有氧元素和另一種元素的二元化合物是氧化物,如水,CO₂。氧化物有多種多樣,主要分為:酸性氧化物,鹼性氧化物,兩性氧化物,不成鹽氧化物和假氧化物。另外還有一些只含有氧元素的基團也能形成氧化物,分為:過氧化物,超氧化物,臭氧化物等。含氧化合物,含氧化合物泛指一切含有氧元素的化合物,比氧化物範圍大,對於組成物質的元素種類無要求。
特殊
四聚氧(O4)這種氧分子可以穩定存在,預計構型為正四面體或者矩形,從兩種構型中性分子O4,正一價分子O4+和負一價分子O₄-的基態電子結構,並根據能量最低原則確定了各自的結構參數,從而得到了O4分子2種結構的基態總能量、一價電離能及電子親合勢能。與氧原子、普通氧分子O₂和臭氧分子O₃的計算結果比較,顯示O₄分子可以以正方形結構或正四面體結構形式存在,其中正方形結構更有可能是O4分子的真實空間結構。
紅氧(O8)
隨著室溫下氧氣的壓強超過10GPa,它將出人意料地相變為另一個同素異形體。它的體積驟減,顏色也從藍變成深紅。這種ε相發現於1979年,但當時它的結構並不清楚。基於它的紅外線吸收光譜,1999年,研究人員推斷此相態是O4分子的晶體。但在2006年,X射線晶體學表明這個被稱作ε氧或紅氧的穩定相態實為O8。此結構在理論上不曾被預測:由四個O2分子組成的菱形的O8原子簇。
理化性質
物理性質
基本信息氧(Oxygen)是一種化學元素,其原子序數為8,相對原子質量為16.00。由符號“O”表示。在元素周期表中,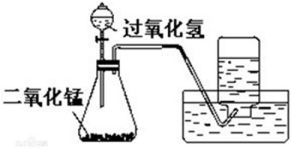 過氧化氫分解制氧氣
過氧化氫分解制氧氣同位素
氧的同位素已知的有十七種,包括氧-12至氧-28,其中氧-16、氧-17和氧-18三種屬於穩定型,其他已知的同位素都帶有放射性,其半衰期全部均少於三分鐘。利用醫用回旋加速器產生的質子,轟擊重氧水之中的氧-18,通過(p,n)核反應,從而獲得可以發射正電子的放射性同位素氟-18離子,用於合成正電子發射計算機斷層掃描檢查所需的示蹤劑氟代脫氧葡萄糖。
| 符號 | 質子 | 中子 | 質量(u) | 半衰期 | 原子核自鏇 | 相對豐度 | 相對豐度的變化量 |
|---|---|---|---|---|---|---|---|
| 12O | 8 | 4 | 12.034405(20) | 580(30)E-24 s [0.40(25) MeV] | 0+ | ||
| 13O | 8 | 5 | 13.024812(10) | 8.58(5) ms | (3/2-) | ||
| 14O | 8 | 6 | 14.00859625(12) | 70.598(18) s | 0+ | ||
| 15O | 8 | 7 | 15.0030656(5) | 122.24(16) s | 1/2- | ||
| 16O | 8 | 8 | 15.9949146 1956(16) | 穩定 | 0+ | 0.99757(16) | 0.99738-0.99776 |
| 17O | 8 | 9 | 16.99913170(12) | 穩定 | 5/2+ | 0.00038(1) | 0.00037-0.00040 |
| 18O | 8 | 10 | 17.9991610(7) | 穩定 | 0+ | 0.00205(14) | 0.00188-0.00222 |
| 19O | 8 | 11 | 19.003580(3) | 26.464(9) s | 5/2+ | ||
| 20O | 8 | 12 | 20.0040767(12) | 13.51(5) s | 0+ | ||
| 21O | 8 | 13 | 21.008656(13) | 3.42(10) s | (1/2,3/2,5/2)+ | ||
| 22O | 8 | 14 | 22.00997(6) | 2.25(15) s | 0+ | ||
| 23O | 8 | 15 | 23.01569(13) | 82(37) ms | 1/2+# | ||
| 24O | 8 | 16 | 24.02047(25) | 65(5) ms | 0+ | ||
| 25O | 8 | 17 | 25.02946(28)# | <50 ns | (3/2+)# | ||
| 26O | 8 | 18 | 26.03834(28)# | <40 ns | 0+ | ||
| 27O | 8 | 19 | 27.04826(54)# | <260 ns | 3/2+# | ||
| 28O | 8 | 20 | 28.05781(64)# | <100 ns | 0+ |
備註:畫上#號的數據代表沒有經過實驗的證明,只是理論推測而已,而用括弧括起來的代表數據不確定性。
化學性質
氧的非金屬性和電負性僅次於氟,為,除了氦氖氬氪所有元素都能與氧起反應。一般而言,
 氧氣袋
氧氣袋氧的化合價:氧的化合價很特殊一般為-2價和0價。而氧在過氧化物中通常為-1價。在超氧化物中為-1/2,臭氧化物中氧為-1/3,這裡的化合價被稱為表觀化合價,就是表面上看出來的化合價沒有實際的含義,超氧化物中氧的化合價只能說是超氧根離子,不能單獨的看每個原子,因為電子是量子化的,即不連續的,不存在1/2個電子,自然化合價也就沒有0.5的說法,臭氧化物也一樣,在過氧根中相當於是有兩個電子組成了電子對,所以這兩個電子不表現出化合價,所以過氧根離子整體呈-2價。而氧的正價很少出現,只有在和氟的化合物二氟化氧,二氟化二氧和氟鉑酸氧(O₂PTF₆)中顯示+2價和+1價以及+0.5價,在中學化學中只要記住氧沒有最高正價和氟是沒有正價就可以了。
實驗證明,除黃金外的所有金屬都能和氧發生反應生成金屬氧化物,比如鉑在高溫下在純氧中被氧化生成二氧化鉑,黃金一般認為不能和氧發生反應,但是有三氧化二金和氫氧化金等化合物,其中金為+3價;氧氣不能和氯,溴,碘發生反應,但是臭氧可以氧化它們。
在元素周期表中屬於ⅥA族元素化合價一般為0和-2。大多數元素在含氧的氣氛中加熱時可生成氧化物。有許多元素可形成一種以上的氧化物。氧分子在低溫下可形成水合晶體O₂.H₂O和O₂.H₂O₂,後者較不穩定。氧氣在水中的溶解度是4.89毫升/100毫升水(0℃),是水中生命體的基礎。氧在地殼中豐度占第一位。乾燥空氣中含有20.946%體積的氧;水有88.81%重量的氧組成。除了O16外,還有O17和O18等同位素。常見氧化態有-Ⅰ,-Ⅱ,0。共價半徑66pm,第一電離勢1314kJ/mol,電負性3.44。
| 化學方程式 | 現象 | |
|---|---|---|
| 與鉀的反應 | 4K+O 2=2K 2O | 鉀的表面變暗 |
| 2K+O2=K2O2 | ||
| K+O 2=KO 2(超氧化鉀) | ||
| 2K+3O2=2KO3(臭氧化鉀) | ||
| 與鈉的反應 | 4Na+O2=2Na2O | 鈉的表面變暗 |
| 產生黃色火焰,放出大量的熱,生成淡黃色粉末 | ||
| 與鎂的反應 | 2Mg+O2=點燃=2MgO | 劇烈燃燒發出耀眼的強光,放出大量熱,生成白色粉末狀固體。 |
| 與鋁的反應 | 4Al+3O2=點燃=2Al2O3 | 發出明亮的光,放出熱量,生成白色固體。 |
| 與鐵的反應 | (鐵鏽的形成) | |
| 3Fe+2O2=點燃=Fe3O4 | 紅熱的鐵絲劇烈燃燒,火星四射,放出大量熱,生成黑色固體。 | |
| 與鋅的反應 | 2Zn+O2=點燃=2ZnO | |
| 與銅的反應 | 2Cu+O2=加熱=2CuO | 加熱後亮紅色的銅絲表面生成一層黑色物質。 |
| 化學方程式 | 現象 | |
|---|---|---|
| 與氫氣的反應 | 2H 2+O 2=點燃=2H 2O | 安靜地燃燒,產生淡藍色的火焰,生成水並放出大量的熱。[8] |
| 與碳的反應 | C+O 2=點燃=CO 2 | 劇烈燃燒,發出白光,放出熱量,生成使澄清石灰水變渾濁的氣體。[9] |
| 2C+O 2=點燃=2CO (氧氣不充足時) | ||
| 與硫的反應 | S+O 2=點燃=SO 2 | 在空氣中燃燒,發出微弱的淡藍色火焰;在純氧中燃燒得更旺,發出藍紫色火焰,放出熱量,生成有刺激性氣味的氣體[10]。該氣體能使澄清石灰水變渾濁,且能使酸性高錳酸鉀溶液或品紅溶液褪色,褪色的品紅溶液加熱後顏色又恢復為紅色。 |
| 與紅磷的反應 | 4P+5O 2=點燃=2P 2O 5 | 發出耀眼白光,放熱,生成大量白煙。 |
| 與白磷的反應 | 白磷在空氣中自燃,發光發熱,生成白煙。 | |
| 與氮氣的反應 | N 2+O 2=高溫或放電=2NO |
| 如甲烷、乙炔、酒精、石蠟等能在氧氣中燃燒生成水和二氧化碳。 氣態烴類的燃燒通常發出明亮的藍色火焰,放出大量的熱,生成水和能使澄清石灰水變渾濁的氣體。 | ||
| 甲烷 | CH4+2O2=點燃=CO2+2H2O | |
| 乙烯 | C2H4+3O2=點燃=2CO2+2H2O | |
| 乙炔 | 2C2H2+5O2=點燃=4CO2+2H2O | |
| 苯 | 2C6H6+15O2=點燃=12CO2+6H2O | 在空氣中燃燒時,火焰明亮並有濃黑煙。 |
| 甲醇 | 2CH3OH+3O2=點燃=2CO2+4H2O | |
| 乙醇 | CH3CH2OH+3O2=點燃=2CO2+3H2O | |
| 碳氫氧化合物與氧氣發生燃燒的通式 | 4CxHyOz+(4x+y-2z)O2=點燃=4xCO2+2yH2O(通式完成後應注意化簡!下同) | |
| 烴的燃燒通式 | 4CxHy+(4x+y)O2=點燃=4xCO2+2yH2O | |
| 乙醇被氧氣氧化 | 此反應包含兩個步驟: | |
| 氯仿與氧氣的反應 | 2CHCl3+O2=2COCl2(光氣)+2HCl | |
| 化學方程式 | |
|---|---|
| 硫化氫的燃燒 | 2H 2S+3O 2(過量)=點燃=2H 2O+2SO 2[11] 2H 2S+O 2(少量)=點燃=2H 2O+2S[11] |
| 煅燒黃鐵礦 | 4FeS2+11O2=高溫=2Fe2O3+8SO2 |
| 二氧化硫的催化氧化 | 2SO 2+O 2←催化劑,△→2SO 3 |
| 空氣中硫酸酸雨的形成 | 2SO 2+O 2+2H 2O=2H 2SO 4 |
| 氨在純氧中的燃燒 | 4NH3+3O2(純)=點燃=2N2+6H2O |
| 氨的催化氧化 | |
| 一氧化氮與氧氣的反應 | 2NO+O 2=2NO 2 |
| 轉化為臭氧的反應 | 3O2=放電=2O3(該反應為可逆反應) |
製取方法
實驗室製法
1.加熱高錳酸鉀: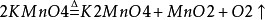 加熱高錳酸鉀方程式
加熱高錳酸鉀方程式2.二氧化錳與氯酸鉀共熱:
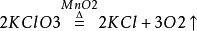 二氧化錳與氯酸鉀共熱方程式
二氧化錳與氯酸鉀共熱方程式(製得的氧氣中含有少量Cl2、O3和微量ClO2;部分教材已經刪掉;該反應實際上是放熱反應,而不是吸熱反應,發生上述1mol反應,放熱108kJ)。
3.過氧化氫溶液催化分解(催化劑主要為二氧化錳,三氧化二鐵、氧化銅也可):
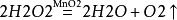 過氧化氫溶液催化分解方程式
過氧化氫溶液催化分解方程式工業製法
1、分離液態空氣法在低溫條件下加壓,使空氣轉變為液態,然後蒸發,由於液態氮的沸點是‐196℃,比液態氧的沸點(‐183℃)低,因此氮氣首先從液態空氣中蒸發出來,剩下的主要是液態氧。
空氣中的主要成分是氧氣和氮氣。利用氧氣和氮氣的沸點不同,從空氣中製備氧氣稱空氣分離法。首先把空氣預冷、淨化(去除空氣中的少量水分、二氧化碳、乙炔、碳氫化合物等氣體和灰塵等雜質)、然後進行壓縮、冷卻,使之成為液態空氣。然後,利用氧和氮的沸點的不同,在精餾塔中把液態空氣多次蒸發和冷凝,將氧氣和氮氣分離開來,得到純氧(可以達到99.6%的純度)和純氮(可以達到99.9%的純度)。如果增加一些附加裝置,還可以提取出氬、氖、氦、氪、氙等在空氣中含量極少的稀有惰性氣體。由空氣分離裝置產出的氧氣,經過壓縮機的壓縮,最後將壓縮氧氣裝入高壓鋼瓶貯存,或通過管道直接輸送到工廠、車間使用。使用這種方法生產氧氣,雖然需要大型的成套設備和嚴格的安全操作技術,但是產量高,每小時可以產出數千、萬立方米的氧氣,而且所耗用的原料僅僅是不用買、不用運、不用倉庫儲存的空氣,所以從1903年研製出第一台深冷空分制氧機以來,這種制氧方法一直得到最廣泛的套用。
2、膜分離技術
膜分離技術得到迅速發展。利用這種技術,在一定壓力下,讓空氣通過具有富集氧氣功能的薄膜,可得到含氧量較高的富氧空氣。利用這種膜進行多級分離,可以得到百分之九十以上氧氣的富氧空氣。
3、分子篩制氧法(吸附法)
利用氮分子大於氧分子的特性,使用特製的分子篩把空氣中的氧離分出來。首先,用壓縮機迫使乾燥的空氣通過分子篩進入抽成真空的吸附器中,空氣中的氮分子即被分子篩所吸附,氧氣進入吸附器內,當吸附器內氧氣達到一定量(壓力達到一定程度)時,即可打開出氧閥門放出氧氣。經過一段時間,分子篩吸附的氮逐漸增多,吸附能力減弱,產出的氧氣純度下降,需要用真空泵抽出吸附在分子篩上面的氮,然後重複上述過程。這種製取氧的方法亦稱吸附法.利用吸附法制氧的小型制氧機已經開發出來,便於家庭使用。
4、電解制氧法
把水放入電解槽中,加入氫氧化鈉或氫氧化鉀以提高水的電解度,然後通入直流電,水就分解為氧氣和氫氣。每製取一立方米氧,同時獲得兩立方米氫。用電解法製取一立方米氧要耗電12~15千瓦小時,與上述兩種方法的耗電量(0.55~0.60千瓦小時)相比,是很不經濟的。所以,電解法不適用於大量制氧。另外同時產生的氫氣如果沒有妥善的方法收集,在空氣中聚集起來,如與氧氣混合,容易發生極其劇烈的爆炸。所以,電解法也不適用家庭制氧的方法。
| 電解硫酸銅溶液 | 2CuSO 4+2H 2O=通電=2Cu↓+2H 2SO 4+O 2↑ |
| 電解水 | 2H 2O=通電=2H 2+O 2↑ |
| 光合作用總反應式 | 6CO 2+6H 2O—光,葉綠素→C 6H 12O 6+6O 2↑ |
| 電解硝酸銀溶液 | 4AgNO 3+2H 2O =通電=4Ag↓+4HNO 3+O 2↑ |
| 氟氣與水的反應 | 2F2+2H2O=O2+4HF |
| 電解鋁 | 2Al 2O 3=通電=4Al+3O 2↑ |
| 加熱氧化銅 | 2CuO=△=2Cu+O2 |
| 加熱氧化汞 | 2HgO=△=2Hg=O2 |
氧中毒
氧雖對身體有益,卻也並非越多越好,氧氣含量過高時也會發生氧中毒,氧中毒主要分以下三種類型:肺型
類似支氣管肺炎。其表現及通常的發展過程為:最初為類似上呼吸道感染引起的氣管刺激症狀,如胸骨後不適(刺激或燒灼感)伴輕度乾咳,並緩慢加重;然後出現胸骨後疼痛,且疼痛逐漸沿支氣管樹向整個胸部蔓延,吸氣時為甚;疼痛逐漸加劇,出現不可控制的咳嗽;休息時也伴有呼吸困難。在症狀出現的早期階段結束暴露,胸疼和咳嗽可在數小時內減輕。腦型
最初出現額、眼、鼻、口唇及面頰肌肉的纖維性顫動,也可累及手的小肌肉;面色蒼白、有異味感。繼而可有噁心、嘔吐、眩暈、汗、流涎、上腹部緊張;也可出現視力喪失、視野縮小、幻視、幻聽;還會有心動過緩、心悸、氣哽、指(趾)端發麻、情緒反常(憂慮、抑鬱、煩躁或欣悅)。接著出現極度疲勞、嗜睡、呼吸困難等。少數情況還可能發生虛脫。眼型
主要表現為視網膜萎縮。早產嬰兒在恆溫箱內吸氧時間過長,視網膜有廣泛的血管阻塞、成纖維組織浸潤、晶體後纖維增生,可因而致盲。生命元素
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||