發現簡史
 白磷
白磷1669年,德國漢堡一位叫布朗特(BrandH)的商人在強熱蒸發人尿的過程中,他沒有製得黃金,卻意外地得到一種像白蠟一樣的物質,在黑暗的小屋裡閃閃發光。這從未見過的白蠟模樣的東西,雖不是布朗特夢寐以求的黃金,可那神奇的藍綠色的火光卻令他興奮得手舞足蹈。他發現這種綠火不發熱,不引燃其它物質,是一種冷光。於是,他就以“冷光”的意思命名這種新發現的物質為“磷”。磷的拉丁文名稱Phosphorum就是“冷光”之意,它的化學符號是P,它的英文名稱是Phosphorus。
元素含量
 磷
磷元素在海水中的含量:0.0015ppm
地殼中含量:1000ppm
磷在生物圈內的分布很廣泛,地殼含量豐富列前10位,在海水中濃度屬第2類。廣泛存在於動植物組織中,也是人體含量較多的元素之一,稍次於鈣排列為第六位。約占人體重的1%,成人體內約含有600-900g的磷。體內磷的85.7%集中於骨和牙,其餘散在分布於全身各組織及體液中,其中一半存在於肌肉組織。它不但構成人體成分,且參與生命活動中非常重要的代謝過程,作為人體細胞DNA和RNA的重要組成元素,是機體很重要的一種元素。
物理性質
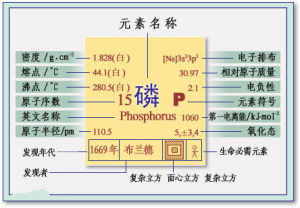
單質磷有幾種同素異形體。其中,白磷或黃磷是無色或淡黃色的透明結晶固體。密度1.82克/立方厘米。熔點44.1℃,沸點280℃,著火點是40℃。放於暗處有磷光發出。有惡臭。劇毒。白磷幾乎不溶於水,易溶解於二硫化碳溶劑中.在高壓下加熱會變為黑磷,其密度2.70克/立方厘米,略顯金屬性。電離能為10.486電子伏特。一般不溶於普通溶劑中。白磷經放置或在250℃隔絕空氣加熱數小時或暴露於光照下可轉化為紅磷。紅磷是紅棕色粉末,無毒,密度2.34克/立方厘米,熔點59℃(在43atm下,熔點是590℃,升華溫度416℃),沸點200℃,著火點240℃。不溶於水。在自然界中,磷以磷酸鹽的形式存在,是生命體的重要元素。存在於細胞、蛋白質、骨骼和牙齒中。在含磷化合物中,磷原子通過氧原子而和別的原子或基團相聯結。
同位素
已發現的共有23種:包括從磷24到磷46。其中只有磷31最為穩定。其它同位素都具有放射性,其中磷32、磷33的半衰期在10d內,其餘的都為極不穩定的放射性同位素。
| 符號 | 質子 | 中子 | 質量(u) | 半衰期 | 原子核自鏇 | 相對豐度 |
|---|---|---|---|---|---|---|
| 24P | 15 | 9 | 24.03435(54)# | (1+)# | ||
| 25P | 15 | 10 | 25.02026(26)# | <30 ns | (1/2+)# | |
| 26P | 15 | 11 | 26.01178(21)# | 43.7(6) ms | (3+) | |
| 27P | 15 | 12 | 26.999230(28) | 260(80) ms | 1/2+ | |
| 28P | 15 | 13 | 27.992315(4) | 270.3(5) ms | 3+ | |
| 29P | 15 | 14 | 28.9818006(6) | 4.142(15) s | 1/2+ | |
| 30P | 15 | 15 | 29.9783138(3) | 2.498(4) min | 1+ | |
| 31P | 15 | 16 | 30.97376163(20) | 穩定 | 1/2+ | 1.0000 |
| 32P | 15 | 17 | 31.97390727(20) | 14.263(3) d | 1+ | |
| 33P | 15 | 18 | 32.9717255(12) | 25.34(12) d | 1/2+ | |
| 34P | 15 | 19 | 33.973636(5) | 12.43(8) s | 1+ | |
| 35P | 15 | 20 | 34.9733141(20) | 47.3(7) s | 1/2+ | |
| 36P | 15 | 21 | 35.978260(14) | 5.6(3) s | 4-# | |
| 37P | 15 | 22 | 36.97961(4) | 2.31(13) s | 1/2+# | |
| 38P | 15 | 23 | 37.98416(11) | 0.64(14) s | ||
| 39P | 15 | 24 | 38.98618(11) | 190(50) ms | 1/2+# | |
| 40P | 15 | 25 | 39.99130(15) | 153(8) ms | (2-,3-) | |
| 41P | 15 | 26 | 40.99434(23) | 100(5) ms | 1/2+# | |
| 42P | 15 | 27 | 42.00101(48) | 48.5(15) ms | ||
| 43P | 15 | 28 | 43.00619(104) | 36.5(15) ms | 1/2+# | |
| 44P | 15 | 29 | 44.01299(75)# | 18.5(25) ms | ||
| 45P | 15 | 30 | 45.01922(86)# | 8# ms [>200 ns] | 1/2+# | |
| 46P | 15 | 31 | 46.02738(97)# | 4# ms [>200 ns] |
備註:畫上#號的數據代表沒有經過實驗的證明,只是理論推測而已,而用括弧括起來的代表數據不確定性。
同素異形體
黑磷(金屬磷)
黑色有金屬光澤的晶體,在磷的同素異形體中反應活性最弱,在空氣中不會點燃。化學結構類似石墨,因此可導電。
化學式一般寫為P。
深黑色粉末
白磷(黃磷)
化學式:P4
淡黃蠟似半透明可結晶的固體,於黑暗中能發光。有特臭,劇毒。密度1.83克/立方厘米,熔點44.4,沸點287度。
紅磷(赤磷)
化學結構為巨型共價分子。
化學式一般寫為P。
鮮紅色粉末,無毒,密度2.296克/立方厘米,熔點300度,沸點725度,是黃磷於壓力下稀有氣體中加熱8-10日而成。
紫磷
把黑磷加熱到125℃則變成鋼藍色的紫磷。
紫磷的化學活動性比白磷小,但仍能被硝酸氧化成磷酸。紫磷跟氯酸鉀一起摩擦可以劇烈燃燒。化學結構為層狀,但與黑磷不同。
化學式一般寫為P。
化學性質
單質
白磷
純白磷是無色而透明的晶體,遇光逐漸變黃,因而又叫黃磷。黃磷劇毒,誤食0.1g就能致死。皮膚若經常接觸到單質磷也會引起吸收中毒。白磷不溶於水,易溶於CS2中。經測定,不論在溶液中或在蒸汽狀態,磷的分子質量都相當於分子式P4。磷蒸汽熱至1073K,P4開始分解為P2。P2分子結構和N2相同。
白磷晶體是由P4分子組成的分子晶體,P4分子呈四面體構型,分子中P—P鍵長是221pm,鍵角∠PPP是60°。理論上研究認為,P—P鍵是98%3p軌道形成的鍵(3s和3d僅占很少成分),純p軌道間的夾角應為90°,而實際僅有60°,因此P4分子中P—P鍵是受了很大應力而彎曲的鍵。其鍵能比正常無應力時的P—P鍵要弱,易於斷裂,使白磷在常溫下就有很高的化學活性。
白磷在潮濕的空氣中發生緩慢氧化,部分的反應能量以光能的形式放出,故在暗處可看到白磷發光。當緩慢氧化積累的能量達到燃點(313K)時便發生自燃,因此白磷通常要儲存在水中以隔絕空氣。
白磷和氧化劑反應猛烈,它在氯氣中可自燃;遇液氯或溴會發生爆炸,與冷濃硝酸反應激烈生成磷酸;在熱的濃鹼液中發生歧化反應生成磷化氫(主要是PH3,還有P2H4)和次磷酸鹽。
白磷的主要反應有
1.白磷在空氣中自燃生成氧化物。
P4+3O2==P4O6(化合反應)
2.白磷與鹵素單質劇烈反應,在氯氣中也能自燃生成三氯化磷和五氯化磷。
P4+6Cl2==4PCl3(化合反應)
P4+10Cl2==4PCl5(化合反應)
3.白磷能被硝酸氧化成磷酸。
3P+5HNO3+2H2O==3H3PO4+5NO↑(氧化還原反應)
4.白磷溶解在熱的濃鹼中,歧化生成磷化氫和次磷酸鹽。
P4+3OH-+3H2O==PH3+3H2PO2-
5.白磷還可以把金、銀、銅和鉛從它們的鹽中取代出來,例如白磷與熱的銅鹽反應生成磷化亞銅,在冷溶液中則析出銅。
11P+15CuSO4+24H2O=△=5Cu3P+6H3PO4+15H2SO4(氧化還原反應)
2P+5CuSO4+8H2O==5Cu+2H3PO4+5H2SO4(氧化還原反應)
硫酸銅是白磷中毒的解毒劑,如不慎白磷沾到皮膚上,可用CuSO4溶液沖洗,用磷的還原性來解毒。
6.白磷可以被氫氣還原生成磷化氫。
P4+6H2==4PH3
紅磷
紅磷的著火點極高,在空氣中不發生自燃,但是只需要在紅磷中加入少量的MnO2,片刻將會發生燃燒,在這個過程中一定需要注意安全,最好在一個安全的容器內做這個實驗,否則將可能發生意外。
主要化合物
磷的氧化物有三氧化二磷和五氧化二磷。
三氧化二磷
磷在常溫下慢慢氧化,或在不充分的空氣中燃燒,均可生成P(Ⅲ)的氧化物P4O6,常稱做三氧化二磷。
P4O6的生成可以看成是P4分子中的P-P鍵因受到O2分子的進攻而斷開,在每個P原子間嵌入一個O原子而形成稠環分子。形成P4O6分子後,4個P原子的相對位置(正四面體的角頂)並不發生變化。
由於三氧化二磷的分子具有似球狀的結構而容易滑動,所以三氧化二磷是有滑膩感的白色吸潮性蠟狀固體,熔點296.8K,沸點(在氮氣中)446.8K。
①三氧化二磷有很強的毒性,溶於冷水中緩慢地生成亞磷酸,它是亞磷酸酐。
P4O6+6H2O(冷)==4H3PO3
②三氧化二磷在熱水中歧化生成磷酸和放出磷化氫:
P4O6+6H2O(熱)==PH3↑+3H3PO4
③三氧化二磷易溶於有機溶劑中。
五氧化二磷
磷在充分的氧氣中燃燒,可以生成P2O5,這個化合物常簡稱為五氧化二磷。其中P的氧化數為+5。
在P4O6的球狀分子中,每個P原子上還有一對孤電子對,會受到O2分子的進攻,生成四個P=O雙鍵,而形成P4O10的分子。
五氧化二磷是白色粉末狀固體,熔點693K,573K時升華。它有很強的吸水性,在空氣中很快就潮解,因此它是一種最強的乾燥劑。
五氧化二磷與水作用激烈,放出大量熱,生成P(Ⅴ)的各種含氧酸,並不能立即轉變成磷酸,只有在HNO3存在下煮沸才能轉變成磷酸:
P4O10+6H2O==4H3PO4(在HNO3與煮沸的條件下)
五氧化二磷是磷酸的酸酐。
三鹵化磷
用氣態的氯和溴與白磷作用可以得到PCl3和PBr3,根據理論比值混合白磷和碘在CS2中反應可以得到PI3。三氟化磷可用三氟化砷與三氯化磷的反應製備:
PCl3+AsF3=PF3+AsCl3
磷也生成一些混合鹵化物如PF2Cl和PFBr2。
五鹵化磷
單質和鹵素直接反應或三鹵化物和鹵素反應可以得到五鹵化磷:
P4+10Cl2=4PCl5
PF3+Cl2=PF3Cl2
第二種方法特別適用於製備混合鹵化物。
鹵氧化磷
五鹵化磷和過量的水直接接觸時會迅速發生水解作用,產生磷酸和氫鹵酸:
PX5+4H2O=H3PO4+5HX
如果使五鹵化磷和有限量的水作用,水解產物是氫鹵酸和鹵氧化磷(或鹵化磷先)POX3。:
PX5+H2O=POX3+2HX.
鹵化氧磷是許多金屬鹵化物的非水溶劑,它們也能和許多金屬鹵化物形成配合物,如ZrCl4▪2POCl3,這種配合物套用於分離Zr和Hf。
製備方法
白磷
將磷酸鈣、石英砂(SiO2)和炭粉的混合物放在電弧爐中熔燒還原:
2Ca3(PO4)2+6SiO2+10C=1373——1713k=6CaSiO3+P4+10CO
把生成的磷蒸氣P4通過水麵下冷卻,就得到凝固的白色固體──白磷。
該反應的本質是碳把高氧化態的磷還原成單質磷,單純的碳還原磷酸鈣的反應需要很高的溫度,加入石英砂後可大大降低反應溫度。
紅磷
將白磷隔絕空氣加熱到533K就轉變為無定形紅磷。它是一種暗紅色的粉末,不溶於水、鹼和CS2中,基本無毒,其化學性質也比較穩定,雖然可與各種氧化劑反應,但不如白磷那樣猛烈,在空氣中也不自燃,加熱到673K以上才著火。若與空氣長期接觸也會極其緩慢的氧化,形成易吸水的氧化物,所以紅磷保存在未密閉的容器中會逐漸潮解,使用前應小心用水洗滌、過濾和烘乾。
黑磷
黑磷是磷的一種最穩定的變體,但因形成它所需的活化能很高,故在一般條件下,其他變體不容易轉變為黑磷,只有在1200MPa(12000atm的壓力下,將白磷加熱到473K方能轉化類似石墨片狀結構的黑磷。黑磷能導電。在磷的主要三種同素異形體中,黑磷的密度最大(2.7克每立方厘米),不溶於有機溶劑,一般不易發生化學反應。
工業上用白磷來製備高純度的磷酸,生產有機磷殺蟲劑、煙幕彈等。含有少量磷青銅叫做磷青銅,它富有彈性、耐磨、抗腐蝕,用於製作軸承、閥門等。大量紅磷用於火柴生產,火柴盒側面所塗物質就是紅磷與三硫化二銻等的混合物。磷還用於製備發光二極體的半導體材料如GaASxP1-x等。
毒理性質
急救措施
皮膚接觸:立即脫去污染的衣著,用大量流動清水沖洗20~30分鐘。如有不適感,就醫。
眼睛接觸:提起眼瞼,用流動清水或生理鹽水沖洗。如有不適感,就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。呼吸、心跳停止,立即進行心肺復甦術。就醫。
食入:飲水,禁止催吐。如有不適感,就醫。
消防措施
危險特性:遇明火、高熱、摩擦、撞擊有引起燃燒的危險。與溴混合能發生燃燒。與大多數氧化劑如氯酸鹽、硝酸鹽、高氯酸鹽或高錳酸鹽等組成爆炸性能十分敏感的化合物。燃燒時放出有毒的刺激性煙霧。
有害燃燒產物:氧化磷。
滅火注意事項及措施:小火可用乾燥砂土悶熄。大火用水滅火。待火熄滅後,須用濕沙土覆蓋,以防復燃。清理時須注意防範,以免灼傷。
泄漏應急措施
應急處理:消除所有點火源。隔離泄漏污染區,限制出入。建議應急處理人員戴防塵口罩,穿防毒、防靜電服。禁止接觸或跨越泄漏物。小量泄漏:用潔淨的鏟子收集泄漏物,置於乾淨、乾燥、蓋子較松的容器中,將容器移離泄漏區。大量泄漏:用水潤濕,並築堤收容。防止泄漏物進入水體、下水道、地下室或密閉性空間。
接觸控制/個體防護
工程控制:密閉操作,局部排風。
呼吸系統防護:可能接觸其粉塵時,應該佩戴過濾式防塵呼吸器。
眼睛防護:戴化學安全防護眼鏡。
身體防護:穿一般作業工作服。
手防護:戴一般作業防護手套。
其他防護:工作現場禁止吸菸、進食和飲水。工作完畢,淋浴更衣。及時換洗工作服。
穩定性和反應性
穩定性:穩定
禁忌物:強氧化劑、酸類、醯基氯、酸酐。
避免接觸條件:光照。
聚合危害:不聚合
分解產物:氮氧化物。
毒理學信息
急性毒性:
LD50:11.5mg/kg(大鼠經口)
廢棄處置
廢棄物性質:危險廢物
廢棄處置方法:用控制焚燒法處置。
廢棄注意事項:把倒空的容器歸還廠商或在規定場所掩埋。
運輸信息
危規號:41001
UN編號:1338
包裝標誌:易燃固體
包裝類別:Ⅲ類包裝
包裝方法:金屬容器外堅固木箱;螺紋口玻璃瓶、鐵蓋壓口玻璃瓶、塑膠瓶或金屬桶(罐)外普通木箱。
運輸注意事項:運輸時運輸車輛應配備相應品種和數量的消防器材及泄漏應急處理設備。裝運本品的車輛排氣管須有阻火裝置。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與氧化劑、鹵素、鹵化物、等混裝混運。運輸途中應防曝曬、雨淋,防高溫。中途停留時應遠離火種、熱源。車輛運輸完畢應進行徹底清掃。鐵路運輸時要禁止溜放。
儲存方法
操作注意事項:密閉操作,局部排風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防塵口罩,戴化學安全防護眼鏡。遠離火種、熱源,工作場所嚴禁吸菸。使用防爆型的通風系統和設備。避免產生粉塵。避免與氧化劑、鹵素、鹵化物接觸。搬運時要輕裝輕卸,防止包裝及容器損壞。禁止震動、撞擊和摩擦。配備相應品種和數量的消防器材及泄漏應急處理設備。倒空的容器可能殘留有害物。
儲存注意事項:儲存於陰涼、通風的庫房。庫溫不超過35℃,相對濕度低於80%。遠離火種、熱源。應與氧化劑、鹵素、鹵化物等分開存放,切忌混儲。採用防爆型照明、通風設施。禁止使用易產生火花的機械設備和工具。儲區應備有合適的材料收容泄漏物。禁止震動、撞擊和摩擦。
套用領域
食物中有很豐富的磷,故磷缺乏是少見的,磷攝入或吸收的不足可以出現低磷血症,引起紅細胞、白細胞、血小板的異常,軟骨病;因疾病或過多的攝入磷,將導致高磷血症,使血液中血鈣降低導致骨質疏鬆。
對人體的影響
1.磷和鈣都是骨骼牙齒的重要構成材料,促成骨骼和牙齒的鈣化不可缺少的營養素。有些嬰兒因為缺少鈣和磷,常發生軟骨病或佝僂病。骨骼和牙齒的主要成分叫做磷灰石,它就是由磷和鈣組成的。人到成年時,雖然骨骼已經停止生長,但其中的鈣與磷仍在不斷更新,每年約更新20%。也就是說,每隔5年就更新一遍。可是牙齒一旦長出後,便會失去自行修復的能力。如果兒童長牙時缺鈣,牙齒就容易損壞。
2.保持體內ATP代謝的平衡。
3.磷是組成遺傳物質核酸的基本成分之一,而核苷酸是生命中傳遞信息和調控細胞代謝的重要物質——核糖核酸(RNA)和脫氧核糖核酸(DNA)的基本組成單位。
4.參與體內的酸鹼平衡的調節,參與體內能量的代謝。人體中許多酶也都含有磷。碳水化合物、脂肪、蛋白質這3種含熱能的營養素在氧化時會放出熱能,但這種能量並不是一下子放出來的,這其中磷在貯存與轉移能量的過程中扮演著重要角色。
對植物的影響
磷肥能夠促進番茄花芽分化,提早開花結果,促進幼苗根系生長和改善果實品質。缺磷時,幼芽和根系生長緩慢,植株矮小,葉色暗綠,無光澤,背面紫色。
番茄對磷的吸收以植株生長前期為高,在第一穗果實長到核桃大小時,植株吸磷量約占全生育期90%。所以,番茄苗期不能缺磷,以免影響花芽分化。番茄吸收磷肥的能力較弱,尤其在低溫下的吸收率較低。磷肥一般作基肥,也可用0.5%磷酸二氫鉀溶液作葉面噴施,進行根外追肥。磷在植物體內促進胺基酸,蛋白質和碳水化合物的合成和運輸,對延遲植株衰老,延長結果期,增加後期產量有良好的作用。
磷通常成正磷酸鹽(磷酸氫根或磷酸二氫根)形式被植物吸收。當磷進入植物體後,大部分成為有機物,有一部分仍然保持無機鹽的形式。磷以磷酸根形式存在於糖磷酸、核酸、核苷酸、輔酶、磷脂、植酸等中。磷在ATP的反應中起關鍵作用,磷在糖類代謝、蛋白質代謝、和脂肪代謝中起著重要的作用。
施磷能夠促進各種代謝正常進行,植物生長發育良好,同時提高植物的抗寒性和抗旱性。由於磷與糖類、蛋白質和脂肪的代謝和三者相互轉變都有關係,不論栽培糧食作物、豆類作物和油類作物都需要磷肥。
缺磷時,蛋白質合成受阻,新的細胞質和細胞核形成較少,影響細胞分裂,生長緩慢,分裂也少,分枝或分櫱減少,植株矮小,葉片暗綠,可能是細胞生長慢,葉綠素含量相對提高。某些植物(如油菜)葉子有時呈紅色或紫色。因為缺磷阻礙了糖分運輸,累積了大量的糖分,有利於黃色素苷的形成。缺磷時,開花期和成熟期都延遲,產量降低,抗性減弱。
元素間的影響
磷廣泛存在於動植物組織中,並與蛋白質或脂肪結合成核蛋白、磷蛋白和磷脂等,也有少量其它有機磷和無機磷化合物。除植酸形式的磷不能被機體充分吸收和利用外,其它大都能為機體利用。穀類種子中主要是植酸形式的磷,利用率很低,但當用酵母發麵時,或預先將穀粒浸泡於熱水中,則可大大降低植酸磷的含量,從而提高其吸收率。若長期食用大量穀類食品,可形成對植酸的適應力,植酸磷的吸收率也可有不同程度的提高;磷的吸收,也需要維生素D。維生素D缺乏,常使血清無機磷酸鹽下降,所以佝僂病患者血鈣濃度往往正常,而血清無機磷含量較低。
軍事用途
白磷是一種無色或者淺黃色、半透明蠟狀物質,具有強烈的刺激性,其氣味類似於大蒜,燃點極低,一旦與氧氣接觸就會燃燒,發出黃色火焰的同時散發出濃烈的煙霧。可以用來燃燒普通燃燒材料難以燃燒的物質,其特點為能夠在狹小或空氣密度不大的空間充分燃燒,一般燃燒的溫度可以達到1000度以上,足以在有效的範圍內將所有生物體消滅。白磷彈的危害性非常大,它碰到物體後不斷地燃燒,直到熄滅,因此,當它接觸到人的身體後,肉皮會被穿透,然後再深入到骨頭。
白磷燃燒彈即套用此性質,是非常厲害的燃燒彈,沾到皮膚上的話很難及時去除,燃燒溫度又高,可以一直燒到骨頭,同時產生的煙霧對眼鼻刺激極大。最初美國人用它對付在太平洋諸島工事裡的日本人,非常有效。技術含量不大,各國軍隊基本都有。
白磷彈基本結構,就是在彈體內充填磷藥,遇空氣即開始自燃直到消耗完為止。完整的白磷彈由彈底、炮彈底塞、塑膠墊圈、起爆藥、起爆藥室、黃磷發煙罐、鋁質隔片、彈體、銷針、限位器、保險與解除保險裝置、延期雷管、拋射藥和機械時間瞬發引信組成。
例如:MK·77白磷炮彈是一種攻擊型燃燒武器,功能與噴火器相似,彈體內含有大量粘稠劑,能粘在人體和裝備上燃燒,通常用於打擊裸露或易燃目標,殺傷效果極佳,曾被1980年通過的《聯合國常規武器公約》列為違禁武器,不允許對平民或在平民區使用。儘管美國沒有簽署該公約,似乎可不受其制約,但作為一項被80多個國家所接受的國際性公約,其普遍性和合法性已毋容置疑,而美國作為國際社會的一員,理應自覺遵守,否則就會引起國際公憤,陷己於孤立境地。
白磷炮彈主要用作燃燒彈某些情況下也可代替照明彈,二戰末期各國陸軍就開始使用了,美軍似乎是放在化學迫擊炮連內.
煙幕彈中裝有白磷,當其引爆後,白磷會在空氣中迅速燃燒:4P+5O2===(點燃)2P2O5生成物P2O5.後與空氣中的水分以生化學反應:P2O5+H2O====2HPO3(偏磷酸),P2O5+3H2O===2H3PO4(磷酸),這些酸液微滴與一部分未發生反應的白色小顆粒狀P2O5懸浮在空氣中便形成了煙霧。
處白磷燃燒彈作用範圍,最有效方法是全身浸入水中隔絕空氣,降低溫度。對於傷處,應立即進行外科處理(將傷處切除)。
生命元素
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
化學元素(一)
元素性質
| 為了方便閱讀者查閱元素周期表中各元素符號的性質及特點,比較系統的歸納和總結各元素的套用價值及注意事項,從而為需要相關知識的人們形成知識的鏈條,本次主要是對有些元素的內容進行補充及完善。 |

