研究簡史
發現歷史
 約瑟夫·普里斯特利
約瑟夫·普里斯特利普利斯特里對氧氣的研究
 氧氣
氧氣普利斯特里從布萊克煅燒石灰石對CO的發現受到啟發,利用凸透鏡聚集太陽光使一些物質燃燒或分解放出氣體並進行研究。1774年8月1日,普利斯特里終於成功地製得了氧氣,成為化學史上有重大意義的事件。
他的實驗非常簡單,把氧化汞放在一個充滿水銀的玻璃瓶里,然後,把玻璃瓶倒放在水銀槽中,玻璃瓶完全被水銀充滿,空氣全被排除掉,氧化汞浮在最上面。然後,他用凸透鏡聚集太陽光,照射到氧化汞上,使氧化汞受熱。
經過長期加熱,溫度逐漸升高,氧化汞受熱分解成汞,並放出氧氣。於是,氧氣聚集起來排走玻璃瓶中的汞,使汞面降低。氣體空間體積不斷增加,直到氣體體積為氧化汞體積的三四倍為止。
但是,當初他並不知道製得的純淨氣體是氧氣。儘管如此,細心的普利斯特里又做了許多試驗來了解這種氣體的性質,以及它同別種“空氣”的區別。他的研究方法是:
他將研究的氣體放在玻璃瓶中,倒一些水進去,該氣體不溶解。
他把燃燒的蠟燭放進該氣體中,蠟燭竟放出耀眼的強光。
他把一隻老鼠放到充滿該氣體的瓶子裡,老鼠活蹦亂跳,很自在,他猜想人吸入了可能也好受。
他用玻璃管把大瓶中的氧氣吸入肺中,並記下自己的感覺:“我覺得十分愉快,我肺部的感覺好像和平常呼吸空氣一樣,沒有什麼不適。而且,吸進這種氣體後,好久好久,身體還是十分輕鬆愉快。也許,有一天,誰能斷定這種氣體不會變成時髦的奢侈品呢?不過。現在,世界上能夠享受這種氣體的愉快,只有兩隻老鼠和我自己。”
普氏從上述實驗中得出,該氣體有助燃、助呼吸作用,這些性質與一般空氣類似,但作用更強。但是,他把氧氣所這種新氣體錯誤地用燃素說來解釋,並把製得的氧氣稱為“脫燃素空氣”。由於運用了錯誤的理論,這種命名是不恰當的。
舍勒對氧氣的發現
1772年,舍勒對空氣進行研究後,他首先認識到氧氣是空氣的一種重要成分。他用硫磺和鐵粉混合,在空氣中燃燒,消耗掉鐘罩中空氣中的氧氣而製得氮氣,當時他稱它為“濁氣”或“用過的空氣”,或能使人死亡的氣體。
經過思索,舍勒明白了,原來當時人們認為空氣是一種元素的觀點是錯誤的。他猜想:空氣是兩種不同物質的混合,一種是濁氣,能使人死亡的空氣;一種是能使人活命的空氣,能幫助燃燒,在燃燒中消失。於是,舍勒產生了興趣,並開始了他的實驗。
1773年,他把硝石(KNO)裝進曲頸瓶,瓶口系一個排完空氣的豬膀胱,再把曲頸瓶放到火爐上去燒。硝石融化時分解,放出一種氣體,很快把豬膀胱充滿了,這種氣體正是那種能活命的氣體,即現在所知道的氧氣。
舍勒進行了仔細的鑑別,他把紅熱的木炭扔到充滿“能活命的氣體”的瓶中,木炭迅速燃燒,光亮耀眼,比在普通空氣中燃燒得更快更亮。舍勒將 的這種氣體和 濁氣混合於瓶中,蠟燭能正常燃燒,老鼠也同在普通空氣中一樣呼吸。由此他確定這種氣體是一種純淨的能活命的氣體。
舍勒給這種氣體命名為“火空氣”,因為他發現除硝石外,加熱氧化汞、高錳酸鉀、碳酸銀、碳酸汞,均能釋放出氧氣來。
 拉瓦錫
拉瓦錫拉瓦錫對氧氣的研究
拉瓦錫對氧氣的發現是在普里斯特里啟發下完成的。1774年,拉瓦錫用汞灰(HgO)的合成與分解實驗製得氧氣,並對它進行了系統的研究,發現它能與很多非金屬單質合成多種酸,故命名為“酸氣”(希臘文Oxygene)。
拉瓦錫通過氧氣的實驗,提出了燃燒的氧化學說,推翻了燃素說,發動了化學史上著名的化學革命,使過去以燃素說形式倒立著的化學正立過來。因此,雖然不是他首先發現氧氣,但恩格斯還是稱他為“真正發現氧氣的人”,而舍勒和普利斯特里是“當真理碰到鼻尖上的時候還是沒有得到真理”。
1802年,德國東方學者克拉普羅特偶然讀到一本64頁的漢文手抄本,書名是《平龍認》,作者是馬和,著作年代是唐代至德元年(公元756年)。克拉普羅特讀完此書以後,驚奇地發現,這本講述如何在大地上尋找“龍脈”的堪輿家著作,竟揭示了深刻的科學道理:空氣和水裡都有氧氣存在。
1807年,克拉普羅特在彼得堡俄國科學院學術討論會上宣讀了一篇論文,題目是《第八世紀中國人的化學知識》,其中提到,空氣中存在“陰陽二氣”,用火硝、青石等物質加熱後就能產生“陰氣”;水中也有“陰氣”,它和“陽氣”緊密結合在一起,很難分解。克拉普羅特指出,馬和所說的“陰氣”,就是氧氣。證明中國早在唐朝就知道氧氣的存在並且能夠分解它,比歐洲人發現氧氣足足早了1000多年。克拉普羅特這篇論文使在場的科學家都感到驚奇不已。
名稱由來
氧氣(Oxygen)希臘文的意思是“酸素”,該名稱是由法國化學家拉瓦錫所起,原因是拉瓦錫錯誤地認為,所有的酸都含有這種新氣體。日文里氧氣的名稱仍然是“酸素”。
氧氣的中文名稱是清朝徐壽命名的。他認為人的生存離不開氧氣,所以就命名為“養氣”即“養氣之質”,後來為了統一就用“氧”代替了“養”字,便叫這“氧氣”。
分子結構
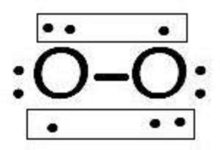 氧氣的結構
氧氣的結構O分子內的化學鍵通常是共價鍵。
從實驗上來說,順磁共振光譜證明O有順磁性,還證明O有兩個未成對地電子。說明原來的以雙鍵結合的氧分子結構式不符合實際。
氧氣的結構如右圖所示,基態O分子中並不存在雙鍵,氧分子裡形成了兩個三電子鍵。
氧的分子軌道電子排布式是 ,在π軌道中有不成對的單電子,所以O分子是所有雙原子氣體分子中唯一的一種具有偶數電子同時又顯示順磁性的物質。
兩個氧原子進行sp軌道雜化,一個單電子填充進sp雜化軌道,成σ鍵,另一個單電子填充進p軌道,成π鍵。氧氣是奇電子分子,具有順磁性。
單線態氧和三線態氧
普通氧氣含有兩個未配對的電子,等同於一個雙游離基。兩個未配對電子的自鏇狀態相同,自鏇量子數之和S=1,2S+1=3,因而基態的氧分子自鏇多重性為3,稱為三線態氧。
在受激發下,氧氣分子的兩個未配對電子發生配對,自鏇量子數的代數和S=0,2S+1=1,稱為單線態氧。
空氣中的氧氣絕大多數為三線態氧。紫外線的照射及一些有機分子對氧氣的能量傳遞是形成單線態氧的主要原因。單線態氧的氧化能力高於三線態氧。
單線態氧的分子類似烯烴分子,因而可以和雙烯發生狄爾斯-阿爾德反應。
物化性質
物理性質
 氧氣瓶
氧氣瓶無色無味氣體,熔點218.8℃,沸點-183.1℃,相對密度1.14(-183℃,水=1),相對蒸氣密度1.43(空氣=1),飽和蒸氣壓506.62kPa(-164℃),臨界溫度-118.95℃,臨界壓力5.08MPa,辛醇/水分配係數:0.65。大氣中體積分數:20.95%(約21%)。
同素異形體:臭氧(O),四聚氧(O),紅氧(O)。
| 性質 | 條件或符號 | 單位 | 數據 |
| 氣體密度 | 克/立方厘米 | 0.001331 | |
| 液體密度 | 千克/升 | 1.141 | |
| 氣體比重 | 空氣=1 | 1.105 | |
| 摩爾體積 | 標準狀況 | 升/摩爾 | 22.39 |
| 溶解熱 | 千焦/摩爾 | 0.44 | |
| 氣化熱 | 千焦/摩爾 | 6.82 | |
| 介電常數 | 20℃,1大氣壓 | 1.0004947+2 | |
| 液氧介電常數 | -193℃ | 1.507 | |
| 折射係數 | 0℃,1大氣壓 | 1.000271 | |
| 磁感性 | 20℃ | 立方厘米/克 | 106.2 |
| 遷移率 | 正離子 負離子 | 平方厘米/伏.秒 平方厘米伏.秒 | 1.32 1.83 |
| 擴散係數 (同種氣體中) | 0℃,133.3Pa 正離子 負離子 | 平方厘米/伏.秒 平方厘米/伏.秒 | 21.3 32.0 |
| 在水中的分子擴散係數 | 20℃ | 平方厘米/伏.時 | 6.7×10 |
| 電離能 | 氧分子 | 千焦/摩爾 | 1165.9 |
表格參考資料來源:高純氣體
化學性質
氧氣的化學性質比較活潑。除了稀有氣體、活性小的金屬元素如金、鉑、銀之外,大部分的元素都能與氧氣反應,這些反應稱為氧化反應,而經過反應產生的化合物(有兩種元素構成,且一種元素為氧元素)稱為氧化物。一般而言,非金屬氧化物的水溶液呈酸性,而鹼金屬或鹼土金屬氧化物則為鹼性。此外,幾乎所有的有機化合物,可在氧中劇烈燃生成二氧化碳與水。化學上曾將物質與氧氣發生的化學反應定義為氧化反應,氧化還原反應指發生電子轉移或偏移的反應。氧氣具有助燃性,氧化性。
| 化學方程式 | 現象 | |
|---|---|---|
| 與鉀的反應 | 4K+O 2 =2K 2 O | 鉀的表面變暗 |
| 2K+O 2 =K 2 O 2 | ||
| K+O 2 =KO 2 ( 超氧化鉀 ) | ||
| 與鈉的反應 | 4Na+O 2 =2Na 2 O | 鈉的表面變暗 |
| 產生黃色火焰,放出大量的熱,生成淡黃色粉末 | ||
| 與鎂的反應 | 2Mg+O 2 = =2MgO | 劇烈燃燒發出耀眼的強光,放出大量熱,生成白色粉末狀固體。 |
| 與鋁的反應 | 4Al+3O 2 = =2Al 2 O 3 | 發出明亮的光,放出熱量,生成白色固體。 |
| 與鐵的反應 |  (鐵鏽的形成) (鐵鏽的形成) | |
| 3Fe+2O 2 = =Fe 3 O 4 | 紅熱的鐵絲劇烈燃燒,火星四射,放出大量熱,生成黑色固體。鐵絲在充滿氧氣的集氣瓶中燃燒 | |
| 與鋅的反應 | 2Zn+O 2 = =2ZnO | |
| 與銅的反應 |  | 加熱後亮紅色的銅絲表面生成一層黑色物質。 |
| 化學方程式 | 現象 | |
|---|---|---|
| 與氫氣的反應 | 2H 2 +O 2 = =2H 2 O | 安靜地燃燒,產生淡藍色的火焰,生成水並放出大量的熱。 [8] |
| 與碳的反應 | C+O 2 = =CO 2 | 劇烈燃燒,發出白光,放出熱量,生成使 澄清石灰水 變渾濁的氣體。 [9] |
| 2C+O 2 = =2CO (氧氣不充足時) | ||
| 與硫的反應 | S+O 2 = =SO 2 | 在空氣中燃燒,發出微弱的淡藍色火焰;在純氧中燃燒得更旺,發出藍紫色火焰,放出熱量,生成有刺激性氣味的氣體 [10] 。該氣體能使澄清石灰水變渾濁,且能使酸性高錳酸鉀溶液或 品紅 溶液褪色,褪色的品紅溶液加熱後顏色又恢復為紅色。硫在氧氣中燃燒 |
| 與 紅磷 的反應 | 4P+5O 2 = =2P 2 O 5 | 發出耀眼白光,放熱,生成大量白煙。 |
| 與 白磷 的反應 |  | 白磷在空氣中自燃,發光發熱,生成白煙。 |
| 與氮氣的反應 | N 2 +O 2 = =2NO |
| 如甲烷、乙炔、酒精、石蠟等能在氧氣中燃燒生成水和二氧化碳。 氣態烴類的燃燒通常發出明亮的藍色火焰,放出大量的熱,生成水和能使澄清石灰水變渾濁的氣體。 | ||
| 甲烷 | CH 4 +2O 2 = =CO 2 +2H 2 O | |
| 乙烯 | C 2 H 4 +3O 2 = =2CO 2 +2H 2 O | |
| 乙炔 | 2C 2 H 2 +5O 2 = =4CO 2 +2H 2 O | |
| 苯 | 2C 6 H 6 +15O 2 = =12CO 2 +6H 2 O | 在空氣中燃燒時,火焰明亮並有濃黑煙。 |
| 甲醇 | 2CH 3 OH+3O 2 = =2CO 2 +4H 2 O | |
| 乙醇 | CH 3 CH 2 OH+3O 2 = =2CO 2 +3H 2 O | |
| 烴 的燃燒通式 |  = = x CO 2 +2 y H 2 O (通式完成後應注意化簡!下同) = = x CO 2 +2 y H 2 O (通式完成後應注意化簡!下同) | |
| 碳氫氧化合物與氧氣發生燃燒的通式 | 4C x H y O z +(4 x + y -2 z )O 2 = =4 x CO 2 +2 y H 2 O | |
| 乙醇被氧氣氧化 | 此反應包含兩個步驟: | |
| 氯仿與氧氣的反應 | 2CHCl 3 +O 2 =2COCl 2 (光氣)+2HCl | |
| 硫化氫 的燃燒 | 2H 2 S+3O 2 (過量)= =2H 2 O+2SO 2 [11] 2H 2 S+O 2 (少量)= =2H 2 O+2S [11] |
| 煅燒 黃鐵礦 | 4FeS 2 +11O 2 = =2Fe 2 O 3 +8SO 2 |
| 二氧化硫的催化氧化 | 2SO 2 +O 2 ← →2SO 3 |
| 空氣中硫酸酸雨的形成 | 2SO 2 +O 2 +2H 2 O=2H 2 SO 4 |
| 氨在純氧中的燃燒 | 4NH 3 +3O 2 (純)= =2N 2 +6H 2 O |
| 氨的催化氧化 | |
| 一氧化氮 與氧氣的反應 | 2NO+O 2 =2NO 2 |
| 轉化為 臭氧 的反應 | 3O 2 = =2O 3 (該反應為可逆反應) |
製取方法
實驗室製法
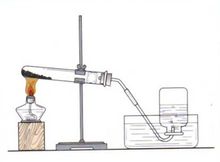 加熱氯酸鉀或高錳酸鉀製取氧氣
加熱氯酸鉀或高錳酸鉀製取氧氣1、加熱高錳酸鉀:(中學教材為)。
2、二氧化錳與氯酸鉀共熱: (製得的氧氣中含有少量、和微量;部分教材已經刪掉;該反應實際上是放熱反應,而不是吸熱反應,發生上述1mol反應,放熱108kJ)。
3、過氧化氫溶液催化分解(催化劑主要為二氧化錳,三氧化二鐵、氧化銅也可)。
| 實驗先查氣密性,受熱均勻試管傾。 收集常用排水法,先撤導管後移燈。 解釋: 1、實驗先查氣密性,受熱均勻試管傾:“試管傾”的意思是說,安裝大試管時,應使試管略微傾斜,即要使試管口低於試管底,這樣可以防止加熱時藥品所含有的少量水分變成水蒸氣,到管口處冷凝成水滴而倒流,致使試管破裂。“受熱均勻”的意思是說加熱試管時必須使試管均勻受熱。 2、收集常用排水法:意思是說收集氧氣時要用排水集氣法收集。 3、先撤導管後移燈:意思是說在停止制氧氣時,務必先把導氣管從水槽中撤出,然後再移去酒精燈(如果先撤去酒精燈,則因試管內溫度降低,氣壓減小,水就會沿導管吸到熱的試管里,致使試管因急劇冷卻而破裂)。 |
工業製法
1、分離液態空氣法
 空氣液化裝置示意圖
空氣液化裝置示意圖在低溫條件下加壓,使空氣轉變為液態,然後蒸發,由於液態氮的沸點是‐196℃,比液態氧的沸點(‐183℃)低,因此氮氣首先從液態空氣中蒸發出來,剩下的主要是液態氧。
空氣中的主要成分是氧氣和氮氣。利用氧氣和氮氣的沸點不同,從空氣中製備氧氣稱空氣分離法。首先把空氣預冷、淨化(去除空氣中的少量水分、二氧化碳、乙炔、碳氫化合物等氣體和灰塵等雜質)、然後進行壓縮、冷卻,使之成為液態空氣。然後,利用氧和氮的沸點的不同,在精餾塔中把液態空氣多次蒸發和冷凝,將氧氣和氮氣分離開來,得到純氧(可以達到99.6%的純度)和純氮(可以達到99.9%的純度)。如果增加一些附加裝置,還可以提取出氬、氖、氦、氪、氙等在空氣中含量極少的稀有惰性氣體。由空氣分離裝置產出的氧氣,經過壓縮機的壓縮,最後將壓縮氧氣裝入高壓鋼瓶貯存,或通過管道直接輸送到工廠、車間使用。使用這種方法生產氧氣,雖然需要大型的成套設備和嚴格的安全操作技術,但是產量高,每小時可以產出數千、萬立方米的氧氣,而且所耗用的原料僅僅是不用買、不用運、不用倉庫儲存的空氣,所以從1903年研製出第一台深冷空分制氧機以來,這種制氧方法一直得到最廣泛的套用。
2、膜分離技術
膜分離技術得到迅速發展。利用這種技術,在一定壓力下,讓空氣通過具有富集氧氣功能的薄膜,可得到含氧量較高的富氧空氣。利用這種膜進行多級分離,可以得到百分之九十以上氧氣的富氧空氣。
3、分子篩制氧法(吸附法)
利用氮分子大於氧分子的特性,使用特製的分子篩把空氣中的氧離分出來。首先,用壓縮機迫使乾燥的空氣通過分子篩進入抽成真空的吸附器中,空氣中的氮分子即被分子篩所吸附,氧氣進入吸附器內,當吸附器內氧氣達到一定量(壓力達到一定程度)時,即可打開出氧閥門放出氧氣。經過一段時間,分子篩吸附的氮逐漸增多,吸附能力減弱,產出的氧氣純度下降,需要用真空泵抽出吸附在分子篩上面的氮,然後重複上述過程。這種製取氧的方法亦稱吸附法.利用吸附法制氧的小型制氧機已經開發出來,便於家庭使用。
4、電解制氧法
把水放入電解槽中,加入氫氧化鈉或氫氧化鉀以提高水的電解度,然後通入直流電,水就分解為氧氣和氫氣。每製取一立方米氧,同時獲得兩立方米氫。用電解法製取一立方米氧要耗電12~15千瓦小時,與上述兩種方法的耗電量(0.55~0.60千瓦小時)相比,是很不經濟的。所以,電解法不適用於大量制氧。另外同時產生的氫氣如果沒有妥善的方法收集,在空氣中聚集起來,如與氧氣混合,容易發生極其劇烈的爆炸。所以,電解法也不適用家庭制氧的方法。
| 電解 硫酸銅 溶液 | 2CuSO 4 +2H 2 O= =2Cu↓+2H 2 SO 4 +O 2 ↑ |
| 電解水 | 2H 2 O= =2H 2 +O 2 ↑ |
| 光合作用總反應式 | 6CO 2 +6H 2 O— →C 6 H 12 O 6 +6O 2 ↑ |
| 濃硝酸 受熱或見光分解 | |
| 電解 硝酸銀 溶液 | 4AgNO 3 +2H 2 O = =4Ag↓+4HNO 3 +O 2 ↑ |
| 高鐵酸鈉 受熱分解(此反應有待考證) | |
| 氟氣 與水的反應 | |
| 電解 鋁 | 2Al 2 O 3 = =4Al+3O 2 ↑ |
| 加熱 氧化銅 |  |
| 加熱 氧化汞 |  |
主要用途
冶煉工藝:在煉鋼過程中吹以高純度氧氣,氧便和碳及磷、硫、矽等起氧化反應,這不但降低了鋼的含碳量,還有利於清除磷、硫、矽等雜質。而且氧化過程中產生的熱量足以維持煉鋼過程所需的溫度,因此,吹氧不但縮短了冶煉時間,同時提高了鋼的質量。高爐煉鐵時,提高鼓風中的氧濃度可以降焦比,提高產量。在有色金屬冶煉中,採用富氧也可以縮短冶煉時間提高產量。
化學工業:在生產合成氨時,氧氣主要用於原料氣的氧化,以強化工藝過程,提高化肥產量。再例如,重油的高溫裂化,以及煤粉的氣化等。
國防工業:液氧是現代火箭最好的助燃劑,在超音速飛機中也需要液氧作氧化劑,可燃物質浸漬液氧後具有強烈的爆炸性,可製作液氧炸藥。
醫療保健:供給呼吸:用於缺氧、低氧或無氧環境,例如:潛水作業、登山運動、高空飛行、宇宙航行、醫療搶救等時。
其它方面:它本身作為助燃劑與乙炔、丙烷等可燃氣體配合使用,達到焊割金屬的作用,各行各業中,特別是機械企業里用途很廣,作為切割之用也很方便,是首選的一種切割方法。
危險與防控
毒理學資料
1、急性毒性:人類吸入TC:100pph/14H;
2、繁殖數據:
女人懷孕後26-39周吸入TC:12pph/10M生殖系統和心血管系統出現異常;
大母鼠受孕後22天吸入TD:10pph/12H生殖和呼吸系統出現異常;
大母鼠受孕後22天吸入TD:10pph/9H對生殖、呼吸系統和新生兒生長出現抑制作用;
小鼠受孕後8天吸入TC:10pph/24H皮膚和皮下組織及生殖出現異常;
3、致突變性:
人類淋巴細胞40pph/4D對細胞遺傳有影響;
齧齒動物-倉鼠卵巢20pph/3D (Continuous) 對細胞遺傳有影響;
齧齒動物-倉鼠肺80pph對細胞遺傳有影響;
齧齒動物-倉鼠卵巢姐妹染色體20pph複製受影響;
齧齒動物-倉鼠肺95pph/24H引起細胞突變。
4、亞急性與慢性毒性:常壓下,在80%氧中生活4d,大鼠開始陸續死亡,兔的視細胞全部損毀;在純氧中,兔48h視細胞全部損毀,狗60h有死亡,猴3d出現呼吸困難,6~9d死亡。
5、其他毒害作用:TC:100%(100%)(人吸入,14h);TCLo:80%(大鼠吸入)。
過度吸氧負作用:
早在19世紀中葉,英國科學家保爾·伯特首先發現,如果讓動物呼吸純氧會引起中毒,人類也同樣。人如果在大於0.05MPa(半個大氣壓)的純氧環境中,對所有的細胞都有毒害作用,吸入時間過長,就可能發生“氧中毒”。肺部毛細管屏障被破壞,導致肺水腫、肺淤血和出血,嚴重影響呼吸功能,進而使各臟器缺氧而發生損害。在0.1MPa(1個大氣壓)的純氧環境中,人只能存活24小時,就會發生肺炎,最終導致呼吸衰竭、窒息而死。人在0.2MPa(2個大氣壓)高壓純氧環境中,最多可停留小時~2小時,超過了會引起腦中毒,生命節奏紊亂,精神錯亂,記憶喪失。如加入0.3MPa(3個大氣壓)甚至更高的氧,人會在數分鐘內發生腦細胞變性壞死,抽搐昏迷,導致死亡。
此外,過量吸氧還會促進生命衰老。進入人體的氧與細胞中的氧化酶發生反應,可生成過氧化氫,進而變成脂褐素。這種脂褐素是加速細胞衰老的有害物質,它堆積在心肌,使心肌細胞老化,心功能減退;堆積在血管壁上,造成血管老化和硬化;堆積在肝臟,削弱肝功能;堆積在大腦,引起智力下降,記憶力衰退,人變得痴呆;堆積在皮膚上,形成老年斑。
| 氧氣濃度(%體積) | 徵兆(大氣壓力下) |
|---|---|
| 100% | 致命/6分鐘(絕對密閉環境,如 高壓氧艙 或深水) |
| 50% | 致命/4~5分鐘經治療可痊癒(絕對密閉環境,如高壓氧艙) |
| >23.5% | 富氧 |
| 20.9% | 氧氣濃度正常 |
| 19.5% | 氧氣最小允許濃度 |
| 15~19% | 降低工作效率,並可導致頭部、肺部和循環系統問題 |
| 10~12% | 呼吸急促,判斷力喪失,嘴唇發紫 |
| 8~10% | 智力喪失,昏厥,無意識,臉色蒼白,嘴唇發紫,噁心嘔吐 |
| 6~8% | 8分鐘 |
| 4~6% | 40秒內抽搐,呼吸停止,死亡 |
中毒或泄漏處理
急救措施
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸停止,立即進行人工呼吸。就醫。
滅火方法:用水保持容器冷卻,以防受熱爆炸,急劇助長火勢。迅速切斷氣源,用水噴淋保護切斷氣源的人員,然後根據著火原因選擇適當滅火劑滅火。
現場處理
迅速撤離泄漏污染區人員至上風處,並進行隔離,嚴格限制出入。切斷火源。建議應急處理人員戴自給正壓式呼吸器,穿一般作業工作服。避免與可燃物或易燃物接觸。儘可能切斷泄漏源。合理通風,加速擴散。漏氣容器要妥善處理,修復、檢驗後再用。
操作處置與儲存
操作注意事項:密閉操作。密閉操作,提供良好的自然通風條件。操作人員必須經過專門培訓,嚴格遵守操作規程。遠離火種、熱源,工作場所嚴禁吸菸。遠離易燃、可燃物。防止氣體泄漏到工作場所空氣中。避免與活性金屬粉末接觸。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。配備相應品種和數量的消防器材及泄漏應急處理設備。
儲存注意事項:儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。應與易(可)燃物、活性金屬粉末等分開存放,切忌混儲。儲區應備有泄漏應急處理設備。
個體防護
工程控制:密閉操作。提供良好的自然通風條件。
身體防護:穿一般作業工作服。
手防護:戴一般作業防護手套。
其他防護:避免高濃度吸入。
貯運方法
包裝方法:鋼質氣瓶。
運輸方法:氧氣鋼瓶不得沾污油脂。採用剛瓶運輸時必須戴好鋼瓶上的安全帽。鋼瓶一般平放,並應將瓶口朝同一方向,不可交叉;高度不得超過車輛的防護欄板,並用三角木墊卡牢,防止滾動。嚴禁與易燃物或可燃物、活性金屬粉末等混裝混運。夏季應早晚運輸,防止日光曝曬。鐵路運輸時要禁止溜放。
氧氣的出現
 光合作用
光合作用地球的大氣層形成初期是不含氧氣的。原始大氣是還原性的,充滿了甲烷、氨等氣體。
大氣層氧氣的出現源於兩種作用,一個是非生物參與的水的光解,一個是生物參與的光合作用。
生物的光合作用對大氣層的影響巨大。它造成了大氣層由還原氛圍向氧化氛圍的轉變。使得水光解產生的氫氣能重新被氧化為水回到地球而不至於擴散到外層空間去,從而防止了地球上的水的流失。同時光合作用也加速了大氣層氧氣的積累,深刻地改變了地球上物種的代謝方式和體型。大氣層含氧量在石炭紀的時候一度上升到了35%。氧氣含量的增加造成了依賴於滲透方式輸氧的昆蟲在體型上的巨型化。在石炭紀曾出現過翼展2英尺半的巨蜻蜓。

