發現簡史
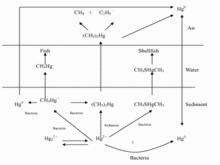 汞的遷移循環
汞的遷移循環汞在自然界中分布量極小,被認為是稀有金屬,但是人們很早就發現了水銀。天然的硫化汞又稱為硃砂,由於具有鮮紅的色澤,因而很早就被人們用作紅色顏料。根據殷虛出土的甲骨文上塗有丹砂,可以證明中國在有史以前就使用了天然的硫化汞。
根據中國古文獻記載:在秦始皇死以前,一些王侯在墓葬中也早已使用了灌輸水銀,例如齊桓公葬在今山東臨淄縣,其墓中傾水銀為池。這就是說,中國在公元前7世紀或更早已經取得大量汞。
中國古代還把汞作為外科用藥。1973年長沙馬王堆漢墓出土的帛書中的《五十二藥方》,抄寫年代在秦漢之際,是現已發掘的中國最古醫方,可能處於戰國時代。其中有四個藥方就套用了水銀。例如用水銀、雄黃混合,治療疥瘡等。
 “汞”楷書形式
“汞”楷書形式東西方的鍊金術士們都對水銀髮生了興趣。西方的鍊金術士們認為水銀是一切金屬的共同性——金屬性的化身。他們所認為的金屬性是一種組成一切金屬的“元素”。
中國古代勞動人民把丹砂(也就是硫化汞),在空氣中煅燒得到汞。但是生成的汞容易揮發,不易收集,而且操作人員會發生汞中毒。中國勞動人民在實踐中積累經驗,改用密閉方式制汞,有的是密閉在竹筒中,有的是密閉的石榴罐中。
根據西方化學史的資料,曾在埃及古墓中發現一小管水銀,據歷史考證是公元前16—前15世紀的產物。但中國古代勞動人民首先製得了大量水銀。
礦產分布
礦藏
汞是自然生成的元素,見於空氣、水和土壤中。
汞是一種劇毒非必需元素,廣泛存在於各類環境介質和食物鏈(尤其是魚類)中,其蹤跡遍布全球各個角落。
世界汞礦資源量約70萬噸,基礎儲量30萬噸。擁有汞儲量的主要國家及其基礎儲量有西班牙9萬噸,義大利6.9萬噸,中國8.14萬噸,吉爾吉斯斯坦4.5萬噸。世界汞礦床主要分布在特提斯—喜馬拉雅構造帶上。汞礦床主要類型為碳酸鹽型,其次是碎屑岩型和岩漿岩型。其中碳酸鹽型為最主要,占汞礦床的儲量的90%。
汞礦產於下寒武統地層中,產出與富集嚴格受構造、岩石組合及圍岩蝕變等綜合控制。主礦體呈層狀、似層狀,亦有順層透鏡狀的礦體產出,具明顯的層控特徵,屬層控型礦床,被公認為中國最典型的"層狀汞礦床",對國內外汞的勘查與研究具有重要意義。礦石單一,以辰砂為主。產出以星點狀、浸染狀為主,次為脈狀、條帶狀。礦石選冶性能良好。
遷移與轉化
(一)汞循環是重金屬在生態系統中循環的典型,汞以元素狀態在水體、土壤、大氣和生物圈中遷移和轉化。
(二)汞遷移、轉化的主要特點:
(1)汞是在生態系統中能完善循環的惟一重金屬。汞排入水中後,通過食物鏈,受汞污染的水中的魚體內甲基汞濃度可比水中高上萬倍。
(2)汞循環顯示複雜過程包括:顆粒物的遷移;乾、濕物的沉降;火山揮發進入大氣;入水沉積污泥中;在細菌作用下生成甲基汞;進入生物體;在生物體內累積。
(3)生物甲基化:在微生物的作用下,金屬汞和二價離子汞等無機汞會轉化成甲基汞和二甲基汞,這種轉化稱為汞的生物甲基化作用。
(4)甲基汞易被人體吸收,排出慢,而且毒性大。這是因為甲基汞易溶於脂類中;汞在體內不易分解,由於其分子結構中有碳-汞鍵不易切斷;是高神經毒劑,多在腦部積累。
物理性質
是在常溫、常壓下唯一以液態存在的金屬。熔點-38.87℃,沸點356.6℃,密度13.59克/立方厘米。內聚力很強,在空氣中穩定,常溫下蒸發出汞蒸氣,蒸氣有劇毒。天然的汞是汞的七種同位素的混合物。汞微溶於水,在有空氣存在時溶解度增大。汞在自然界中普遍存在,一般動物植物中都含有微量的汞,因此我們的食物中,都有微量的汞存在,可以通過排泄、毛髮等代謝。
合金:汞容易與大部分普通金屬形成合金,這些合金統稱汞合金(或汞齊)。能與汞形成合金的金屬包括金和銀,但不包括鐵,所以鐵粉一直以來被用於置換汞。其他一些第一行的過渡金屬難於形成合金,但不包括錳、銅和鋅。其他不易與汞形成合金的元素有鉑和其他一些金屬。鈉汞齊是有機合成中常用的還原劑,也被用於高壓鈉燈中。當汞和鋁的純金屬接觸時,它們易於形成鋁汞齊,因為鋁汞齊可以破壞防止繼續氧化金屬鋁的氧化層(毛刷實驗),所以即使很少量的汞也能嚴重腐蝕金屬鋁。出於這個原因,絕大多數情況下,汞不能被帶上飛機,因為它很容易與飛機上暴露的鋁質部件形成合金而造成危險。
液態:作為金屬的汞,在常溫下卻離奇地以液態存在。相對論收縮效應理論能為這一不尋常的現象提供解釋。與金相仿,汞的6s 軌道在收縮的同時並趨於穩定化導致了一種稱之為“惰性電子對”效應:汞的6s 殼層在成鍵過程中呈現惰性。可以看到汞的6s 6p激發能遠遠超過鎘和鋅的相應激發能。按照一般周期規律能量間隔應隨主量子數增加而減小。所以,由鋅到鎘能量間隔變小在預料之中,然而由鎘到汞該能量間隔反而陡然增加。這裡可以再次看到正是相對論收縮效應致使全滿的6s 殼層安然穩定,於是汞的6s 6p能量間隔驟增。只要得不到所需的激發能,具有惰性6s 殼層的汞原子之間就無法形成強鍵。基態Hg僅靠范德華力相互維繫,所以金屬汞在常溫下呈液態。
化學性質
溶於硝酸和熱濃硫酸,分別生成硝酸汞和硫酸汞,汞過量則出現亞汞鹽。能溶解許多金屬,形成合金,合金叫做汞齊。化合價為+1和+2。與銀類似,汞也可以與空氣中的硫化氫反應。汞具有恆定的體積膨脹係數,其金屬活躍性低於鋅和鎘,且不能從酸溶液中置換出氫。一般汞化合物的化合價是+1或+2,+4價的汞化合物只有四氟化汞,而+3價的汞化合物不存在。
毒理簡介
需要注意的是, 微量的液體汞吞食一般是無毒的(有資料稱它在生物體內會形成有機化合物),但汞蒸氣和汞鹽(除了一些溶解度極小的如硫化汞)都是劇毒的,口服、吸入或接觸後可以導致腦和肝損傷。使用溫度計一般用酒精取代汞,中華人民共和國境內(不包括港澳台地區)使用的溫度計仍然在使用汞。中國計畫在2015年前逐步禁止汞溫度計的使用。
最危險的汞有機化合物是二甲基汞[(CH)Hg],僅幾 微升 (10m或10dm或10cm)二甲基汞接觸在皮膚上就可以致死。
汞可以在生物體內積累,很容易被皮膚以及呼吸道和消化道吸收。水俁病是汞中毒的一種。汞破壞中樞神經系統,對口、黏膜和牙齒有不良影響。長時間暴露在高汞環境中可以導致腦損傷和死亡。儘管汞沸點很高,但在室內溫度下飽和的汞蒸氣已經達到了中毒劑量的數倍。
藥用領域
水銀出自《本經》。《本草圖經》:水銀,《經》雲出於丹砂者,乃是山石中采粗次硃砂,作爐置砂於中,下承以水,上覆以盎器,外加火煅養則煙飛於上,水銀溜於下,其色小白濁。至於西羌來者,彼人亦云如此燒煅。但其山中所生極多,至於一山自拆裂,人採得砂石,皆大塊如升斗,碎之乃可燒煅,故西來水銀極多於南方者。《本草衍義》:水銀,得鉛則凝,得硫黃則結,並棗肉研之則散。別法煅為膩粉、粉霜。唾研斃虱。 《綱目》:水銀,若撒失在地,但以川椒末或茶末收之。 《本經逢原》:水銀,陰毒重著,不可入人腹。今有誤食水銀,腹中重墜,用豬脂二斤,切作小塊焙熟,入生蜜拌食得下,亦一法也。
藥理作用
水銀(汞)的化合物有消毒、瀉下、利尿作用,現已不用或罕用。元素汞不引起藥理作用,解離後的汞離子能與疏基結合而干擾細胞的代謝及功能。元素汞不能自腸胃道吸收,但其表面暴露於空氣中時可形成氧化物或硫化物,因而吞食後有時可引起輕度瀉下、利尿。吞食水銀的人,大多數並無症狀,水銀自糞便排出,少數人可有某些症狀,而極少數(敏感或其他未知原因)可引起立即死亡。
水銀為一種原生質毒,能和病原微生物呼吸酶中的硫氫基結合而抑制其生活力,最後使其窒息而致死。
汞劑排泄主要由腎,其次是大腸。
1.水銀(汞)的化合物有消毒、瀉下、利尿作用,現已不用或罕用。元素汞不引起藥理作用,解離後的汞離子能與疏基結合而干擾細胞的代謝及功能。元素汞不能自腸胃道吸收,但其表面暴露於空氣中時可形成氧化物或硫化物,因而吞食後有時可引起輕度瀉下、利尿。吞食水銀的人,大多數並無症狀,水銀自糞便排出,少數人可有某些症狀,而極少數(敏感或其他未知原因)可引起立即死亡。
2.水銀為一種原生質毒,能和病原微生物呼吸酶中的硫氫基結合而抑制其生活力,最後使其窒息而致死。
3.汞劑排泄主要由腎,其次是大腸。
藥(毒)理學
汞劑對消化道有腐蝕作用,對腎臟,毛細血管均有損害作用。急性中毒多半由誤服升汞引起,有消化道腐蝕所致的症狀,吸收後產生腎臟損害而致尿閉和毛細血管損害而引起血漿損失,甚至發生休克。早期套用二巰基丙醇及其他對症措施,多數有效。慢性中毒一般見於工業中毒,發生口腔炎和中毒性腦病,後者表現為憂鬱、畏縮等精神症狀和肌肉震顫。
常用選方
治疥癬瘡,經年不差:水銀一兩,白礬一兩,蛇床子一兩,雄黃一兩,閭茹末一兩。上藥,入煉了豬脂半斤,都研侯水銀星盡,便用敷之,日三兩上。(《聖惠方》水銀膏)
治燥癬:水銀、胡粉。研令調以塗之。(《肘後方》)
治熱瘡疥癬,癢痛不可忍者:水銀、蕪荑。酥和塗之。(《近效方》)
治楊梅毒瘡:水銀、黑鉛各一錢(結砂),黃丹一錢,乳香、沒藥各五分。為末,以紙卷作小拈,染油點燈,日照(熏)瘡三次。(《綱目》)
治痔,谷道中蟲癢不止:水銀、棗膏各二兩。同研相和,拈如棗形狀,薄綿片裹,納下部。若痛者,加粉三大分作丸。(《梅師集驗方》)
治白癜風:水銀拭之令熱即消,數拭之,差乃止。(《千金方》)
治腋下狐臭:水銀,胡粉。上二味,以面脂研和塗之。
1.治疥癬瘡,經年不差:水銀一兩,白礬一兩,蛇床子一兩,雄黃一兩,閭茹末一兩。上藥,入煉了豬脂半斤,都研侯水銀星盡,便用敷之,日三兩上。(《聖惠方》水銀膏)
2.治燥癬:水銀、胡粉。研令調以塗之。(《肘後方》)
3.治熱瘡疥癬,癢痛不可忍者:水銀、蕪荑。酥和塗之。(《近效方》)
4.治楊梅毒瘡:水銀、黑鉛各一錢(結砂),黃丹一錢,乳香、沒藥各五分。為末,以紙卷作小拈,染油點燈,日照(熏)瘡三次。(《綱目》)
5.治痔,谷道中蟲癢不止:水銀、棗膏各二兩。同研相和,拈如棗形狀,薄綿片裹,納下部。若痛者,加粉三大分作丸。(《梅師集驗方》)
6.治白癜風:水銀拭之令熱即消,數拭之,差乃止。(《千金方》)
7.治腋下狐臭:水銀,胡粉。上二味,以面脂研和塗之。
用藥禁忌
大毒之品,不宜內服,孕婦尤忌。
外用亦不可過量或久用,以免中毒。
《本草拾遺》:人患瘡疥,多以水銀塗之,性滑重,直入肉,宜慎之。
《本草經疏》:頭瘡切不可用,恐入筋絡,必緩筋骨,惟宜外敷,不宜內服。
1.大毒之品,不宜內服,孕婦尤忌。
2.外用亦不可過量或久用,以免中毒。
3.《本草拾遺》:人患瘡疥,多以水銀塗之,性滑重,直入肉,宜慎之。
4.《本草經疏》:頭瘡切不可用,恐入筋絡,必緩筋骨,惟宜外敷,不宜內服。
套用領域
汞最常用的套用是造工業用化學藥物以及在電子或電器產品中獲得套用。汞還用於溫度計,尤其是在測量高溫的溫度計。越來越多的氣態汞仍用於製造日光燈,而很多的其他套用都因影響健康和安全的問題而被逐漸淘汰,取而代之的是毒性弱但貴很多的Galinstan合金。除此之外汞之用途還有:
可將金從其礦物中分解出來,因此經常用於金礦。
氣壓計和擴散泵等儀器。
三相點是-38.8344 °C,它是一個溫度的標準點。
氣態汞用於汞蒸氣燈。
用於製造液體鏡面望遠鏡。利用鏇轉使液體形成拋物面形狀,以此作為主鏡進行天文觀測的望遠鏡,價格為普通望遠鏡的三分之一。
其他用途:水銀開關、殺蟲劑、生產氯和氫氧化鉀的過程中、防腐劑、在一些電解設備中充當電極、電池和催化劑。
牙醫學
汞齊牙齒填補物
汞和它的化合物一直被用於藥物,不過不如以前那么常見了,因為汞和它的化合物的毒性已經被更廣泛地知曉。汞是一種製成牙齒填補物的重要元素。硫柳汞是一種用於疫苗中的有機物防腐劑,儘管它的使用已被禁止。另一種汞化合物,汞溴紅,是一種局部外用的消毒劑,用於微小切口和表面創傷;在某些國家它仍被使用。
化妝品
硫柳汞(Thiomersal)廣泛用於製造染眉毛膏。在2008年,美國明尼蘇達州成為美國第一個禁止在化妝品中加入汞的州。
製備方法
在自然界中,汞多以化合物的性質存在,汞親銅和硫,故汞大部分以硫化汞(硃砂)的形式分布。在古代人們就已經掌握了硃砂提汞的方法,即在空氣中煅燒,收集蒸發的汞蒸氣並冷凝既得金屬汞。
在空氣流中加熱辰砂,所得蒸氣經冷凝可得汞。
將辰砂在空氣中焙燒或與生石灰共熱得到。
注意事項
檢測方法
總汞測定
原子螢光光譜分析法:
原理:試樣經酸加熱消解後,在酸性介質中,試樣中汞被硼氫化鉀(KBH)或硼氫化鈉(NaBH)還原成原子態汞,由載氣(氬氣)帶人原子化器中,在特製汞空心陰極燈照射下,基態汞原子被激發至高能態,在去活化回到基態時,發射出特徵波長的螢光,其螢光強度與汞含量成正比,與標準系列比較定量。
冷原子吸收光譜法:
原理:汞蒸氣對波長253.7nm的共振線具有強烈的吸收作用。試樣經過酸消解或催化酸消解使汞轉為離子狀態,在強酸性介質中以氯化亞錫還原成元素汞,以氮氣或乾燥空氣作為載體,將元素汞吹人汞測定儀,進行冷原子吸收測定,在一定濃度範圍其吸收值與汞含量成正比,與標準系列比較定量。
二硫腙比色法:
原理:試樣經消化後,汞離子在酸性溶液中可與二硫腙生成橙紅色絡合物,溶於三氯甲烷,與標準系列比較定量。
甲基汞測定
氣相色譜法:
原理:試樣中的甲基汞,用氯化鈉研磨後加入含有銅離子的鹽酸(1+11),完全萃取後,經離心或過濾,將上清液調試至一定的酸度,用巰基棉吸附,再用鹽酸(1+5)洗脫,最後以苯萃取甲基汞,用帶電子捕獲鑑定器的氣相色譜儀分析。
冷原子吸收法:
原理:同氣相色譜法。但在鹼性介質中用測汞儀測定,與標準系列比較定量。
泄露的處理
廣泛使用的體溫計血壓計等設備造成了汞易污染室內等環境問題,在室內打碎汞溫度計時,不要驚慌,可以立即把肉眼可見的碎汞珠用紙片(由於汞內聚力非常大,用棉簽不能沾起汞,這是極為不科學、不負責任的說法)托起來放進密封的水瓶裡面,如果有細小的汞珠可以用紙片推到一起,汞會自動聚成小球,再收集。為了安全,在有一些簡單化學品的情況下可以使用硝酸擦拭汞污染的地面來完全消除汞污染。而絕對不可以用硫粉覆蓋的方法,因為常溫下汞難和硫化合,不能除去汞污染。為了完全去除汞污染,可以用碘蒸氣熏蒸的方法熏蒸室內數次,直至碘化亞銅試紙不變色為止。 實驗證明,日常泄露的汞可以用家庭常用的透明膠帶粘起並收集,效果好於紙片,發生體溫計血壓計汞泄露可用此方法處理。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
![汞[化學元素] 汞[化學元素]](/img/d/fe3/nBnauM3X4MzM0QjMzUTM3IDN0UTMyITNykTO0EDMwAjMwUzL1EzLxUzLt92YucmbvRWdo5Cd0FmLyE2LvoDc0RHa.jpg)
