簡介
 硫單質
硫單質單質硫有幾種同素異形體:
主要是菱形硫(S8),密度2.07克/厘米3 ,熔點112.8℃,沸點444.674℃;單斜硫(S8),密度1.96克/厘米3,熔點119.0℃,沸點444.6℃;純粹的單質硫,密度1.96克/厘米3,熔點120.0℃,沸點444.6℃。導熱性和導電性都差。性鬆脆,不溶於水。
無定形硫主要有彈性硫,是由熔態硫迅速傾倒在冰水中所得。不穩定,可轉變為晶狀硫。晶狀硫能溶於有機溶劑如二硫化碳中,而彈性硫只能部分溶解。化合價為-2、+2、+4和+6。第一電離能10.360電子伏特。
發現歷史
硫在遠古時代就被人們所知曉。大約在4000年前,埃及人已經會用硫燃燒所形成的二氧化硫來漂白布匹,古希臘和古羅馬人也能熟練地使用二氧化硫來熏蒸消毒和漂白。公元前九世紀,古羅馬著名詩人荷馬在他的著作里講述了硫燃燒時有消毒和漂白的作用。硫在古代中國被列為重要的藥材,在中國古代第一部藥物學專著《神農本草經》中所記載的46種礦物藥品中,就有石硫黃(即硫磺)。在這部著作里還指出:“石硫黃能化金銀銅鐵,奇物”。這說明當時已經知曉硫能與銅、鐵等金屬直接作用而生成金屬硫化物。世界現存最古的煉丹著作——魏伯陽的《周易參同契》,也記述了硫能和易揮發的汞化合成不易揮發的硫化汞。在東晉煉丹家葛洪的《抱朴子內篇》中也有“丹砂燒之成水銀,積變又還成丹砂”的記載。中國對火藥的研究,大概始於公元七世紀。當時的火藥是黑火藥,它是由硝酸鉀、硫黃和木炭三者組成。火藥的製造促進了硫磺的提取和精製技術的發展,《太清石壁記》有用升華法精製硫磺的記載。明朝末年宋應星的《天工開物》一書中對從黃鐵礦石和含煤黃鐵礦石製取硫磺的操作方法作了詳細的敘述。
隨著1746年英國J.Roebuck發明了鉛室法製造硫酸和1777年硫被法國A.L.Lavoisier確認為一種元素後,硫便進入了近代化學的大門。在此之後的年代,硫就迅速成為與近代化學工業和現代化學工業密切相關的最重要的元素之一。
含量分布
硫在自然界中分布較廣,在地殼中含量為0.048%(按質量計)。在自然界中硫的存在形式有游離態和化合態。單質硫主要存在於火山周圍的地域中。以化合態存在的硫多為礦物,可分為硫化物礦和硫酸鹽礦。硫化物礦有黃鐵礦(FeS2)、黃銅礦(CuFeS2)、方鉛礦(PbS)、閃鋅礦(ZnS)等。硫酸鹽礦有石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)、重晶石(BaSO4)、天青石(SrSO4)、礬石[(AlO)2SO4·9H2O]、明礬石[K2SO4·Al2(SO4)3·24H2O]等。
理化性質
物理性質
 自然硫
自然硫硫化物沉澱時根據溫度的不同S-34的含量少許不同。假如在一個礦物中硫化物和碳酸鹽同時存在的話,那麼根據碳-13和硫-34的含量可以推算出礦物形成時礦水的pH值和氧的逸度。
在森林生態系統中,硫酸鹽主要來自空氣,少量來自礦物的風化。其中硫的同位素的不同含量可用來確定它們的來歷。
原子半徑:102pm;
離子半徑:184pm(S2-),29pm(S4+);
純的硫呈淺黃色,質地柔軟、輕,粉末有臭味。硫不溶於水但溶於二硫化碳。硫在所有的物態中(固態、液態和氣態),硫都有不同的同素異形體,這些同素異形體的相互關係還沒有被完全理解。晶體的硫可以組成一個由八個原子組成的環:S8。
導熱性和導電性都差。性鬆脆,不溶於水。無定形硫主要有彈性硫,是由熔態硫迅速傾倒在冰水中所得。不穩定,可轉變為晶狀硫。晶狀硫能溶於有機溶劑如二硫化碳(而彈性硫只能部分溶解)、四氯化碳和苯。化合價為-2.+2.+4和+6。第一電離能10.360電子伏特。結晶形硫不溶於水,稍溶於乙醇和乙醚,溶於二硫化碳、四氯化碳和苯。可轉變為晶狀硫(正交硫),正交硫是室溫下唯一穩定的硫的存在形式。原子半徑:88pm。
化學性質
化合價為-2、+2、+4和+6。第一電離能10.360電子伏特。化學性質比較活潑,能與氧、金屬、氫氣、鹵素(除碘外)及已知的大多數元素化合。還可以與強氧化性的酸、鹽、氧化物,濃的強鹼溶液反應。它存在正氧化態,也存在負氧化態,可形成離子化合物、共價化合成物和配位共價化合物。
1、氧化性
與金屬單質反應:銅→硫化亞銅;鐵→硫化亞鐵;鋁,鈉等金屬往往將其氧化為較底價態 特性:銀與硫摩擦生成硫化銀;汞與硫研磨生成硫化汞,實驗室水銀溫度計打破流出水銀時,撒上硫粉可防止汞蒸氣生成。
與非金屬反應:2S+C→CS2;S+H2→H2S
與其他的還原劑:S+Na2SO3加熱→Na2SO3S(Na2S2O3)
2、還原性: S+O2點燃→SO2
硫在氧氣里燃燒的現象:劇烈燃燒,發出熱量,發出明亮的藍紫色火焰,生成有刺激性氣味的氣體。硫與氧氣燃燒會生成二氧化硫。
3、既氧化又還原:
3S+6KOH加熱→2K2S+K2SO3+2H2O (歧化反應)
4、常見化學方程式
(x+3)S+6OH-=加熱=2S(x/2+1)2- +SO32- +3H2O
3S2- +2Al3+ +6H2O====2Al(OH)3↓+3H2S↑
S2- +2Fe3+ ====2Fe2+ +S↓
S2O32- +2H+ ====S↓+SO2↑+H2O
2H2S+SO2=(點燃)===3S↓+2H2O
2H2S+O2====2S↓+2H2O(點燃,氧氣不足)
製取方法
1.往二氧化硫中通入氫硫酸,可以製取硫。化學方程式:SO2+2H2S=3S↓+2H2O(氧化還原反應)
2.往酸性高錳酸鉀中通入氫硫酸。化學方程式:2KMnO4+5H2S+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O
3.往亞硫酸中通入硫化氫。化學方程式:11.2H2S+H2SO3=3S↓+3H2O
化合物
許多有機物難聞的味道來自於它們所含有硫化氫之類的化合物。這些化合物有一股特別的臭雞蛋味道。
硫化氫的溶液是酸性的,與金屬反應形成金屬的硫化物。鐵的硫化物在大自然中很常見,被稱為黃鐵礦。方鉛礦是硫化鉛,也是第一種被發現的半導體。
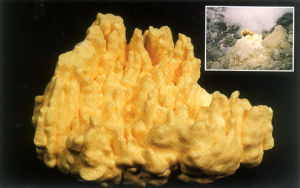 硫
硫其它重要的硫的化合物
連二亞硫酸鈉:Na2S2O4,是一種強有力的還原劑
亞硫酸:H2SO3,是二氧化硫在水中的溶液。亞硫酸和亞硫酸鹽是有力的還原劑。二氧化硫的其它產物包括焦亞硫酸離子(S2O5 2- )
硫代硫酸物:S2O32- ,是氧化物。硫代硫酸氨有可能可以代替氰化物來洗金
連二硫酸:H2S2O6,及其鹽
連多硫酸:H2SnO6,n可以從3一直到80
硫酸鹽:是硫酸的鹽
硫化物:是硫與其它元素的化合物
過一硫酸是三氧化硫與濃的過氧化氫的反應物
硫氰酸鹽是硫氰離子(SCN- )的化合物
硫氰:(SCN)2
二硫化碳
同位素
硫有18種同位素,其中四種是穩定的:S-32(95.02%)、S-33(0.75%)、S-34(4.21%)和S-36(0.02%),除35 S外,其它放射性同位素的半衰期都很短。硫-35由宇宙射線射擊空氣中的氬-40而導致,其半衰期為87天。
硫化物沉澱時根據溫度的不同S-34的含量少許不同。假如在一個礦物中硫化物和碳酸鹽同時存在的話,那么根據碳-13和硫-34的含量可以推算出礦物形成時礦水的pH值和氧的逸度。
在森林生態系統中,硫酸鹽主要來自空氣,少量來自礦物的風化。其中硫的同位素的不同含量可用來確定它們的來歷。
硫單質及其化合物
(一)硫單質的反應(非金屬性弱於鹵素、氧和氮)
1.硫與氧氣反應(只生成二氧化硫,不生成三氧化硫)
2.硫與氫氣加熱反應
3.硫與銅反應(生成+1價銅化合物,即硫化亞銅)
4.硫與鐵反應,(生成+2價鐵化合物,即硫化亞鐵)
 硫
硫6.硫與強鹼溶液反應生成硫化物和亞硫酸鹽(試管上粘附的硫除了可用CS2洗滌以外,還可以
用NaOH溶液來洗)3S+6NaOH=2Na2S+Na2SO3+3H2O
(二)二氧化硫或亞硫酸的反應(弱氧化性,強還原性,酸性氧化物)
1.氧化硫化氫
2.被氧氣氧化(工業制硫酸時用催化劑;空氣中的二氧化硫在某些懸浮塵埃和陽光作用下被氧氣
氧化成三氧化硫,並溶解於雨雪中成為酸性降水。)
3.被鹵素氧化SO2+Cl2+2H2O==H2SO4+2HCl
4.與水反應
5.與鹼性氧化物反應
6.與鹼反應
7.有漂白性(與有機色質化合成無色物質,生成的無色物質不太穩定,受熱或時日一久便返色)
(三)硫酸性質用途小結
1.強酸性
(1)、與鹼反應
(2)、與鹼性氧化物反應(除銹;制硫酸銅等鹽)
(3)、與弱酸鹽反應(制某些弱酸或酸式鹽)
(4)、與活潑金屬反應(制氫氣)
2.濃硫酸的吸水性(作氣體乾燥劑;)
3.濃硫酸的脫水性(使木條、紙片、蔗糖等炭化;乙醇脫水制乙烯)
4.濃硫酸的強氧化性
(1)、使鐵、鋁等金屬鈍化;
(2)、與不活潑金屬銅反應(加熱)
(3)、與木炭反應(加熱)
(4)、制乙烯時使反應混合液變黑
5.高沸點(不揮發性)(制揮發性酸)
(1)、制氯化氫氣體
(2)、制硝酸(HNO3易溶,用濃硫酸)
實驗室制二氧化碳一般不用硫酸,因另一反應物通常用塊狀石灰石,反應生成的硫酸鈣溶解度
小易裹在表面阻礙反應的進一步進行。
6.有機反應中常用作催化劑
(1)、乙醇脫水制乙烯(作催化劑兼作脫水劑,用多量濃硫酸,乙醇濃硫酸體積比1∶3)
(2)、苯的硝化反應(硫酸作催化劑也起吸水作用,用濃硫酸)
(3)、酯化反應(硫酸作催化劑和吸水劑,用濃硫酸)
(4)、酯水解(硫酸作催化劑,用稀硫酸)
(5)、糖水解(注意:檢驗水解產物時,要先加鹼中和硫酸)
主要用途
工業需求
硫在工業中很重要,比如作為電池中或溶液中的硫酸。硫被用來製造火藥。 在橡膠工業中做硫化劑。硫還被用來殺真菌,用做化肥。硫化物在造紙業中用來漂白。硫酸鹽在煙火中也有用途。硫代硫酸鈉和硫代硫酸氨在照相中做定影劑。肥料。製造硫酸、亞硫酸鹽、殺蟲劑、塑膠、搪瓷、合成染料。橡膠硫化。漂白。藥物。油漆。
硫礦物最主要的用途是生產硫酸和硫磺。硫酸是耗硫大戶,中國約有70%以上的硫用於硫酸生產。化肥是消費硫酸的最大戶,消費量占硫酸總量的70%以上,尤其是磷肥耗硫酸最多,增幅也最大。硫酸除用於化學肥料外,還用於製作苯酚、硫酸鉀等90多種化工產品;輕工系統的腳踏車、皮革行業;紡織系統的粘膠、纖維、維尼綸等產品;冶金系統的鋼材酸洗、氟鹽生產部門;石油系統的原油加工、石油催化劑、添加劑以及醫藥工業等都離不開硫酸。隨著中國經濟的發展,各行業對硫酸的需求量均呈緩慢上升趨勢,化肥用項是明顯的增長點。
 硫
硫高品位硫鐵礦燒渣可以回收鐵等;低品位的燒渣可作水泥配料。燒渣還可以回收少量的銀、金、銅、鋁、鋅和鈷等。硫磺除為生產硫酸的原料之外,還廣泛用來生產化工產品,如硫化銅、焦亞硫酸鈉等。另外,在食糖生產中,要把硫磺氧化為二氧化硫氣體用於漂白脫色。在農藥生產中也直接或間接使用硫磺;粘膠纖維生產中需用二硫化碳作溶劑;硫化金屬礦浮選用的藥劑要以二硫化碳為原料;除以上套用外,消費硫磺的行業還有火柴製造、水泥枕軌處理、醫藥、火藥等。
比如作為電池中或溶液中的硫酸。硫被用來製造火藥。硫也是生產橡膠製品的重要原料。硫還被用來殺真菌,用做化肥。硫化物在造紙業中用來漂白。硫還可用於製造黑色火藥、焰火、火柴等。硫代硫酸鈉和硫代硫酸氨在照相中做定影劑。硫又是製造某些農藥(如石灰硫黃合劑)的原料。
生理作用
半胱氨酸、蛋氨酸、同型半胱氨酸和牛磺酸等胺基酸和一些常見的酶含硫,因此硫是所有細胞中必不可少的一種元素。在蛋白質中,多肽之間的二硫鍵是蛋白質構造中的重要組成部分。有些細菌在一些類似光合作用的過程中使用硫化氫作為電子提供物(一般植物使用水來做這個作用)。植物以硫酸鹽的形式吸收硫。無機的硫是鐵硫蛋白的一個組成部分。在細胞色素氧化酶中,硫是一個關鍵的組成部分。醫療上,硫還可用來制硫黃軟膏醫治某些皮膚病,但硫對身體危害較大長期在高含硫的工況下工工作對身體有極大損害。
危險性
工業硫磺為易燃固體。此外,空氣中含有一定濃度硫磺粉塵時不僅遇火會發生爆炸,而且硫磺粉塵也很易帶靜電產生火花導致爆炸(硫磺粉塵爆炸下限為2.39/m),繼而燃燒引發火災。按固體火災危險性分類硫磺屬於乙類,硫磺回收和成型裝置屬於火災危險性乙類裝置。人體吸入硫磺粉塵後還會引起咳嗽、喉痛等。
燃燒爆炸危險性
①正常情況下燃燒緩慢,與氧化劑混合時燃燒速度劇增;
②與氧化劑混合可形成爆炸性混合物;
③遇明火、高溫易發生火災;
④粉塵易帶高達數千伏乃至上萬伏靜電;
⑤摩擦產生的高溫和明火等均可導致硫磺粉塵爆炸和火災;
⑥一般情況下硫磺粉塵比易燃氣體更易發生爆炸,但燃燒速度和爆炸壓力比易燃氣體小。
毒性
接觸限值:中國MAC、美國TWA和STEL均未制定標準毒理資料:低毒性。
對人體危害
①因其可在腸內部分轉化為硫化氡而被人體吸收,故大量吞入(10~209)可導致硫化氫中毒;
②可引起眼結膜炎、皮膚濕疹,對皮膚有弱刺激性;
③長期吸入硫磺粉塵一般無明顯毒性。
防禦措施
根據國家標準《工業硫磺》(GB2449—2006)規定,有關工業硫磺安全等防護事項如下。
(1)安全
從事工業硫磺生產、運輸、儲存及加工的工作人員,操作時應使用必要的防護用品。
嚴格遵守國家有關消防、危險品的安全條例。工業硫磺堆放場所和倉庫應設定專門滅火器材,嚴禁明火。允許以噴水等方法熄滅燒著的硫磺。
由於硫磺粉塵易爆,使用和運輸工業硫磺時應防止生成或泄出硫磺粉塵。液體硫磺的生產、儲運以及使用遵照相關安全規定執行。
(2)標誌、包裝、運輸和儲存
工業硫磺的包裝容器上應有明顯、牢固的標誌,內容包括生產廠名、廠址、產品名稱、商標、等級、淨質量、批號、生產日期、《工業硫磺》標準編號和符合GB190規定的“易燃固體”標誌。
固體產品可用塑膠編織袋或內襯塑膠薄膜袋包裝,也可散裝。其中,包裝塊狀硫磺可不用內襯塑膠薄膜袋,散裝產品應遮蓋,但粉狀硫磺不可散裝。液體硫磺應使用專門容器儲裝。
(3)產品的運輸按國家有關規定行
塊狀、粒狀硫磺可儲存於露天或倉庫內。粉狀、片狀硫磺儲存於有頂蓋的場所或倉庫內。
袋裝產品成垛堆放,堆垛間應留有不少於0.75m寬的通道。不許放置在上下水管道和取暖設備的近旁。
代表案例
(1)硫磺倉庫爆炸事故
2008年1月13日,國內某公司的一個分公司硫磺倉庫發生爆炸,造成7人死亡、32人受傷。
①事故經過2008年1月13日2時45分,鐵路運輸裝卸承包單位的53名工人在該公司硫磺倉庫內開始從事火車硫磺卸車作業,即從火車卸下並拆開硫磺包裝袋,將硫磺分別倒入平行於鐵路、與地面平齊的34個料斗中,硫磺通過料斗落在地坑中輸送機皮帶上,用輸送機傳送皮帶將硫磺送入硫磺庫內作為該公司生產硫酸的原料。3時40分時地坑硫磺粉塵突然發生爆炸,爆炸衝擊波將料斗、硫磺庫的輕型屋頂、皮帶輸送機、斗式提升機等設備、設施毀壞,造成7人死亡、7人重傷、25人輕傷。
②事故原因事故發生的主要原因,一是天氣乾燥,空氣濕度低,硫磺粉塵容易爆炸;二是作業時正值深夜,風速低,空氣流動性差,造成局部空間內(皮帶運輸機地坑)硫磺粉塵濃度增大,達到爆炸極限,由現場產生的點火能量引發爆炸。
(2)硫磺成型系統爆炸事故
國內某廠有兩套硫磺回收裝置,共用一台成型結片機,生產能力7500t/a。成型系統包括成型結片機(二樓)、包裝間和成品庫(一樓),包裝間和成品庫混用。
2001年6月23日14時10分,一搬運工將無防火帽的外運貨車開進硫磺成品庫,引起成品庫內小範圍閃爆,幸無人員傷亡。
2003年1月19日10時30分,一電工在拆修成型結片機頂部引風線上的軸流風機時,產生的電火花造成引風線內硫磺粉塵爆炸,爆炸產生的衝擊波將現場一名作業人員推出1.5m遠,所幸有護欄保護,未造成傷亡。
生命元素
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
化學元素(一)
元素性質
| 為了方便閱讀者查閱元素周期表中各元素符號的性質及特點,比較系統的歸納和總結各元素的套用價值及注意事項,從而為需要相關知識的人們形成知識的鏈條,本次主要是對有些元素的內容進行補充及完善。 |

