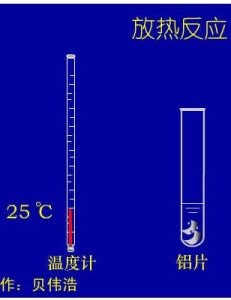
簡介
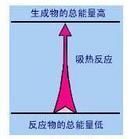 吸熱反應
吸熱反應化學上把吸收熱量的化學反應叫做吸熱反應.吸熱反應中反應物的總能量低於生成物的總能量。
生成物中的化學鍵的能量越強,穩定性越差,能量越弱,穩定性越好。
例如:C+H2O=CO+H2
分解反應一般為吸熱反應,如2NaHCO3=(加熱)Na2CO3+H2O+CO2。
注意:不是需要加熱的反應都是吸熱反應,燃燒大多數要"點燃",都是放熱反應
常見的放熱反應:
1.一切燃燒,以及部分氧化(如氨氣氧化)
2.中和、沉澱(不全是)
3.多數化和,如SO3+H2O,NH3+HCl(但H2+I2,合成NH3吸熱)
4.特別劇烈的反應,如電石和水
定義
常見吸熱反應類型
(1)①幾個常見的反應,如:2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
C+H2O(g)=(高溫)CO+H2
C(s)+CO2(g)=(高溫)2CO
I2+H2=2HI(此反應為可逆反應,因為生成的碘化氫不穩定)
②多數的分解反應,如:
CaCO3=(高溫)CaO+CO2↑
CuSO4·5H2O=CuSO4+5H2O
(2)電離。
(3)鹽類水解。此時必為吸熱反應。如:銨根水解即為吸熱
常見網路謠言
C,H2,CO做還原劑的反應都吸熱闢謠:判斷反應熱效應的兩個標準是實驗實測以及通過熱力學進行計算,而C、H2、CO還原很多情況都是放熱反應,如以下實例
反應1:CuO(s)+H2(g)=Cu(s)+H2O(g)
反應2:CuO(s)+CO(g)=Cu(s)+CO2(g)
反應3:CuO(s)+1/2C(石墨)=Cu(s)+1/2CO2(g)
計算化學反應熱效應可以直接使用ΔH
相應物質標準生成焓:單位:kJ/mol
分子式 標準生成焓
H2O(g) -241.82
C(石墨) 0.00
H2(g) 0.00
CO(g) -110.53
CO2(g) -393.51
Cu(s) 0.00
CuO(cr) -157.30
數據代入計算可知:
ΔH1=0+(-241.818)-(-157.3)-(0)=-84.518<0,即反應放熱
ΔH2=0+(-393.509)-(-110.525)-(-157.3)=-125.684<0,即反應放熱
ΔH3=0.5×(-393.509)+0-(-157.3)-0=-236.209<0,即反應放熱
綜上可證這三個反應都是放熱反應,即本詞條原有的,網路上流傳的所謂“C,H2,CO做還原劑的反應(吸熱)”實質系謠言