概述
 鉺
鉺鉺為銀灰色金屬,熔點1529°C,沸點2863°C,密度9.006克/厘米³;第一電離能6.10電子伏特。質軟,不溶於水,溶於酸。與鈥、鏑的化學性質和物理性質幾乎完全相同。鉺在低溫下是反鐵磁性的,在接近絕對零度時為強鐵磁性,並為超導體。鉺在室溫下緩慢被空氣和水氧化,氧化鉺為玫瑰紅色。鹽類和氧化物呈粉紅至紅色。鉺的同位素有:162Er、164Er、166Er、167Er、168Er、170Er。鉺可用作反應堆控制材料;鉺也可作某些螢光材料的激活劑。
元素來源:存在於火成岩中,可由電解熔融氯化鉺ErCl3而製得,與其他密度較大的稀土元素共存於磷釔礦和黑稀金礦中。綜合性質
 鉺
鉺元素符號:Er
英文名:Erbium
元素原子量:167.3
體積彈性模量:Gpa:44.4
原子化焓:kJ/mol@25℃:314
熱容:J/(mol•K):28.12
導電性:10^6/(cm•Ω):0.0117
導熱係數:W/(m•K):14.5
熔化熱:(千焦/摩爾):19.90
汽化熱:(千焦/摩爾):261.0
原子體積:(立方厘米/摩爾):18.4
氧化態:MainEr+3
元素在宇宙中的含量:(ppm):0.002
元素在太陽中的含量:(ppm):0.001
元素在海水中的含量:(ppm):大西洋表面0.00000059
地殼中含量:(ppm):3.8
晶體結構:晶胞為六方晶胞。
晶胞參數:
a=355.88pm
b=355.88pm
c=558.74pm
α=90°
β=90°
γ=120°
維氏硬度:589MPa
 鉺
鉺常見化合價:+3
電負性:1.24
外圍電子排布:4f126s2
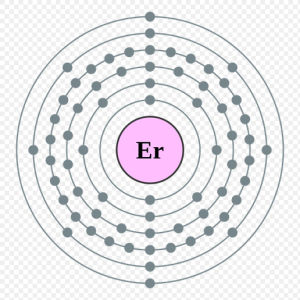
核外電子排布:2,8,18,30,8,2
同位素及放射線:Er-162Er-164*Er-166Er-167Er-168Er-169[9.4d]Er-170Er-171[7.5h]Er-172[2.1d]
電子親合和能:0KJ•mol-1
第一電離能:589KJ•mol-1
第二電離能:1151KJ•mol-1
第三電離能:0KJ•mol-1
單質密度:8.795g/cm3
單質熔點:1522.0℃
單質沸點:2510.0℃
原子半徑:2.45埃
離子半徑:1.00(+3)埃
共價半徑:1.57埃
發現
 莫桑德爾
莫桑德爾發現年代:1843年
發現過程:1843年,由莫桑德爾(C.G.Mosander)發現。他原來將鉺德氧化物命名為氧化鋱,因此,早期德文獻中,氧化鋱和氧化鉺是混同的。直到1860年以後,才得糾正。
在發現鑭的同一時期里,莫桑德爾對最初發現的釔進行了分析研究,並於1842年發表報告,明確最初發現的釔土不是單一的元素氧化物,而是三種元素的氧化物。他把其中的一種仍稱為釔土,其中一種命名為erbia(鉺土)。元素符號定為Er。它的命名來源和釔一樣,出自最初發現釔礦石的產地,瑞典斯德哥爾摩附近的小鎮乙特比(Ytterby)。鉺和另兩個元素鑭、鋱的發現打開了發現稀土元素的第二道大門,是發現稀土元素的第二階段。他們的發現是繼鈰和釔兩個元素後又找到稀土元素中的三個。
用途
 摻鉺光纖放大器
摻鉺光纖放大器2、另外摻鉺的雷射晶體及其輸出的1730nm雷射和1550nm雷射對人的眼睛安全,大氣傳輸性能較好,對戰場的硝煙穿透能力較強,保密性好,不易被敵人探測,照射軍事目標的對比度較大,已製成軍事上用的對人眼安全的攜帶型雷射測距儀。
3、Er3+加入到玻璃中可製成稀土玻璃雷射材料,是目前輸出脈衝能量最大,輸出功率最高的固體雷射材料。
4、Er3+還可做稀土上轉換雷射材料的激活離子。
5、它的氧化物Er2O3為玫瑰紅色,用來製造陶器得釉彩。陶瓷業中使用氧化鉺產生一種粉紅色的釉質。另外鉺也可套用於眼鏡片玻璃、結晶玻璃的脫色和著色等。
6、鉺在核工業中也有一些套用,還能作為其他金屬的合金成分。例如釩中摻入鉺能夠增強其延展性。
類別
氧化鉺
 氧化鉺
氧化鉺分子式:Er2O3
性質:Er2O3是體心立方和單斜兩種結構的粉狀物,粉紅色粉末,密度8.64,熔點2378℃,沸點3000℃。Er2O3磁矩也較大,為9.5M.B.。不溶於水,溶於酸,是一種穩定的化合物。其他性質及製備方法同於鑭系元素。由硝酸鉺或硫酸鉺溶液與鹼反應後,經分離、灼燒而得。
用途:主要用作釔鐵柘榴石添加劑和核反應堆控制材料,也用於製造特種發光玻璃和吸收紅外線的玻璃,還用作玻璃著色劑,製做粉紅色玻璃。
毒鉺
 毒鉺
毒鉺滅鼠藥的誘餌可選擇小麥、稻穀、碎玉米等原糧,不宜用熟食,更不能用餅乾、速食麵等,以免被人誤食。毒餌必須選用一般食品不用的深藍或黑色作為警告色。鼠藥濃度是:殺鼠醚0.0375%,敵鼠鈉鹽0.025%,溴敵隆0.005%。黏著劑用量是3%至4%。為提高毒餌對老鼠的吸引力,可在其中加入5%左右的糖或0.5%的食鹽,亦可加0.1%的味素或2%的白酒。
毒餌應投放在老鼠經常出沒的地方(俗稱“鼠道”),一般可投放在距離牆根10厘米至15厘米處,每堆二三十克,次日檢查,吃多少補多少,吃光加倍,連續檢查,投放期至少應在2周以上。鼠患較嚴重的單位可以利用空心磚、專用毒餌箱在牆根邊長期投放一些毒鼠餌,做到長年滅鼠。在大範圍滅鼠活動中,如預先斷絕鼠糧然後用同一藥物同一時間投放毒餌,滅鼠效果會更好。
急性滅鼠藥,如“三步倒”、“毒鼠強”、“鼠立死”等屬國家禁用的劇毒藥,有的市民為圖方便,向街頭巷尾的無證小販購買此類殺鼠藥來使用,是錯誤和危險的。這類藥含有國家明令禁止的氟乙醯胺等成分,人畜誤服後可迅速中毒致死,而且易造成二次中毒甚至三次中毒,又沒有特效解毒劑,危害極大。另外,根據鼠類的生活習性,急性滅鼠藥的長期滅鼠效果遠不如慢性滅鼠藥,對滅鼠是不利的。
硝酸鉺
 硝酸鉺
硝酸鉺化學式:Er(NO3)3•6H2O
相對分子質量: 443.30
熔點: 130℃(失去4個分子結晶水)
形 狀:粉紅色粒狀結晶,溶於水和醇,遇熱脫水,在潮濕空氣中易潮解。
用 途:用於是間化合物、玻璃、化學試劑等行業。
包 裝:採用雙層複合塑膠袋真空包裝,每袋淨重為1、2、5kg,置於紙桶(鐵桶、 塑膠桶)中,每桶淨重40kg 或50kg。
【火災危險】:與有機物, 還原劑及易燃物硫、磷等混和後, 摩擦、撞擊, 有引起燃燒爆炸的危險。
【處置方法】:霧狀水、砂土。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||

