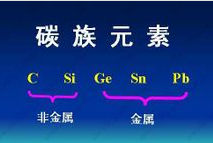
關係性質
最外層電子數大於等於4,所以其原子容易得到電子,常以陰離子形態存在於離子化合物中,或形成分子晶體、原子晶體。它們的氧化物和氫氧化物一般呈酸性。
 非金屬元素
非金屬元素元素的金屬性是指元素的原子失電子的能力;元素的非金屬性是指元素的原子得電子的能力。周期表中的位置關係
對於主族元素來說,同周期元素隨著原子序數的遞增,原子核電荷數逐漸增大,而電子層數卻沒有變化,因此原子核對核外電子的引力逐漸增強,隨原子半徑逐漸減小,原子失電子能力逐漸降低,元素金屬性逐漸減弱;而原子得電子能力逐漸增強,元素非金屬性逐漸增強。例如:對於第三周期元素的金屬性Na>Mg>Al,非金屬性Cl>S>P>Si。
同主族元素,隨著原子序數的遞增,電子層逐漸增大,原子半徑明顯增大,原子核對最外層電子的引力逐漸減小,元素的原子失電子逐漸增強,得電子能力逐漸減弱,所以元素的金屬性逐漸增強,非金屬性減弱。例如:第一主族元素的金屬性H<Li<Na<K<Rb<Cs,鹵族元素的非金屬性F>Cl>Br>I。
綜合以上兩種情況,可以作出簡明的結論:在元素周期表中,越向左、下方,元素金屬性越強,金屬性最強的金屬是Cs;越向右、上方,元素的非金屬越強,非金屬性最強的元素是F。例如:金屬性K>Na>Mg,非金屬性O>S>P。
化學反應中表現關係
一般說來,元素的金屬性越強,它的單質與水或酸反應越劇烈,對於的鹼的鹼性也越強。例如:金屬性Na>Mg>Al,常溫時單質Na與水能劇烈反應,單質Mg與水能緩慢地進行反應,而單質Al與水在常溫時很難進行反應,它們對應的氧化物的水化物的鹼性NaOH>Mg(OH)2>Al(OH)3。元素的非金屬性越強,它的單質與H₂反應越劇烈,得到的氣態氫化物的穩定性越強,元素的最高價氧化物所對應的水化物的酸也越強。例如:非金屬Cl>S>P>Si,Cl₂與H₂在光照或點燃時就可能發生爆炸而化合,S與H₂須加熱才能化合,而Si與H₂須在高溫下才能化合併且SiH4極不穩定;氫化物的穩定HCl>H2S>PH3>SiH4;這些元素的最高價氧化物的水化物的酸性HClO4>H2SO4>H3PO4>H4SiO4。
因此,在化學反應中的表現可以作為判斷元素的金屬性或非金屬強弱的依據。另外,還可以根據金屬或非金屬單質之間的相互置換反應,進行金屬性和非金屬性強弱的判斷。一種金屬把另一金屬元素從它的鹽溶液里置換出來,表明前一種元素金屬性較強;一種非金屬單質能把另一種非金屬單質從它的鹽溶液或酸溶液中置換出來,表明前一種元素的非金屬性較強。
性質關係對比
元素的性質與物質的化學性質的關係
元素的金屬性越強,它的單質還原性越強,而它陽離子的氧化性越弱。例如:金屬性Na>Mg>Al,單質的還原性Na>Mg>Al,陽離子的氧化性Na+<Mg2+<Al3+。中學化學教材中金屬活動順序表為K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>H>Cu>Hg>Ag>Pt>Au,而陽離子的氧化性為K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe2+<Sn2+Br>I>S,它們的單質的氧化性Cl2>Br2>I2>S,還原性Cl2
理化性質
物理性質
非金屬單質大多是分子晶體,少部分為原子晶體和過渡型的層狀晶體。
單質共價鍵數大部分符合8-N規則
稀有氣體:8-8=0(2-2=0),為單原子分子鹵素,氫:8-7=1(2-1=1),為雙原子分子VIA族的硫、硒、碲:8-6=2,為二配位的鏈形與環形分子VA族的磷、砷:8-5=3,為三配位的有限分子P4,As4,灰砷和黑磷為層狀分子IVA族的碳、矽:8-4=4,為四配位的金剛石型結構。少數分子由於形成π鍵、大Π鍵或d軌道參與成鍵,鍵型發生變化,於是不遵守8-N規則。如N2、O2分子中的原子間的鍵不是單鍵;硼單質和石墨結構中,鍵的個數也不等於8-N個。
物理性質可分為三類
 非金屬元素
非金屬元素稀有氣體及O2、N2、H2等:一般狀態下為氣體,固體為分子晶體,熔沸點很低多原子分子,S8、P4等:一般狀態下為固體,分子晶體,熔沸點低,但比第一類高大分子單質,金剛石、晶態矽等:原子晶體,熔沸點高
化學性質
活潑非金屬元素,如F2,Cl2,Br2,O2,PS等,能與金屬形成鹵化物、氧化物、硫化物,氫化物或含氧酸鹽等。非金屬元素之間也能形成鹵化物、氧化物、無氧酸、含氧酸等。
大部分單質不與水反應,僅鹵素與高溫下的碳能與水發生反應。
非金屬一般不與非氧化性稀酸發生反應,硼、碳、磷、硫、碘、砷等才能被濃HNO3、濃H2SO4及王水氧化。
除碳、氮、氧外,一般可以和鹼溶液發生反應,對於有變價的主要發生歧化反應;Si、B則是從鹼溶液中置換出氫氣;濃鹼時,F2能氧化出O2
成鍵方式
非金屬原子之間主要成共價鍵,而非金屬元素與金屬元素之間主要成離子鍵。
非金屬原子之間成共價鍵的原因是,兩種原子均有獲得電子的能力,都傾向於獲得對方的電子使自己達到穩定的構型,於是兩者就共用電子對以達此目的。
而金屬原子失去電子的能力較強,與非金屬相遇時就一者失電子、一者得電子,雙方均達到穩定結構。
多原子的共價分子常常出現的一種現象是軌道雜化,這使得中心原子更易和多個原子成鍵。
非金屬原子之間形成的共價鍵中,除了一般的σ鍵和π鍵,還有一種大Π鍵。大Π鍵是離域的,可以增加共價分子或離子的穩定性。
氫元素
氫:符號:H,原
子序數:1,原子量:1.00794amu,熔點:-259.14°C(14.009985°K,-434.45203°F),沸點:-252.87°C(20.280005°K,-423.166°F)質子數/電子數:1,中子數:0,類別:非金屬,晶體結構:六邊形結構,密度@293K:0.08988g/cm3,顏色:無色,HYDROGEN,源自htdor和gen,意為"水的形成",1766年發現。是宇宙間最豐富的元素。氫可說完全不是以單質形態存在於地球上,可是太陽和其他一些星球則全部是由純氫所構成。這種星球上發生的氫熱核反應的熱光普照四方,溫暖了整個宇宙。
氫發展歷史
 非金屬元素
非金屬元素氫的存在,早在16世紀就有人注意到了。曾經接觸過氫氣的也不只一人,但因當時人們把接觸到的各種氣體都籠統地稱作“空氣”,因此,氫氣並沒有引起人們的注意。直到1766年,英國的物理學家和化學家卡文迪什(CavendishH,1731─1810)用六種相似的反應制出了氫氣。這些反應包括鋅、鐵、錫分別與鹽酸或稀硫酸反應。同年,他在一篇名為“人造空氣的實驗”的研究報告中談到此種氣體與其它氣體性質不同,但由於他是燃素學說的虔誠信徒,他不認為這是一種新的氣體,他認為這是金屬中含有的燃素在金屬溶於酸後放出,形成了這種“可燃空氣”。事實上是傑出的化學家拉瓦錫(LavoisierAL,1743─1794)1785年首次明確地指出:水是氫和氧的化合物,氫是一種元素。並將“可燃空氣”命名為“Hydrogen”。這裡的“Hydro”是希臘文中的“水”,“gene”是“源”,“Hydrogen”就是“水之源”的意思。它的化學符號為H。我們的“氫”字是採用“輕”的偏旁,把它放進“氣”裡面,表示“輕氣”。
氫在周期表中的位置
化學元素周期系1.0表中的第一個元素,它在所有元素中具有最簡單的原子結構。它由一個帶+1電荷的核和一個軌道電子組成。鹼金屬也都具有一個外層軌道電子,但它們在反應中很容易失去這個電子而生成正離子;與此相反,氫不容易失去這個電子,而是使這個電子配對生成一個共價鍵。鹵素像氫一樣,比稀有氣體結構缺少一個電子。在許多反應中,鹵素容易獲得一個電子而生成負離子;但氫只有在與失電子能力強的金屬反應時才會獲得電子而生成負離子。氫的這些獨特性質是由氫的獨特的原子結構、氫原子特別小的半徑和低的電負性決定的。因為它的性質與鹼金屬和鹵素的性質都不相同,使得很難把它放在周期表中的一個合適位置上。在本課件中,按原子序數把氫放在第IA族元素的位置上。
氫的同位素
同一種元素的原子具有不同的質量數,這些原子就叫同位素。質量數產生差異的原因是原子核中含有不同的中子。氫有三種同位素:(氕,符號H),(氘,符號D)和(氚,符號T)。在它們的核中分別含有0、1和2箇中子,它們的質量數分別為1,2,3。自然界中普通氫內H同位素的豐度最大,原子百分比占99.98%,D占0.016%,T的存在量僅為H的10-17。
氫的成鍵特徵
氫原子的價電子層結構為,電負性為2.2,當氫原子同其它元素的原子化合時,可以形成:離子鍵,共價鍵,特殊的鍵型。離子鍵:當H與電負性很小的活潑金屬,如Na,K,Ca等形成氫化物時,H獲得1個電子形成氫負離子。這個離子因具有較大的半徑208pm,僅存在於離子型氫化物的晶體中。
共價鍵:①、兩個H原子能形成一個非極性的共價單鍵,如H2分子。②、H原子與非金屬元素的原子化合時,形成極性共價鍵,例如HCl分子。鍵的極性隨非金屬元素原子的電負性增大而增強。
特殊的鍵型
①、H原子可以填充到許多過渡金屬晶格的空隙中,形成一類非整比化合物,一般稱之為金屬型氫化物,例如:ZrH1.30和LaH2.87等。
②、在硼氫化合物(例如乙硼烷B2H6)和某些過渡金屬配合物中均存在著氫橋鍵。
③、能形成氫鍵。在含有強極性鍵的共價氫化物中,近乎裸露的H原子核可以定向吸收鄰近電負性高的原子(如F、O、N等)上的孤電子對而形成分子間或分子內氫鍵。例如在HF分子間存在著很強的氫鍵。
物理性質
單質氫是由兩個H原子以共價單鍵的形式結合而成的雙原子分子,其鍵長為74pm。氫是已知的最輕的氣體,無色無臭,幾乎不溶於水(273K時1的水僅能溶解0.02的氫),氫比空氣輕14.38倍,具有很大的擴散速度和很高的導熱性。將氫冷卻到20K時,氣態氫可被液化。液態氫可以把除氦以外的其它氣體冷卻都轉變為固體。同溫同壓下,氫氣的密度最小,常用來填充氣球。
分子氫在地球上的豐度很小,但化合態氫的豐度卻很大,例如氫存在於水、碳水化合物和有機化合物以及氨和酸中。含有氫的化合物比其它任何元素的化合物都多。氫在地殼外層的三界(大氣、水和岩石)里以原子百分比計占17%,僅次於氧而居第二位。
 非金屬元素
非金屬元素化學性質
(1)、分子氫中H—H鍵的離解能,比一般的單鍵高很多,相當於一般雙鍵的離解能。因此常溫下分子氫不活潑。但氫在常溫下能與單質氟在暗處迅速反應生成HF,而與其它鹵素或氧不發生反應。
(2)、高溫下,氫氣是一個非常好的還原劑。例如:
①、氫氣能在空氣中燃燒生成水,氫氣燃燒時火焰可以達到3273K左右,工業上常利用此反應切割和焊接金屬。
②、高溫下,氫氣還能同鹵素、N2等非金屬反應,生成共價型氫化物。
③、高溫下氫氣與活潑金屬反應,生成金屬氫化物。
④、高溫下,氫氣還能還原許多金屬氧化物或金屬鹵化物為金屬
能被還原的金屬是那些在電化學順序中位置低於鐵的金屬。這類反應多用來製備純金屬。
(3)、在有機化學中,氫的一個重要的化學反應是它能夠加在聯結兩個碳原子的雙鍵或三鍵上,使不飽和的碳氫化合物加氫而成為飽和的碳氫化合物,這類反應叫加氫反應。在有機化學中,在分子中加入氫即是還原反應。這類反應廣泛套用於將植物油通過加氫反應,由液體變為固體,生產人造黃油。也用於把硝基苯還原成苯胺(印染工業),把苯還原成環己烷(生產尼龍-66的原料)。氫同CO反應生成甲醇等等。
(4)、氫分子雖然很穩定,但在高溫下,在電弧中,或進行低壓放電,或在紫外線的照射下,氫分子能發生離解作用,得到原子氫。所得原子氫僅能存在半秒鐘,隨後便重新結合成分子氫,並放出大量的熱。
碳元素
碳:CARBON,源自carbo,也就是木炭,這種物質發現得很早,上圖顯示出它的三種自然形式:鑽石、炭和石墨。碳的無數化合物是我們日常生活中不可缺少的物質,產品從尼龍和汽油、香水和塑膠,一直到鞋油、滴滴涕和炸藥等,範圍廣泛種類繁多。
發現史
碳可以說是人類接觸到的最早的元素之一,也是人類利用得最早的元素之一。自從人類在地球上出現以後,就和碳有了接觸,由於閃電使木材燃燒後殘留下來木炭,動物被燒死以後,便會剩下骨碳,人類在學會了怎樣引火以後,碳就成為人類永久的“夥伴”了,所以碳是古代就已經知道的元素。發現碳的精確日期是不可能查清楚的,但從拉瓦錫(LavoisierAL1743—1794法國)1789年編制的《元素表》中可以看出,碳是作為元素出現的。碳在古代的燃素理論的發展過程中起了重要的作用,根據這種理論,碳不是一種元素而是一種純粹的燃素,由於研究煤和其它化學物質的燃燒,拉瓦錫首先指出碳是一種元素。碳在自然界中存在有三種同素異形體──金剛石、石墨、C60。金剛石和石墨早已被人們所知,拉瓦錫做了燃燒金剛石和石墨的實驗後,確定這兩種物質燃燒都產生了CO2,因而得出結論,即金剛石和石墨中含有相同的“基礎”,稱為碳。正是拉瓦錫首先把碳列入元素周期表中。C60是1985年由美國休斯頓賴斯大學的化學家哈里可勞特等人發現的,它是由60個碳原子組成的一種球狀的穩定的碳分子,是金剛石和石墨之後的碳的第三種同素異形體。碳元素的拉丁文名稱Carbonium來自Carbon一詞,就是“煤”的意思,它首次出現在1787年由拉瓦錫等人編著的《化學命名法》一書中。碳的英文名稱是Corbon。
碳單質
碳在地殼中的質量分數為0.027%,在自然界中分布很廣。以化合物形式存在的碳有煤、石油、天然氣、動植物體、石灰石、白雲石、二氧化碳等。截止1998年底,在全球最大的化學文摘——美國化學文摘上登記的化合物總數為18.8百萬種,其中絕大多數是碳的化合物。眾所周知,生命的基本單元胺基酸、核苷酸是以碳元素做骨架變化而來的。先是一節碳鏈一節碳鏈地接長,演變成為蛋白質和核酸;然後演化出原始的單細胞,又演化出蟲、魚、鳥、獸、猴子、猩猩、直至人類。這三四十億年的生命交響樂,它的主鏇律是碳的化學演變。可以說,沒有碳,就沒有生命。碳,是生命世界的棟樑之材。純淨的、單質狀態的碳有三種,它們是金剛石、石墨、C60。它們是碳的三種同素異形體。
金剛石
金剛石晶瑩美麗,光彩奪目,是自然界最硬的礦石。在所有物質中,它的硬度最大。測定物質硬度的刻畫法規定,以金剛石的硬度為10來度量其它物質的硬度。例如Cr的硬度為9、Fe為4.5、Pb為1.5、鈉為0.4等。在所有單質中,它的熔點最高,達3823K。金剛石晶體屬立方晶系,是典型的原子晶體,每個碳原子都以sp3雜化軌道與另外四個碳原子形成共價鍵,構成正四面體。這是金剛石的面心立方晶胞的結構。
 非金屬元素
非金屬元素由於金剛石晶體中C─C鍵很強,所有價電子都參與了共價鍵的形成,晶體中沒有自由電子,所以金剛石不僅硬度大,熔點高,而且不導電。室溫下,金剛石對所有的化學試劑都顯惰性,但在空氣中加熱到1100K左右時能燃燒成CO2。金剛石俗稱鑽石,除用作裝飾品外,主要用於製造鑽探用的鑽頭和磨削工具,是重要的現代工業原料,價格十分昂貴。
石墨
石墨烏黑柔軟,是世界上最軟的礦石。石墨的密度比金剛石小,熔點比金剛石僅低50K,為3773K。
在石墨晶體中,碳原子以sp2雜化軌道和鄰近的三個碳原子形成共價單鍵,構成六角平面的網狀結構,這些網狀結構又連成片層結構。層中每個碳原子均剩餘一個未參加sp2雜化的p軌道,其中有一個未成對的p電子,同一層中這種碳原子中的m電子形成一個m中心m電子的大∏鍵(鍵)。這些離域電子可以在整個兒碳原子平面層中活動,所以石墨具有層向的良好導電導熱性質。
石墨的層與層之間是以分子間力結合起來的,因此石墨容易沿著與層平行的方向滑動、裂開。石墨質軟具有潤滑性。由於石墨層中有自由的電子存在,石墨的化學性質比金剛石稍顯活潑。由於石墨能導電,有具有化學惰性,耐高溫,易於成型和機械加工,所以石墨被大量用來製作電極、高溫熱電偶、坩堝、電刷、潤滑劑和鉛筆芯。
碳六十
20世紀80年代中期,人們發現了碳元素的第三種同素異形體──C60。從以下三個方面介紹C60,碳六十的發現和結構特點,1996年10月7日,瑞典皇家科學院決定把1996年諾貝爾化學獎授予RobertFCurl,Jr(美國)、HaroldWKroto(英國)和RichardESmalley(美國),以表彰他們發現C60。1995年9月初,在美國德克薩斯州Rice大學的Smalley實驗室里,Kroto等為了模擬N型紅巨星附近大氣中的碳原子簇的形成過程,進行了石墨的雷射氣化實驗。他們從所得的質譜圖中發現存在一系列由偶數個碳原子所形成的分子,其中有一個比其它峰強度大20~25倍的峰,此峰的質量數對應於由60個碳原子所形成的分子。
C60分子結構及穩定
層狀的石墨和四面體結構的金剛石是碳的兩種穩定存在形式,當60個碳原子以它們中的任何一種形式排列時,都會存在許多懸鍵,就會非常活潑,就不會顯示出如此穩定的質譜信號。這就說明C60分子具有與石墨和金剛石完全不同的結構。由於受到建築學家BuckminsterFuller用五邊形和六邊形構成的拱形圓頂建築的啟發,Kroto等認為C60是由60個碳原子組成的球形32面體,即由12個五邊形和20個六邊形組成,只有這樣C60分子才不存在懸鍵。在C60分子中,每個碳原子以sp2雜化軌道與相鄰的三個碳原子相連,剩餘的未參加雜化的一個p軌道在C60球殼的外圍和內腔形成球面大∏鍵,從而具有芳香性。為了紀念Fuller,他們提出用Buckminsterfullerene來命名C60,後來又將包括C60在內的所有含偶數個碳所形成的分子通稱為Fuller,中譯名為富勒烯。
碳六十的製備
用純石墨作電極,在氦氣氛中放電,電弧中產生的煙炱沉積在水冷反應器的內壁上,這種煙炱中存在著C60、C70等碳原子簇的混合物。用萃取法從煙炱中分離提純富勒烯,將煙炱放入索氏(Soxhlet)提取器中,用甲苯或苯提取,提取液中的主要成分是C60和C70,以及少量C84和C78。再用液相色譜分離法對提取液進行分離,就能得到純淨的C60溶液。C60溶液是紫紅色的,蒸發掉溶劑就能得到深紅色的C60微晶。
碳六十的用途
從C60被發現的短短的十多年以來,富勒烯已經廣泛地影響到物理學、化學、材料學、電子學、生物學、醫藥學各個領域,極大地豐富和提高了科學理論,同時也顯示出有巨大的潛在套用前
景。據報導,對C60分子進行摻雜,使C60分子在其籠內或籠外俘獲其它原子或集團,形成類C60的衍生物。例如C60F60,就是對C60分子充分氟化,給C60球面加上氟原子,把C60球殼中的所有電子“鎖住”,使它們不與其它分子結合,因此C60F60表現出不容易粘在其它物質上,其潤滑性比C60要好,可做超級耐高溫的潤滑劑,被視為“分子滾珠”。再如,把K、Cs、Tl等金屬原子摻進C60分子的籠內,就能使其具有超導性能。用這種材料製成的電機,只要很少電量就能使轉子不停地轉動。再有C60H60這些相對分子質量很大地碳氫化合物熱值極高,可做火箭的燃料。
氧元素
概念
非金屬氣體化學元素,原子序數8,符號O。
【分子式】O2O3O4(已證明存在)
名稱
氧舊譯作氱(Oxygen)希臘文的意思是“酸素”,該名稱是由法國化學家拉瓦錫所起,原因是拉瓦錫錯誤地認為,所有的酸都含有這種新氣體。當前日文里氧氣的名稱仍然是“酸素”。而台語受到台灣日治時期的影響,也以“酸素”之日語發音稱呼氧氣。
氧氣的中文名稱是清朝徐壽命名的。他認為人的生存離不開氧氣,所以就命名為“養氣”即“養氣之質”,後來為了統一就用“氧”代替了“養”字,便叫這“氧氣”。
性質
氧氣通常條件下是呈無色、無臭和無味的氣體,密度1.429克/升,1.419克/立方厘米(液),1.426克/立方厘米(固),熔點-218.4℃,沸點-182.962℃,在-182.962℃時液化成淡藍色液體,在-218.4℃時凝固成雪狀淡藍色。固體在化合價一般為0和-2。電離能為13.618電子伏特。除惰性氣體外的所有化學元素都能同氧形成化合物。大多數元素在含氧的氣氛中加熱時可生成氧化物。有許多元素可形成一種以上的氧化物。氧分子在低溫下可形成水合晶體O2.H2O和O2.H2O2,後者較不穩定。氧氣在空氣中的溶解度是:4.89毫升/100毫升水(0℃),是水中生命體的基礎。氧在地殼中豐度占第一位。乾燥空氣中含有20.946%體積的氧;水有88.81%重量的氧組成。除了O16外,還有O17和O18同位素。
物理性質
為無色氣體;無臭,無味;有強助燃力。
在常壓20℃時,能在乙醇7容或水32容中溶解。
氧的單質形態有氧氣(O2)和臭氧(O3)。氧氣在標準狀況下是無色無味無臭,能幫助燃燒的雙原子的氣體。液氧呈淡藍色,具有順磁性。氧能跟氫化合成水。臭氧在標準狀況下是一種有特殊臭味的藍色氣體。
新的氧單質(O4):O4是義大利的一位科學家合成的一種新型的氧分子,一個分子由四個氧原子構成.
振盪會發生爆炸,產生氧氣:O4===振盪===2O2
它的氧化性比O2強的多.
在大氣中含量極少
合成方法:
義大利科學家使用普通氧分子與帶正電的氧離子作用,製造出o4
O4的能量密度比普通氧分子高
O4是一種比黃金還貴的氣體,氧化性極強,可以與黃金反應.
是用普通氧分子和帶正電的氧離子製造出含4個氧原子的氧分子。
這種氧分子可以穩定存在,預計構型為正四面體或者矩形,從兩種構型中性分子O4,正一價分子O4+和負一價分子O4-的基態電子結構,並根據能量最低原則確定了各自的結構參數,從而得到了O4分子2種結構的基態總能量、一價電離能及電子親合勢能.與氧原子、普通氧分子O2和臭氧分子O3的計算結果比較,顯示O4分子可以以正方形結構或正四面體結構形式存在,其中正方形結構更有可能是O4分子的真實空間結構.
化學性質
氧的非金屬性和電負性僅次於氟,除了氦氖氬氪氟所有元素都能與氧起反應,這些反應稱為氧化反應,而反應產生的化合物稱為氧化物。一般而言,絕大多數非金屬氧化物的水溶液呈酸性,而鹼金屬或鹼土金屬氧化物則為鹼性。此外,幾乎所有的有機化合物,可在氧中劇烈燃燒生二氧化碳與水蒸氣。
氧的化合價:氧的化合價很特殊一般為-2價和0價。而氧在過氧化物中通常為-1價。在超氧化物中為-1/2,臭氧化物中氧為-1/3,超氧化物中氧的化合價只能說是超氧根離子,不能單獨的看每個原子,因為電子是量子化的,不存在1/2個電子,自然化合價也就沒有0.5的說法,臭氧化物也一樣。而氧的正價很少出現,只有在和氟的化合物二氧化氟,二氧化二氟和六氟合鉑酸二氧(O2PTF6)中顯示+2價和+1價,在中學化學中只要記住氧和氟是沒有正價就可以了。
實驗證明,除黃金外的所有金屬都能和氧發生反應生成金屬氧化物,比如鉑在高溫下在純氧中被氧化生成二氧化鉑,黃金一般認為不能和氧發生反應,但是有三氧化二金和氫氧化金等化合物,其中金為+3價;氧氣不能和氯,溴,碘發生反應,但是臭氧可以氧化它們.

