發現歷史
 鈾
鈾1841年,佩利戈特(E.M.Peligot)指出,克拉普羅特分離出的“鈾”,實際上是二氧化鈾。他用鉀還原四氯化鈾,成功地獲得了金屬鈾。1896年有人發現了鈾的放射性衰變。1939年,哈恩(O.Hahn)和斯特拉斯曼(F.Strassmann)發現了鈾的核裂變現象。自此以後,鈾便變得身價百倍。
礦藏分布
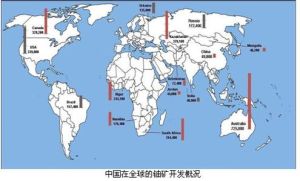 鈾的開發分布
鈾的開發分布地殼中鈾的平均含量約為百萬分之2.5,即平均每噸地殼物質中約含2.5克鈾,這比鎢、汞、金、銀等元素的含量還高。鈾在各種岩石中的含量很不均勻。例如在花崗岩中的含量就要高些,平均每噸含3.5克鈾。在地殼的第一層(距地表20km)內含鈾近1.3×1014噸。依此推算,一立方公里的花崗岩就會含有約一萬噸鈾。海水中鈾的濃度相當低,每噸海水平均只含3.3毫克鈾,但由於海水總量極大(海水中總含鈾量可達4.5×109噸),且從水中提取有其方便之處,所以不少國家,特別是那些缺少鈾礦資源的國家,正在探索海水提鈾的方法。
由於鈾的化學性質很活潑,所以自然界不存在游離態的金屬鈾,它總是以化合狀態存在著。已知的鈾礦物有一百七十多種,但具有工業開採價值的鈾礦只有二、三十種,其中最重要的有瀝青鈾礦(主要成分為八氧化三鈾)、品質鈾礦(主要成分為二氧化鈾)、鈾石和鈾黑等。很多的鈾礦物都呈黃色、綠色或黃綠色。有些鈾礦物在紫外線下能發出強烈的螢光。正是鈾礦物(鈾化合物)這種發螢光的特性,才導致了放射性現象的發現。
雖然鈾元素的分布相當廣,但鈾礦床的分布卻很有限。鈾資源主要分布在美國、加拿大、南非、西南非洲、澳大利亞等國家和地區。據估計,已探明的工業儲量到1972年已超過一百萬噸。中國鈾礦資源也十分豐富。
鈾及其一系列衰變子體的放射性是存在鈾的最好標誌。人的肉眼雖然看不見放射性,但是藉助於專門的儀器卻可以方便地把它探測出來。因此,鈾礦資源的普查和勘探幾乎都利用了鈾具有放射性這一特點:若發現某個地區岩石、土壤、水、甚至植物內放射性特彆強,就說明那個地區可能有鈾礦存在。
元素性質
物理性質
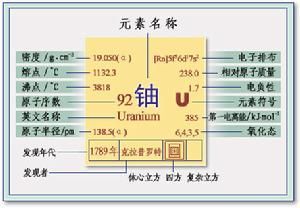
鈾(拼音:yóu;英語拼寫:Uranium),是元素周期表中第七周期MB族元素,錒系元素之一,是重要的天然放射性元素,元素符號U,原子序數92,原子量238.0289。鈾原子有92個質子和92個電子,其中6個是價電子。
鈾為銀白色金屬,熔點1132.5℃,沸點3745℃,抗拉強度450MPa,屈服強度207MPa,彈性模數172GPa。鈾在接近絕對零度時有超導性,有延展性。所有鈾同位素皆不穩定,具有微弱放射性。
化學性質
 鈾的元素周期表
鈾的元素周期表鈾與鹵素反應生成鹵化物,鈾能與汞、錫、銅、鉛、鋁、鉍、鐵、鎳、錳、鈷、鋅、鈹作用生成金屬間化合物,金屬鈾緩慢溶於硫酸和磷酸,有氧化劑存在時會加速溶解,鈾易溶於硝酸,鈾對鹼性溶液呈惰性,但有氧化劑存在時,能使鈾溶解,鈾及其化合物均有較大的毒性,空氣中可溶性鈾化合物的允許濃度為0.05mg/m3,不溶性鈾化合物允許濃度為0.25mg/m3,人體對天然鈾的放射性允許劑量,可溶性鈾化合物為7400Bq,不溶性鈾化合物為333Bq。
活潑,能和所有的非金屬作用(惰性氣體除外),能與多種金屬形成合金。空氣中易氧化,生成一層發暗的氧化膜。 常見化合價:+3,+4,+5,+6,其中+4和+6價化合物穩定。鈾與鹵素反應生成鹵化物,鈾能與汞、錫、銅、鉛、鋁、鉍、鐵、鎳、錳、鈷、鋅、鈹作用生成金屬間化合物。
可燃性
高度粉碎的鈾空氣中極易自燃,塊狀鈾在空氣中易氧化失去金屬光澤,在空氣中加熱即燃燒,
250℃下和硫反應,400℃下和氮反應生成氮化物,1250℃下和碳反應生成碳化物,250-300℃下和氫反應生成UH3,UH3在真空350-400℃下分解,放出氫氣。
溶解性
金屬鈾緩慢溶於硫酸和磷酸,有氧化劑存在時會加速溶解,鈾易溶於硝酸,鈾對鹼性溶液呈惰性,但有氧化劑存在時,能使鈾溶解
毒理性質
鈾及其化合物均有較大的毒性,空氣中可溶性鈾化合物的允許濃度為0.05mg/m3,不溶性鈾化合物允許濃度為0.25mg/m3,人體對天然鈾的放射性允許劑量,可溶性鈾化合物為7400Bq,不溶性鈾化合物為333Bq。
同位素
238u:自然豐度99.275%,原子量238.0508,半衰期4.51X109a
235U:自然豐度0.720%,原子量235.0439,半衰期7.00X108a
234U:自然豐度0.005%,原子量234.0409,半衰期2.47X105a
其中235u是惟一天然可裂變核素,受熱中子轟擊時吸收一個中子後發生裂變,放出總能量為195MeV,同時放2~3箇中子,引發鏈式核裂變;238U是製取核燃料鈽的原料。
鈾的熱中子吸收截面為7.60b,鈾有15種同位素,其原子量從227-240。所有鈾同位素皆不穩定,具有微弱放射性。
化合物
鈾的氟化物六氟化鈾(UF6),它的熔點是攝氏56度、三相點是攝氏64度及稍高於大氣壓力。提煉鈾-235的方法之一就是分離不同分子量的六氟化鈾。鈾235能產生非常大的動能,約等於10噸多的木炭。
套用
 濃縮鈾離心
濃縮鈾離心鈾是重要的核燃料,主要用於原子能發電和核武器,1kg235U核完全裂變所釋放的能量相當於燃燒2500t優質煤所放出的能量,核燃料動力堆用於原子能發電、供熱和潛水艇等船艇的動力裝置,世界核能發電量約占總發電量的23%。
核電站套用較多的反應堆為:輕水堆(以燒結低濃UO2為燃料)、重水堆(以天然UO2芯塊作燃料)和塊中心增殖堆(以PUO2和天然UO2混合物作燃料)。
核武器
軍事上鈾用作核武器燃料,用純淨23592U製造的核子彈叫核子彈。估計一顆鈾核子彈約需10kg純鈾。另一種核子彈是由23892U產出的懷彈。
其他
鈾也是熱核武器氫彈的引爆劑,鈾核裂變時產生的200多种放射性同位素,經分離後廣泛用於國民經濟各個部門,如農業上用於輻照育種,食品工業用於食品保鮮滅菌,醫藥上用於放射治療,工業上用於無損探傷、地質勘探、文物考古等。利用鈾的高密度,還用於製造殺傷力大的穿甲彈(鈾彈)。
放射性治療原料
在居里夫婦發現鐳以後,由於鐳具有治療癌症的特殊功效,鐳的需要量不斷增加,因此許多國家開始從瀝青鈾礦中提煉鐳,而提煉過鐳的含鈾礦渣就堆在一邊,成了“廢料”。然而,鈾核裂變現象發現後,鈾變成了最重要的元素之一。這些“廢料”也就成了“寶貝”。從此,鈾的開採工業大大地發展起來,並迅速地建立起了獨立完整的原子能工業體系。
提煉
 鈾提煉
鈾提煉鈾礦的開採與其它金屬礦床的開採並無多大的區別,但由於鈾礦石的品位一般很低(約千分之一),而用作核燃料的最終產品的純度又要求很高(金屬鈾的純度要求在99.9%以上,雜質增多,會吸收中子而妨礙鏈式反應的進行),所以鈾的冶煉不象普通金屬那樣簡單,而首先要採用“水冶工藝”,把礦石加工成含鈾60~70%的化學濃縮物(重鈾酸銨),再作進一步的加工精製。
純化
鈾水冶得到的化學濃縮物(重鈾酸氨)呈黃色,俗稱黃餅子,但它仍含有大量的雜質,不能直接套用,需要作進一步的純化。先用硝酸將重鈾酸銨溶解,得到硝酸鈾醯溶液。再用溶劑萃取法純化(一般用磷酸三丁酯作萃取劑),以達到所要求的純度標準.純化後的硝酸鈾醯溶液需經加熱脫硝,轉變成三氧化鈾,再還原成二氧化鈾。二氧化鈾是一種棕黑色粉末,很純的二氧化鈾本身就可以用作反應堆的核燃料。
進一步反應
為製取金屬鈾,需要先將二氧化鈾與無水氟化氫反應,得到四氟化鈾;最後用金屬鈣(或鎂)還原四氟化鈾,即得到最終產品金屬鈾。
製備方法
從鈾礦石中提取鈾直到製成核純(見放射性核素純度)鈾化合物的工藝過程,是天然鈾生產的重要步驟。主要產品有重鈾酸銨(俗稱黃餅)和三碳酸鈾醯銨等。純化(又稱精製)後的鈾化合物產品,必須達到核純的要求。精製的產品進一步乾燥、煅燒,加工成二氧化鈾或八氧化三鈾,供製作反應堆元件或六氟化鈾(用於235U的同位素分離)用。整個過程須經下述單元操作:鈾礦石的破碎和磨細、鈾礦石的浸取、礦漿的固液分離、離子交換和溶劑萃取法提取鈾濃縮物、溶劑萃取法純化鈾濃縮物。可根據礦石種類、產品要求等不同情況,選擇由上述單元操作所組成的適當流程。
破碎和磨細
破碎是將礦石經顎式破碎機、圓錐破碎機或錘式破碎機粗碎、中碎和細碎以達到所要求的粒度。然後進行細磨,以達到浸取工序所要求的粒度。
浸取
用溶劑將礦石中的鈾選擇性地溶解。鈾礦石經浸取後,鈾與大部分脈石分離,浸取液中鈾與雜質的比例比原礦石中約提高10~30倍,因此,浸取過程也是鈾與雜質初步分離的過程。
鈾礦石浸取方法一般有酸法和鹼法兩種。多數鈾水冶廠採用酸浸取法,少數廠用鹼浸取法,只有個別廠同時採用酸、鹼兩種浸取流程。酸浸取法一般用硫酸作浸取劑,礦石中的鈾和硫酸反應,生成可溶的鈾醯離子UO2和硫酸鈾醯離子[UO2(SO4)]x;浸取時常加入氧化劑(常用二氧化錳、氯酸鈉),以保持適宜的氧化還原電勢(約450毫伏),使四價鈾氧化成六價,以提高鈾的浸出率。含碳酸鹽的鈾礦石主要用鹼法浸取,常用的浸取劑為碳酸鈉和碳酸氫鈉的水溶液,在鼓入空氣的條件下,礦石中的鈾與碳酸鈉生成碳酸鈾醯鈉Na4[UO2(CO3)3],溶於浸取液。
礦漿的固液分離
礦石浸取後所得到的酸性或鹼性礦漿(包括含鈾溶液、部分雜質及固體礦渣)中的溶液和礦渣須經分離。根據需要也可進行粗獷分級,以除去+200~40目的粗砂,得到細泥礦漿。常用的固液分離設備有過濾機、沉降槽(濃密機);分級設備有螺鏇分級機、水力鏇流器。中國還採用流態化塔進行分級和洗滌。
分離出的溶液可用離子交換法分離鈾,也可用溶劑萃取法分離和純化鈾,或將鈾從含鈾溶液中沉澱出來。
 鈾提煉
鈾提煉固液分離後的浸取液中八氧化三鈾的含量大致為500~1000毫克/升。對於含鈾濃度低的浸取液採用離子交換法提取鈾較為合宜。離子交換法一般採用強鹼性陰離子交換樹脂吸附鈾。按吸附液含固量的多少,吸附可分為清液吸附、混濁液吸附和礦漿吸附。當樹脂吸咐飽和後,經水洗,再用淋洗劑(硫酸-氯化鈉、硫酸-氯化銨、硝酸-硝酸鈉、硝酸-硝酸銨、稀硫酸或稀硝酸)將鈾從樹脂上淋洗下來。
萃取法提取和精製
鈾水冶廠處理的溶液是體積大、鈾濃度低、雜質含量高的稀溶液,須將鈾與雜質分離並初步使鈾濃縮,而在精製工藝中,處理的是高濃度的含鈾溶液,產品質量要求達到核純。在鈾的萃取工藝中常用的有機膦與烷基胺類萃取劑有磷酸三丁酯(TBP)、二(2-乙基己基)磷酸、三辛胺等。
在鈾水冶廠,硫酸體系的萃取多採用磷類和胺類兩種萃取工藝(鹼性體系的萃取常用季銨鹽萃取工藝),如烷基膦萃取工藝和胺類萃取工藝流程,後者在世界上套用較多。中國套用較多的是淋萃流程。吸附鈾的飽和樹脂,用1mol/L的硫酸淋洗,隨後對此淋洗液進行萃取。例如淋萃流程所用的萃取劑是0.2mol/L的二(2-乙基己基)磷酸—0.1mol/L的三烷基氧膦體系。有機相的飽和度控制在85%以上,經水洗後,用碳酸銨結晶反萃取,可得核純三碳酸鈾醯。此流程中淋洗與萃取結合,使萃取所處理的液量減少,金屬回收率高,節省試劑,產品純度也高。
鈾水冶廠生產的產品一般為工業鈾濃縮物,仍含有硫酸鹽、矽、鈣、鎂等雜質,須進一步精製,才能得到核純產品。精製過程中最常用的是TBP萃取工藝,TBP對鈾飽和容量大,可處理含鈾量高的溶液,在有機相接近飽和的條件下,對雜質元素有較高的淨化能力。
從溶液中沉澱
在浸取所得溶液中,也可將鈾以不溶性化合物的狀態分離出來;並可通過對沉澱物的多次溶解及再沉澱而進行純化。主要有鹼中和法和過氧化氫沉澱法:
鹼中和法
將鹼性沉澱劑如氨水、氧化鎂、氣態氨等加入到酸性含鈾溶液中,並控制最終pH值為6.5~8.0,鈾以重鈾酸鹽形式完全沉澱出來。對鹼性浸取液主要採用氫氧化鈉沉澱劑,得鈾酸鈉或重鈾酸鈉沉澱。如果從純化過的酸性溶液中沉澱鈾,則其沉澱物重鈾酸銨的純度較高。
過氧化氫沉澱法
將含鈾溶液的pH調至2.5~4.0,緩慢加入比化學計算量過量的30%過氧化氫,再加入適量的氨水,以中和反應過程生成的酸,使最終pH值達2.8,生成鈾的過氧化物(UO4·xH2O)沉澱。過氧化氫沉澱法對鈾選擇性高,並可獲得晶狀、易處理的產品,也具有工業意義。
范德華濃縮技術
純度為3%的U-235為核電站發電用低濃縮鈾,U-235純度大於80%的鈾為高濃縮鈾,其中純度大於90%的稱為武器級高濃縮鈾,主要用於製造核武器。獲得鈾是非常複雜的系列工藝,要經過探礦、開礦、選礦、浸礦、煉礦、精煉等流程,而濃縮分離是其中最後的流程,需要很高的科技水平。獲得1公斤武器級U-235需要200噸鈾礦石。由於涉及核武器問題,鈾濃縮技術是國際社會嚴禁擴散的敏感技術。除了幾個核大國之外,日本、德國、印度、巴基斯坦、阿根廷等國家都掌握了鈾濃縮技術。
提煉濃縮鈾方法主要有氣體擴散法和氣體離心法。
氣體擴散法:使待分離的氣體混合物流入裝有擴散膜(分離膜)的裝置來得到富集和貧化的兩股流的同位素分離方法。基本原理是:在分子間的相互碰撞忽略不計的情況下,氣體混合物中質量不同的氣體分子(例如235UF6和238UF6)的平均熱運動速率與其質量二次方根成反比。當氣體通過擴散膜時,速率大的輕分子(235UF6)通過的幾率比速率小的重分子(238UF6)的大。這樣,通過膜以後,輕分子的含量就會提高,從而達到同位素分離的目的。
第二次世界大戰結束後,美國的實踐證明,氣體擴散法能夠用來大規模生產鈾235。它是目前最成熟的大規模分離鈾同位素的方法,是對各種新的濃縮方法的大規模商業套用的挑戰,是比較各種方法的基本點。美國和法國大型氣體擴散工廠的分離功率達1萬噸/年以上,比能耗均在2400千瓦·時/千克左右。氣體擴散法的缺點是分離係數小,工廠規模大,耗電量驚人,成本很高。
氣體離心法:氣體離心分離機是其中的關鍵設備。鈾原料放置於離心機中央反應室內,離心機以7-8萬轉/分鐘的速度鏇轉。較重的238U原子逐漸靠近離心機的邊緣,而較輕的235U則保留在離心機中心部位。結晶235U被稱為“富鈾”(濃縮鈾),其餘的“貧鈾”則被丟棄。僅靠單個離心機一次分離是遠遠不夠的,必須通過更多離心機加工,才可以分離提純。這些離心機以“級聯配置”聯接一體。因而,“級聯配置”成為核物質用途的又一重要線索。鈾在一級離心機提純後,會轉送到下一級離心機繼續提純,級級相連。由於核電站所需鈾濃縮較低,其離心機級聯層次較少,因而看起來會比較短。而用作核武器的鈾濃度要達到90%以上,其離心機層次更多,級聯配置自然顯得又細又長。
美國等國家通常把擁有該設備作為判斷一個國家是否進行核武器研究的標準。核電站核反應堆只需3%~5%的235U,而要生產核武器,235U濃度至少要達到90%。如果發現某個國家的235U濃度達到90%,這就是企圖製造核武器的鐵證。
儲存方法
應該儲存於陰涼、通風防輻射庫房。庫溫不超過30℃,相對濕度不超過80%。保持容器密封。應與鹼類、胺類、鹼金屬、易(可)燃物分開存放,切忌混儲。儲區應備有泄漏應急處理設備和合適的收容材料。
濃縮鈾
鈾主要含三種同位素,即鈾238、鈾235和鈾234,其中只有鈾235是可裂變核元素,在中子轟擊下可發生鏈式核裂變反應,可用作核子彈的核裝料和核電站反應堆的燃料。
根據國際原子能機構的定義,豐度為3%的鈾235為核電站發電用低濃縮鈾,鈾235豐度大於80%的鈾為高濃縮鈾,其中豐度大於90%的稱為武器級高濃縮鈾,主要用於製造核武器。
在天然礦石中鈾的三種同位素共生,其中鈾235的含量非常低,只有約0.7%。為滿足核武器和核動力的需求,一些國家建造了鈾濃縮廠,以天然鈾礦作原料,運用同位素分離法(擴散法、離心法和雷射法等)使天然鈾的三種同位素分離,以提高鈾235的豐度,提煉濃縮鈾。
核子彈
 核子彈
核子彈另外一種核子彈:內爆式鈽彈是一種嶄新的設計,曼哈頓計畫期間製造的“胖子”核子彈就是用的易爆炸、壓縮的鈽。美國在1945年7月16日新墨西哥州試爆了一枚稱為“小玩意”(Gadget)的核子彈。結果試驗非常成功,得到的當量達二萬公噸,比原先預計高出二至四倍。
主要危害
鈾屬高毒性元素,進入人體的鈾難以排出,由它發射的阿爾法射線所引起的體內輻照損傷是高度累積性的,易蓄積在骨骼、肝腎部位。其顯示的化學毒性與汞相似,會引起腎臟病變、肝炎及神經系統病變。但除非是戰事或突發性職業事故,日常生活中經人體攝入多量鈾的事故是極為罕見的。
相關新聞
2012年11月4日,中國國土資源部表示,內蒙古中部大營地區鈾礦勘查取得重大突破,發現中國最大規模的可地浸砂岩型鈾礦床。連同此前的勘查成果,該地區累計控制鈾資源量已經躋身世界級大礦行列。這一發現打破了中國此前沒有世界級大鈾礦的局面。
2014年3月,美國白宮在海牙2014年核安全峰會正式開幕前夕搶先在海牙發布訊息,美日兩國領導人在聲明中表示,“該高濃縮鈾在被送至美國後,將被送至安全場所並將其轉化至不那么敏感的存在形式;與此同時,將對(日本歸還的)武器級鈽進行最終處理。”
尚無宣布歸還的高濃縮鈾具體數量,然而根據媒體此前預估,總量大概在450磅(205公斤)。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||

