元素簡介
 錳
錳錳是人類必需的微量元素,地球上一切生命的生物學功能都與錳元素緊密相關。它是構成正常骨骼時所必要的物質,有著多方面的作用。它可以激活必要的酶,使維生素H、B、C能順利被人體利用;在製造甲狀腺素時也不可或缺。但是,人體吸收過量則會引起錳中毒,重度的可出現精神病的症狀,如暴躁、幻覺等,產生錳狂症。
發現過程
 錳砂
錳砂1774年,瑞典的甘恩,用軟錳礦和木炭在坩堝中共熱,發現一紐扣大的錳粒。錳是在地殼中廣泛分布的元素之一。它的氧化物礦——軟錳礦早為古代人們知悉和利用。但是,一直到18世紀的70年代以前,西方化學家們仍認為軟錳礦是含錫、鋅和鈷等的礦物。
18世紀後半葉,瑞典化學家T.O.柏格曼研究了軟錳礦,認為它是一種新金屬氧化物。他曾試圖分離出這個金屬,卻沒有成功。舍勒也同樣沒有從軟錳礦中提取出金屬,便求助於他的好友、柏格曼的助手——甘英。
1774年,甘英分離出了金屬錳。柏格曼將它命名為managnese(錳)。它的拉丁名稱manganum和元素符號Mn由此而來。
物理性質
 電解金屬錳
電解金屬錳在固態狀態時它以四種同素異形體存在α錳(體心立方),β錳(立方體),γ錳(面心立方),δ錳(體心立方)。電離能為7.435電子伏特。
元素符號:Mn
元素原子量:54.94
CAS號:7439-96-5
元素類型:金屬元素
體積彈性模量:120(GPa)
原子化焓:280.3(kJ/mol@25℃)
熱容:26.32J/(mol·K)
導電性:0.0069510^6/(cm·Ω)
原子體積:7.39(立方厘米/摩爾)
元素在太陽中的含量:10(ppm)
元素在海水中的含量:
太平洋表面:0.0001(ppm)
地殼中含量:950(ppm)
質子數:25
中子數:30
相對原子質量:54.938049
原子序數:25
所屬周期:4
所屬族數:VIIB
價電子排布:1s22s22p63s23p63d54s2
外圍電子層排布:3d54s2
電子層:K-L-M-N
電子層分布:2-8-13-2
晶體結構:晶胞為體心立方晶胞,每個晶胞含有2個金屬原子。
晶胞參數:
a=891.25pm
b=891.25pm
c=891.25pm
α=90°β=90°
γ=90°
莫氏硬度:6
電離能(kJ/mol)
M-M+717.4
M+-M2+1509.0
M2+-M3+3248.4
M3+-M4+4940
M4+-M5+6990
M5+-M6+9200
M6+-M7+11508
M7+-M8+18956
M8+-M9+21400
M9+-M10+23960
聲音在其中的傳播速率:5150(m/S)
化學性質
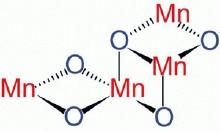 錳原子和氧原子
錳原子和氧原子錳在空氣中易氧化,生成褐色的氧化物覆蓋層。它也易在升溫時氧化。氧化時形成層狀氧化銹皮,最靠近金屬的氧化層是MnO,而外層是Mn3O4。
化合價錳的化合價有+2、+3、+4、+6和+7。其中以+2(Mn2+的化合物)、+4(二氧化錳,為天然礦物)和+7(高錳酸鹽,如KMnO4)、+6(錳酸鹽,如K2MnO4)為穩定的氧化態。在酸性溶液中,+3價的錳和+6價的錳均比較容易發生歧化反應:
Mn較穩定,不容易被氧化,也不容易被還原。MnO4和MnO2有強氧化性。在鹼性溶液中,Mn(OH)2不穩定,易被空氣中的氧氣氧化為MnO2;MnO4也能發生歧化反應,但反應不如在酸性溶液中進行得完全。
下面列出部分其化合價對應的化合物:
Mn-3:Na3[Mn(CO)4]
Mn-1:Na[Mn(CO)5]
Mn0:MnMn2(CO)10K6[Mn(CN)6]
Mn+1:K5[Mn(CN)6]
Mn+3:MnF3K3[Mn(CN)6]
Mn+4:MnO2K2[MnF6]MnF4
Mn+5:Na3MnO4
Mn+6:MnO42-
Mn+7:MnO4-MnO3F
和氧氣的反應在空氣中易氧化,生成褐色的氧化物覆蓋層。它也易在升溫時氧化。氧化時形成層狀氧化銹皮,最靠近金屬的氧化層是MnO(一氧化錳),而外層是Mn3O4(四氧化三錳):
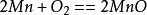 反應 1
反應 1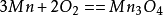 反應 2
反應 2在高於800℃的溫度下氧化時,MnO的厚度逐漸增加,而Mn3O4層的厚度減少。在800度以下出現第三種氧化層Mn2O2。在約450℃以下最外面的第四層氧化物MnO2是穩定的。和水、酸的反應
錳和鐵化學性質相似,常溫與水反應緩慢,當自身高溫時,反應迅速,水變為氫氣,錳被氧化,形成複雜氧化物;錳易溶於稀酸,並有氫氣放出,生成二價錳離子:錳和濃硫酸、濃硝酸等氧化性酸反應生成二氧化硫、二氧化氮,自身被氧化成二價錳。錳和錳礦是有些極大的分別的。
研究歷史
1774年,瑞典的甘恩,用軟錳礦和木炭在坩堝中共熱,發現一紐扣大的錳粒。錳是在地殼中廣泛分布的元素之一。它的氧化物礦——軟錳礦早為古代人們知悉和利用。但是,一直到18世紀的70年代以前,西方化學家們仍認為軟錳礦是含錫、鋅和鈷等的礦物。18世紀後半葉,瑞典化學家T.O.柏格曼研究了軟錳礦,認為它是一種新金屬氧化物。他曾試圖分離出這個金屬,卻沒有成功。舍勒也同樣沒有從軟錳礦中提取出金屬,便求助於他的好友、柏格曼的助手——甘恩。在1774年,甘恩分離出了金屬錳。柏格曼將它命名為manganese(錳)。它的拉丁名稱manganum和元素符號Mn由此而來。
來源分布
來源
重要的礦物是軟錳礦、輝錳礦和褐錳礦等。可用鋁熱法還原軟錳礦製得。
分布
截至2007年底,中國錳礦(礦石)查明資源儲量79293.5萬噸,其中基礎儲量22443.7萬噸(儲量為12714.1萬噸),資源量為56849.8萬噸。我國錳礦查明資源儲量分布於全國23個省、自治區、直轄市,但主要集中在廣西(28125.9.萬噸,占35.5%)、湖南(15845.0萬噸,占20.0%)、雲南(9215.7萬噸,占11.6%)、貴州(7981.5萬噸,占10.1%)、遼寧(4190.1萬噸,5.3%)和重慶(4127.6萬噸,占5.2%),六省合計69485.8萬噸,占全國錳礦查明資源儲量總量的87.6%。中國錳礦資源較多,分布廣泛,在全國21個省(區)均有產出;有探明儲量的礦區213處,總保有儲量礦石5.66億噸,居世界第3位。中國富錳礦較少,在保有儲量中僅占6.4%。從地區分布看,以廣西、湖南為最豐富,占全國總儲量的55%;貴州、雲南、遼寧、四川等地次之。從礦床成因類型來看,以沉積型錳礦為主,如廣西下雷錳礦、貴州遵義錳礦、湖南湘潭錳礦、永州零陵區珠山鎮錳礦、遼寧瓦房子錳礦、江西樂平錳礦等;其次為火山-沉積礦床,如新疆莫托沙拉鐵錳礦床;受變質礦床,如四川虎牙錳礦等;熱液改造錳礦床,如湖南瑪瑙山錳礦;表生錳礦床,如廣西欽州錳礦。從成礦時代來看,自元古宙至第四紀均有錳礦形成,以震旦紀和泥盆組為最重要。
主要用途
簡介
冶金工業中用來製造特種鋼;鋼鐵生產上用錳鐵合金作為去硫劑和去氧劑。
在實驗室中二氧化錳常用作催化劑使用(把二氧化錳加入雙氧水中分解氧氣,還有把二氧化錳混合氯酸鉀一起加熱)。
合金
錳鋼的脾氣十分古怪而有趣:如果在鋼中加入2.5—3.5%的錳,那么所製得的低錳鋼簡直脆得像玻璃一樣,一敲就碎。然而,如果加入13%以上的錳,製成高錳鋼,那么就變得既堅硬又富有韌性。高錳鋼加熱到淡橙色時,變得十分柔軟,很易進行各種加工。另外,它沒有磁性,不會被磁鐵所吸引。如今,人們大量用錳鋼製造鋼磨、滾珠軸承、推土機與掘土機的鏟斗等經常受磨的構件,以及鐵錳錳軌、橋樑等。上海新建的文化廣場觀眾廳的屋頂,採用新穎的網架結構,用幾千根錳鋼鋼管焊接而成。在縱76米、橫138米的扇形大廳里,中間沒有一根柱子。由於用錳鋼作為結構材料,非常結實,而且用料比別的鋼材省,平均每平方米的屋頂只用45公斤錳鋼。1973年興健的上海體育館(容納一萬八千人),也同樣採用錳鋼作為網架屋頂的結構材料。在軍事上,用高錳鋼製造鋼盔、坦克鋼甲、穿甲彈的彈頭等。煉製錳鋼時,是把含錳達60一70%的軟錫礦和鐵礦一起混合冶煉而成的。影響
錳是煉鋼時用錳鐵脫氧而殘留在鋼中的,錳有很好的脫氧能力,能把鋼中的FeO還原成鐵,改善鋼的質量;還可以與硫形成MnS,從而減輕了硫的有害作用。降低鋼的脆性,改善鋼的熱加工性能;錳能大部分溶於鐵素體,形成置換固溶體,使鐵素體強化提高鋼的強度和硬度。錳是鋼中的有益元素。對人體影響
錳廣泛分布於生物圈內,但是人體內含量甚微。成年人體內錳的總量約為200~400umol,分布在身體各種組織和體液中。骨、肝、胰、腎中錳濃度較高;腦、心、肺和肌肉中錳的濃度低於20nmol/g;全血和血清中的錳濃度分別為200nmol/L和20nmol/L。錳在線粒體中的濃度高於在細胞漿或其它細胞器中的濃度,所以線粒體多的組織錳濃度較高。
錳是構成正常骨骼時所必要的物質,並有著多方面的作用。它可能與維持正常腦部機能息息相關,對阿爾茲海默症(老年痴呆的一種)具有療效;可以激活必要的酶,使維生素H、B、C能順利地被人體所利用;在製造甲狀腺素時也不可或缺 。
作用
 金屬錳
金屬錳錳被確定為人類必需微量元素約有60多年的歷史。在體內含量很少,但起著非常重要的作用。
一、可影響骨骼的正常生長和發育。用缺錳飼料餵養雌性大鼠,所生幼鼠骨骼生長不成比例。四股骨骼縮短,脊骨彎曲,顱骨也變形。
二、可影響糖的新陳代謝。如豚鼠缺錳後,葡萄糖耐受異常,葡萄糖利用率下降,使胰島素合成與分泌降低,可能是胰島素肝細胞受到了破壞。也可見實驗動物腹腔和肝臟的脂肪儲存明顯增加。
三、錳在維持正常腦功能中必不可缺,與智慧型發展、思維、情感、行為均有一定關係。缺少時可引起神經衰弱綜合症。癲癇病人、精神分裂症病人頭髮和血清中錳含量均低於正常人。
四、錳與衰老:有學者報導,哺乳類動物的衰老可能與錳一過氧化物酶減少引起抗氧化作用降低有關,因而長壽可能與高錳存在某些關係。我國廣西巴馬縣長壽公社的長壽老人,發錳含量明顯高於其它地區。
五、錳與癌症的關係已引起人們的關註:在流行病學的調查中可見,癌症患者發錳含量顯著低於正常人。在動物誘癌實驗中也看到,隨著癌瘤的發生與發展,肝、肺中錳含量降低,但腫瘤部位猛含量升高。但總的來看,尚需進行更多的研究。
需要量
雖然大海底下錳含量非常豐富,錳在人體中作用也不小,但人體對錳的需要量還是很微少的,普通人的膳食中,錳的需要量為每天4~9毫克,其中約一半經腸道吸收。
中國營養學會制定了錳的“安全和適宜的攝入量”參考指標,6個月以內嬰兒每人每天0.5~0.7毫克,1歲以內0.7~1.0毫克,1歲以上1.0~1.5毫克,4歲以上1.5~2.0毫克,7歲以上2.0~2.5毫克,11歲以上至青年及成年每人每天均為2.0~3.0毫克。
錳失調危害
缺乏症
很少發現患有錳缺乏的人,缺乏錳可能會產生運動失調症。
錳缺乏還可能與某些疾病有關。在骨質疏鬆、糖尿病、動脈粥樣硬化、癲癇、創傷癒合不良的患者中存在膳食錳攝入少,血錳、組織錳低的問題。
過量表現
典型症狀時神經系統錐體外束的損害和與之相應的震顫麻痹綜合症。
在肝功能受損、膽道不通暢或兼有兩者的病人中發現錳中毒,病人腦MRI檢查呈現明顯異常,中毒減輕後此種異常亦隨之改善。
有人曾發現神經系統功能障礙者腦中錳濃度高於正常;有暴力行為的人發現錳高於正常。
食物來源
成年人每日錳供給量為每千克體重0.1毫克。食物中茶葉、堅果、粗糧、乾豆含錳最多,蔬菜和乾鮮果中錳的含量略高於肉、乳和水產品,魚肝、雞肝含錳量比其肉多。一般葷素混雜的膳食,每日可供給5毫克錳,基本可以滿足需要。偏食精米、白面、肉多、乳多錳的含量低。當正常人出現體重減輕、性功能低下、頭髮早白可懷疑錳攝入不足。
豐富來源:糙米、米糠、香料、核桃和麥芽等。
良好來源:乾菜豆、花生、土豆、大豆粉、向日葵籽、小麥粉和全穀粒(大麥和高梁等)。
一般來源:啤酒酵母、肝、大多數水果(水果食品)蔬菜(蔬菜食品)與紅茶等。
微量來源:脂肪、油(油食品)、魚、蛋、肉、奶、家禽和糖。
中毒防治
中毒表現
起病緩慢,發病工齡一般5-10年,也有工作20年以上無發病者,這可能與個體敏感有關,早期輕度表現有精神差、失眠、頭昏、頭痛、無力、四肢酸痛、記憶力減退等症狀,有的人易激動、話多、好哭等情緒改變,常有食慾不好、噁心、流涎、上腹不適、性慾減退或陽萎、多汗等,四肢有時麻木、疼痛、兩腿沉重無力。
防治
急性錳中毒
急性錳中毒(manganesepoisoning)可因口服高錳酸鉀或吸入高濃度氧化錳煙霧引起急性腐蝕性胃腸炎或刺激性支氣管炎、肺炎。急性口服高錳酸鉀中毒應立即用溫水洗胃,口服牛奶和氫氧化鋁凝膠。錳煙霧引起的“金屬煙熱”可對症處理。
慢性錳中毒
慢性錳中毒的驅錳治療可用依地酸鈣鈉、促排靈或二巰丁二鈉。用對氨基水楊酸鈉(PAS)可治療錳中毒,可使尿錳排出量為治療前1.5~16.4倍。口服劑量每次2~3g,每日3~4次,3~4周為一療程。靜脈用藥,PAS6g加入5%葡萄糖溶液500ml,每日1次,連續3天,停藥4天為一療程;4~5療程後症狀有好轉。出現震顫麻痹綜合徵可用左鏇多巴和安坦等藥物。
職業性錳中毒職業性錳中毒是由於長期吸入含錳深度較高的錳煙及錳塵而致,慢性錳中毒是職業錳中毒的主要類型。多見於錳鐵冶煉、電焊條的製造與電焊作業以及錳礦石的開採、粉碎或乾電池的生產等作業的工人。
如被確診為慢性錳中毒,應脫離錳作業,到醫院進行驅錳治療,驅錳藥有依地酸鈣、二巰基丁二酸鈉,神經衰弱症狀用中藥調節。
礦山開採、爆破、粉碎、篩選等過程用濕式作業,如水風鑽進行鑽孔、水封爆破、噴霧降塵減少粉塵飛揚。車間採取機械通風或自然通風,減少空缺陷中錳塵濃度,焊劑、焊條、蓄電池生產過程中拌料、過篩等,採取密閉和吸塵裝置,避免錳塵飛揚。加強個人防護,載濾膜口罩,飯前注意清洗,預防性體檢,早發現早治療。
學科聯繫
精神科
錳--和精神科關係最密切的金屬元素生理功能
1.可促進骨骼的生長發育。
2.保護細胞中線粒體的完整。
3.保持正常的腦功能。
4.維持正常的糖代謝和脂肪代謝。
5.可改善機體的造血功能。
影響健康
錳缺乏症狀可影響生殖能力,有可能使後代先天性畸形,骨和軟骨的形成不正常及葡萄糖耐量受損。另外,錳的缺乏可引起神經衰弱綜合症,影響智力發育。錳缺乏還將導致胰島素合成和分泌的降低,影響糖代謝。
食品攝取
錳的安全和足夠的每日攝入量如下表所示:
| 組 別 | 年齡(歲) | 錳(毫克) |
| 嬰 兒 | 0--0.5 | 0.5--0.7 |
| 0.5--1.0 | 0.7--1.0 | |
| 兒童和青少年 | 1--3 | 1.0--1.5 |
| 4--6 | 1.5--2.0 | |
| 7--10 | 2.0--3.0 | |
| 11以上 | 2.5--5.0 | |
| 成 人 | 18以上 | 2.5--5.0 |
營養學
代謝吸收全部小腸都能吸收錳。錳的吸收是一種迅速的可飽和過程,很可能是通過一種高親和性、低容量的主動運輸系統和一個不飽和的簡單擴散作用完成的。錳的吸收機制有可能包括兩個步驟,首先是從腸腔攝取,然後是跨過黏膜細胞輸送,兩個動力過程同時進行。在吸收過程中錳、鐵與鈷競爭相同的吸收部位,三者中任何一個數量高都會抑制另外兩個的吸收。錳幾乎完全經腸道排泄,僅有微量經尿排泄。吸收的錳經腸道的排泄非常快。
生理功能
錳在體內一部分作為金屬酶的組成成分,一部分作為酶的激活劑起作用。
生理需要
成年人的錳的適宜攝入量為3.5mg/d,最高可耐受攝入量為10mg/d。
過量表現
有人報告在肝功能受損、膽道不通暢或兼有兩者的病人中發現錳中毒,病人的腦MRI檢查呈明顯異常,中毒減輕後此種異常亦隨之改善。此外,關於口服毒性問題雖然還沒有肯定的結論,但已經有一些報告提示這一問題值得充分重視與研究。例如,有人曾發現神經系統功能障礙者腦中錳濃度高於正常;有暴力行為的人發現錳高於正常。
錳缺乏症
有人提出,錳缺乏可能是人類的一個潛在的營養問題。錳缺乏還可能與某些疾病有關。有人曾報告,在骨質疏鬆、糖尿病、動脈粥樣硬化、癲癇、創傷癒合不良的患者中存在膳食錳攝入少,血錳、組織錳低的問題。
中國乃至世界錳礦儲量最大的地方在廣西的大新縣下雷鎮。
植物作用
植物主要吸收錳離子(Mn)。Mn是細胞中許多酶(如脫氫酶、脫羧酶、激酶、氧化酶和過氧化物酶)的活化劑,尤其是影響糖酵解和三羧酸循環。錳使光合中水裂解為氧。缺錳時,葉脈間缺綠,伴隨小壞死點的產生。缺綠會在嫩葉中或老葉中出現,依植物種類和生長速率決定。生命元素
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
元素性質
| 為了方便閱讀者查閱元素周期表中各元素符號的性質及特點,比較系統的歸納和總結各元素的套用價值及注意事項,從而為需要相關知識的人們形成知識的鏈條,本次主要是對有些元素的內容進行補充及完善。 |

