基本資料
 溴
溴折射率:是海水中重要的非金屬元素.地球上99%的溴元素以BR-的形式存在於海水中,所以人們也把溴稱為“海洋元素”
原子化焓:kJ/mol@25℃
111.7
熱容:J/(mol·K)
75.69
導熱係數:W/(m·K)
0.122
熔化熱:(千焦/摩爾)
5.286
汽化熱:(千焦/摩爾)
15.438
 溴
溴25.6
元素在宇宙中的含量:(ppm)
0.007
元素在海水中的含量:(ppm)
65
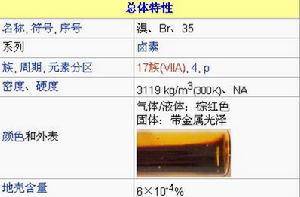
相對原子質量:79.90
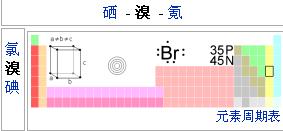
原子序數:35
質子數:35
中子數:45
摩爾質量:80
所屬周期:4
所屬族數:VIIA
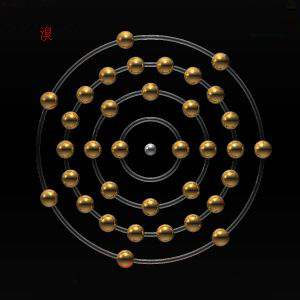
電子層排布:2-8-18-7
氧化態:Main Br-1,Br+5 Other Br+1,Br+3,Br+4,Br+7
聲音在其中的傳播速率:(m/S)
 溴
溴晶胞參數:a=672.65pm b=464.51pm c=870.23pm α=90° β=90°γ=90°
化學鍵能:(kJ/mol)
Br-H366
Br-C286
Br-O234
Br-F285
Br-Br193
Br-B410
Br-Si310
Br-P264
電離能
 溴
溴晶體結構:晶胞為正交晶胞。
常見化合價:-1、+5
單質:溴
單質化學符號:Br2
顏色和狀態:棕紅色易揮發有強烈刺激性臭味的液體
密度:3.119g/cm3
熔點:-7.2℃
沸點:58.76℃
發現人:巴拉爾
發現年代:1824年
化學性質
醛與溴的反應
在鹼的催化下,由於羰基的作用,醛的“阿爾法碳上的氫原子”變得異常活潑而被溴取代,生成阿爾法溴代醛和溴化氫!而且往往a-氫趨向於全部被取代。例如,CH3CHO+Br2=Br-CH2-CHO+HBr.
反應機理:
1,鹼和a-氫結合生成碳負離子,是一個慢過程,反應速度與溴的濃度無關;
2,生成的烯醇負離子很快與Br2反應,得到a-溴代醛。
重複以上過程,可以得到二溴代醛,三溴代醛(假如是乙醛的話有三個a-氫原子)。
3,得到的a-溴代產物由於溴的強吸電子效應,使羰基碳原子正電性大大加強,在鹼性條件下,C-C鍵容易斷裂,生成溴仿和羧酸鹽。
Br3-C-CHO+H2O=CBr3+HCOOH(與催化劑鹼中的金屬離子結合成甲酸鹽)。
在酸性條件下,溴化反應的速度與醛的濃度有關,反應的本質是溴與烯醇式C=C的親電加成。與鹼崔不同,酸催條件下可以使溴化反應停留在一溴代醛階段。
物理性質
溴是唯一在室溫下是液態的非金屬元素,並且是周期表上在室溫或接近室溫下為液體的六個元素之一。溴的熔點是-7.2°C,而沸點是58.8°C。元素單質的形式是雙原子分子:Br2。它是黏稠的,可流動的,紅棕色的液體,並在標準溫度和壓力下容易揮發,形成紅色的蒸氣(顏色近似於二氧化氮)並且有一股與氯氣相似的惡臭。溴是一種鹵素,它的活性小於氯但大於碘。溴微溶於水,但對二硫化碳,有機醇類(像甲醇)與有機酸的溶解度佳。它很容易與其他原子鍵結並有強烈的漂白作用。溴像氯一樣,也有用在游泳池的維護。一些特定的溴化合物被認為是有可能破壞臭氧層的或是具有生物累積性的。所以許多工業用的溴化合物不再被生產,被限制,或逐漸的淘汰。蒙特婁公約提到了一些有機溴化物是需要被逐漸淘汰的。
溴是一種強氧化劑。它會和金屬和大部分有機化合物產生激烈的反應,若有水參與則反應更加劇烈,溴和金屬反應會產生金屬溴鹽及次溴酸鹽(有水參與時),和有機化合物則可能產生磷光或螢光化合物。
性狀:深紅棕色發煙揮發性液體。有刺激性氣味,其煙霧能強烈地刺激眼睛和呼吸道。在空氣中迅速揮發。易溶於乙醇、乙醚、氯仿、二硫化碳、四氯化碳、濃鹽酸和溴化物水溶液,微溶於水。
對大多數金屬和有機物組織均有侵蝕作用,甚至包括鉑和鈀。與鋁、鉀等作用發生燃燒和爆炸。它是ⅦA族(鹵族元素)的第三號元素。
折光率:1.664
儲存:密封陰涼保存。
分子式:Br2
CAS號:7726-95-6[1]
顏色和狀態:深棕紅色,有強烈刺激性臭味的液體
密度:3.119g/cm3
熔點:-7.2℃
沸點:58.76℃
晶體結構:晶胞為正交晶胞。
常見化合價:-1、0、+5
折射率:(gas)1.001132
原子化焓:111.7kJ/mol(25℃)
熱容:75.69J/(mol·K)
導熱係數:0.122W/(m·K)
熔化熱:5286(千焦/摩爾)
汽化熱:15.438(千焦/摩爾)
原子體積:25.6(立方厘米/摩爾)
元素在宇宙中的含量:0.007(ppm)
元素在海水中的含量:65(ppm)
地殼中含量:0.37(ppm)
相對原子質量:79.90
原子序數:35
質子數:35
中子數:45
原子核虧損質量:0.7602u
摩爾質量:80g/mol
所屬周期:4
電子層排布:2-8-18-7
外層電子排布為:4s24p5
電子層:K-L-M-N
核電荷數:35
氧化態:
MainBr-1,Br+5
OtherBr+1,Br+3,Br+4,Br+7
聲音在其中的傳播速率:206(m/S)
晶胞參數:
a=672.65pm
b=464.51pm
c=870.23pm
α=90°
β=90°
γ=90°
化學鍵能:(kJ/mol)
Br-H366
Br-C286
Br-O234
Br-F285
Br-Br193
Br-B410
Br-Si310
Br-P264
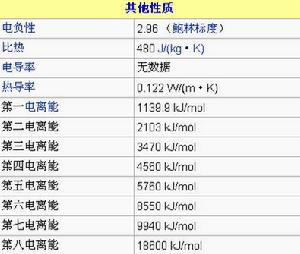
電離能(kJ/mol)
M-M+1139.9
M+-M2+2104
M2+-M3+3500
M3+-M4+4560
M4+-M5+5760
M5+-M6+8550
M6+-M7+9940
M7+-M8+18600
M8+-M9+23900
M9+-M10+28100
第一電離能11.814eV
化合物
一般指含溴為-1氧化態的二元化合物。包括金屬溴化物、非金屬溴化物以及溴化銨等。鹼金屬、鹼土金屬溴化物以及溴化銨易溶於水。難溶溴化物與難溶氯化物相似,但前者的溶解度通常小於相應的氯化物。溴化氫的水溶液稱為氫溴酸,氫溴酸是一種強酸。也存在一些屬於溴化物的鹵素互化物,如溴化碘(IBr)。鹼金屬和鹼土金屬的溴化物可由相應的碳酸鹽或氫氧化物與氫溴酸作用製得。如:溴化錳、溴化鋇、溴化銅、溴化鎂、溴化鉈、溴化汞、溴化氯、溴化苄等等。
溴化氫
化學式:HBr
性質:無色有刺激性臭味氣體。有毒,易溶於水,水溶液稱為氫溴酸。易被液化。
氫溴酸是強酸,暴露在空氣中或在光的作用下,顏色逐漸變深。
用途:用於製藥,亦作催化劑。
製法:a)由氫(H)和溴(Br2)直接化合。
b)由溴化鈉(NaBr)與稀硫酸(H2SO4)作用。
c)由三溴化磷(PBr3)水解製得。
與有機物反應
 溴
溴溴化鉀
化學式:KBr
性質:白色具有潮解性的晶體或粉末。溶於水。
用途:用作神經鎮靜劑,並用於攝影溴化紙等。
製法:a)由碳酸鉀(K2CO3)溶液加入溴化鐵(FeBr3)溶液,將上層清夜蒸髮結晶而製得。
b)將溴蒸汽(Br2)通入氫氧化鉀(KOH)製得。
溴化物,其代表藥物為溴化鉀(或鈉)。溴化物的主要作用為加強大腦皮質的抑制過程,使其更加集中,從而調節失去平衡狀態的高級神經活動,使之恢復正常。
高血壓浮腫患者不應服用溴化物;癲癇患者不宜套用溴化銨;嚴重肺功能不全、支氣管哮喘及顱腦損傷所致的呼吸中樞抑制的患者應避免使用催眠藥。肝、腎功能不全者慎用鎮靜催眠藥。
2-硝基溴苯
健康危害
侵入途徑:吸入、食入、經皮吸收。
健康危害:吸入、口服或經皮膚吸收後對身體有害。對眼睛和皮膚有刺激作用。經皮膚吸收迅速,吸收後引起高鐵血紅蛋白血症,出現紫紺。
毒理學資料及環境行為
危險特性:遇明火、高熱可燃。與強氧化劑可發生反應。受高熱分解放出有毒的氣體。
燃燒(分解)產物:一氧化碳、二氧化碳、氧化氮、溴化氫。
泄漏應急處理
隔離泄漏污染區,周圍設警告標誌,建議應急處理人員好防毒面具,穿化學防護服。不要直接接觸泄漏物,用潔清的鏟子收集於乾燥有蓋的容器中,運至廢物處理場所。如大量泄漏,收集回收或無害處理後廢棄。
發現過程
 溴
溴元素來源:鹽滷和海水是提取溴的主要來源。從製鹽工業的廢鹽汁直接電解可得。
元素用途:主要用於制溴化物、氫溴酸、藥物、染料、煙燻劑等。
元素輔助資料:溴在自然界中和其他鹵素一樣,沒有單質狀態存在。它的化合物常常和氯的化合物混雜在一起,只是數量少得多,在一些礦泉水、鹽湖水和海水中含有溴。
 溴原子
溴原子事實上,在巴拉爾發現溴的前幾年,有人曾把一瓶取自德國克魯茲拉赫鹽泉的紅棕色樣品交給化學家李比希鑑定,李比希並沒有進行細緻的研究,就斷定它是“氯化碘”,幾年後,李比希得知溴的發現之時,立刻意識到自己的錯誤,把那瓶液體放進一個柜子,並在柜子上寫上“恥辱櫃”一警示自己,此事成為化學史上的一樁趣聞。
物質用途
 溴的利用
溴的利用溴是暗紅色的液體,密度是水的兩倍,它在零下七度時就會凝結成固體,在五十九度時又會變成氣態。溴在大自然中的含量並不多,在地殼中的含量只有十萬分之一左右,而且沒有形成集中的礦床。海水中大約含有十萬分之六的溴,所以人們都是從海水中提取溴。然而,人們不是直接從海水中提取,而是在曬鹽場或制鹼工業的廢液中提取。只要往它們裡面通進氯氣,就能產生游離態的溴。
溴最出名的地方是它具有一種強烈的窒息性的惡臭。它還很容易揮發,形成紅棕色的蒸氣,有很大的毒性,它能刺激人的眼黏膜,使人不住地流淚。它的這種特性很煩人,但軍事科學家卻很喜歡,他們把溴裝在空炮殼裡就製成了催淚彈。喜歡看新聞聯播的小朋友會知道,當人們為爭取自由而遊行示威時,警察為了驅散集合起來的人群,經常發射一些催淚彈,它不會對人體造成很大危害,但可以嗆得人不住地咳嗽和流淚。
在保護溴時,為了防止溴的揮發,通常要在盛溴的容器中加進一些硫酸。因為溴的密度大,所以硫酸就像油浮在水面上一樣浮在溴上面。在醫學上,溴是一種貴重的製藥原料。說它貴重,不僅是因為大量的高級藥物都要由它來製造,就連一般的消毒藥也離不了它。大家熟悉的紅藥水,就是溴和汞的一種有機化合物。很多藥品,例如治血蟲病的海群生,治療鉤蟲病的一溴二酚,抗菌藥物金黴素等,都離不開溴。
 溴的利用
溴的利用現在,很多家庭都有小汽車或摩托車,出門辦事很方便,但它們每天都要燒掉很多汽油,有沒有一種省油的辦法呢?這時溴也能幫人們的忙。人們可以把它製成二溴乙烯,把二溴乙烯加入汽油中,就可以使汽油的消耗降低三分之一。溴的最重要的化合物,就算是溴化銀了。溴化銀有一個奇妙的特性——對光很敏感,稍微受到光的刺激,它就會分解。人們把它和阿拉伯樹膠製成乳劑塗在膠片上,就製成了“溴膠於片”。平常用的照相膠捲、照像底片、印相紙,幾乎都塗有一層溴化銀。現在,攝影行業消耗著大量的溴化銀。在1962年,全世界溴的化合物的產量已近十萬噸,其中有將近九萬噸用於攝影。
現在,人們在溴化銀中加入了許多其他物質,大大增強了膠片的質量,已經把曝光的時間縮短到了十萬分之一秒以至百萬分之一秒,拍下正在飛行中的子彈和火箭;人們還能在菜油燈或者火柴那樣微弱的光線下,拍出清晰的照片。溴和鎢的化合物還能用來製造新光源。大家知道,平常在廣場中照明用的燈是碘鎢燈。在高溫時,碘鎢燈中碘的蒸氣是紅色的,會吸收一部分光,這就影響了光效率。而溴蒸氣在高溫時是無色的,所以溴鎢燈非常明亮,它的體積也很小,所以目前,我國的電影攝像、舞台照明已普遍使用溴鎢燈。
物質中毒
預防溴中毒的辦法
 溴
溴溴是一種對黏膜有強烈刺激性和腐蝕性的物質,組織損害程度一般較氯明顯。吸入低濃度溴後可引起咳嗽、胸悶、黏膜分泌物增加,並有頭痛、頭暈、全身不適等,部分人可引起胃腸道症狀;吸入較高濃度後,鼻咽部和口腔黏膜可被染色,口中呼氣有特殊的臭味,有流淚、怕光、劇咳、嘶啞、聲門水腫甚至產生窒息,部分患者可發生過敏性皮炎,接觸高濃度溴可造成皮膚重度灼傷。長期吸入溴,可有蓄積性,除表現黏膜刺激症狀外,還伴有神經衰弱綜合徵等。溴氣的預防,主要應做好生產設備及管道密閉,加強局部通風,注意個人防護。
溴中毒治療
一次誤服大量溴化物者速飲高滲鹽水並探咽導吐,隨即以等滲鹽水洗胃,其後給予硫酸鈉導瀉。因溴離子在體內分布與氯離子相同,且可互相替代,二者經由腎臟排泄甚少區別,用氯化物後,氯離子排出增加,溴離子相應地增加排出,故對中毒病兒,給服適量氯化銨或氯化鈉(食鹽),對原有心臟病或心衰水腫的患兒,不宜套用大量氯化鈉,可用氯化銨代替。小兒每日用量為75mg/kg,分4次內服(開始可每小時內服1次),直至血內溴化物降至4.85mmol/L(50mg/dl)以下時停用同時給飲大量液,體重症病人可用生理鹽水靜脈滴注(約2500ml/m2)或加入適量葡萄糖溶液並可酌用甘露醇及利尿劑,加速毒物由尿排泄,因氯化物入量過多,則從組織中游離出來的溴離子來不及由腎排出,致使血清滇的濃度暫時性升高,加重病情,嚴重中毒可用透析療法其他為對症處理。
自然存在形式及製備
溴的雙原子分子Br2不會自然存在,溴主要是以溴鹽的形式散布在地殼中。由過濾法,溴鹽在海水裡的含量約65ppm,它在海里的濃度比氯小。溴可以在溴含量豐富的鹵井與死海(接近50000ppm)中商業開採。一年(2007)有接近556,000公噸(價值約25億美金)的溴被製造,其中最主要的生產國是美國,以色列與中國。溴的生產量自1960年代以來已經成長了六倍,美國溴含量最多的方在哥倫比亞縣與猶尼昂縣。中國的溴來源位於山東省,而以色列的溴則源於死海的水。使用氯氣來處理富含溴的滷水,在過程中,溴離子被氯氣所氧化而形成溴分子。由於溴的商業運用以及很長的保存時間,人們不會刻意的去製備它。但小量的溴可以經由固態溴化鈉與濃硫酸(H2SO4)製備。反應的第一步是製造氣態的溴化氫(HBr),但於此反應條件下,部分的溴化氫會被進一步硫酸氧化形成溴分子(Br2)與二氧化硫(SO2)。
NaBr(s)+H2SO4(aq)→HBr(aq)+NaHSO4(aq)2HBr(aq)+H2SO4(aq)→Br2(g)+SO2(g)+2H2O(l)使用相似的化合物,如使用稀鹽酸與次氯酸鈉也是可以的。最重要的是,該酸的陰離子(以上述的例子,硫酸根與氯離子)的電負度比溴還大,使取代反應能夠發生。
同位素
溴有兩個穩定的同位素:Br(50.69%)及Br(49.31%)。其他至少有23种放射性同位素是已被發現可以存在的。不少的溴同位素是核分裂的產物。有幾種來自於核分裂產物的大原子量的溴同位素會產生延遲性的中子衰變。所有的放射性溴同位素的半衰期相對來講是比較短的,半衰期最長的是一個中子數不足的同位素半衰期為2.376天。半衰期最長的豐中子同位素的半衰期為1.47天。一些溴的同位素有亞穩定的同質異能素。穩定的Br有一個具放射性的同質異能素,半衰期4.86秒,它最終衰變成穩定的基態。
套用領域
溴可用於製備有機溴化物。溴可用於製備顏料與化學中間體。溴與氯配合使用可用於水的處理與殺菌。
做氧化劑。有機化合物的溴化劑。乙烯和重碳氫化合物的吸收劑。水的消毒劑。漂白絲綢纖維。製藥。照相。染料製造。
由於其單質活潑的性質,在自然界中很難找到單質溴。最常見的形式是溴化物和溴酸鹽。海藻等水生植物中也有溴的存在,最早溴的發現就是從海藻的浸取液中得到的。
向海水中通氯氣,是比較通用的得到溴和碘的工業途徑。
溴的化合物用途也是十分廣泛的,溴化銀被用作照相中的感光劑。使用老式相機時,當你“咔嚓”按下快門的時候,相片上的部分溴化銀就分解出銀,從而得到我們所說的底片。所以很有發展前景。溴在有機合成中也是很有用的一種元素。在高中的時候我們很多人就做過乙烯使溴水褪色的實驗,這實際上就代表了一類重要的反應。在製藥方面,有很多藥裡面也是有溴的。滅火器中也有溴,我們平時看到的諸如“1211”滅火器,就是分子裡面有一個溴原子的多鹵代烷烴,不僅能撲滅普通火險,在泡沫滅火器無法發揮作用的時候,例如油火,它也能撲滅火險。
醫院裡曾經使用的鎮靜劑,有一類就是用溴的化合物製成的,如溴化鉀、溴化鈉、溴化銨等,通常用以配成“三溴片”,可治療神精衰弱和歇斯底里症,但是三溴片已經被更好的藥品(巴比妥類)所取代了。又如大家熟悉的紅藥水,也是溴與汞的化合物汞溴紅。此外,青黴素等抗菌素生產也需要溴,溴還是製造農業殺蟲劑的原料。溴化銀是一種重要的感光材料,被用於製作膠捲和相紙等。
溴在地殼中含量只有0.001%,而且沒有集中形成礦層,無法開採;而海洋中溴的濃度雖然僅有0.0067%,但它的儲量卻占地球上溴的總儲量的99%,這樣,人們所需求的溴就只能取自海洋了,這也是溴被稱為“海洋元素”的原因所在。溴在海洋中,大多是以可溶的化合物形成如溴化鈉、溴化鉀等而存在。
從海水中提取溴,首先要使溴從化合物中脫離出來,變成溴單質。為此,可以往海水中通氯氣,讓氯置換溴,但這時產生的溴單質仍然溶解在海水中。這時可以用蒸餾法和空氣吹出法,再經過幾道工序,就能得到液溴。用濃縮鹽滷提取溴,比直接用海水要好。在海水淡化工廠和使用海水冷卻的核電站,同時進行提取溴的生產,經濟上會更為合算。一個日產10萬噸的淡化水廠,每天要處理15萬噸海水,可得到10萬噸淡水和5萬噸滷水。用這些滷水可提煉10噸溴。
世界上有很多國家都在進行”海水提溴“。美國年產溴約13萬噸,日本年產溴約1萬噸。中國一直是從鹽化工尾料中提以溴,年產僅3000-4000噸,遠遠滿足不了需要,每年都需要進口溴。因此,中國正在大力開展海水提溴的研究和開發工作。
溴的用途很廣,但也是有毒有害物質,所以一些農藥和防爆劑要控制使用。溴代甲烷對大氣臭氧層可能有一定的影響,這一點已引起科學家們的關注。
許多種的有機溴化物在工業上有其套用,其中一部份是由溴製備而來,另一部份則是由溴化氫製備而來。而溴化氫則是以在溴中燃燒氫來取得。
加成反應是製備1,2-二溴乙烷的過程,而1,2-二溴乙烷是有機溴化物中被製造的量最多的。
C2H4+Br2→CH2BrCH2Br
阻燃物
含溴阻燃劑的重要性與日俱增,當燃燒發生時,阻燃劑會生成氫溴酸,它會干擾在火焰當中所進行的氧化連鎖反應。高活性的氫、氧與氫氧根自由基會與溴化氫反應成活性沒那么強的溴自由基。含溴的化合物可以藉由在聚合過程中加入一些被溴化的單體或在聚合後加入含溴化合物的方法加入聚合物中。添加四溴雙酚A可以製造聚酯與環氧樹脂,用於印刷電路板(PCB)的環氧樹脂通常都是由阻燃劑製成的,並且在產品縮寫中以FR來表示。(如FR-4與FR-2)溴乙烯可以用來製造聚乙烯、聚氯乙烯與聚丙烯。十溴二苯醚可以添加在已完成的聚合物中。
汽油添加劑
1,2-二溴乙烷是添加在含鉛汽油中的一種汽油添加劑,它藉由產生揮發性的溴化鉛來移除引擎中的鉛,此類用法在美國占了1966年全部溴用量的77%,但這種用途在1970年代因為會污染環境而被禁止了。此化合物也曾被當作殺蟲用的熏劑,但此種套用也一樣的被禁止了。
殺蟲劑
溴甲烷曾被廣泛的用做煙薰土地用的農藥,蒙特婁公約決定到2005年逐漸淘汰這種會破壞臭氧層的化合物。在1991年,估計有35,000公噸的此化合物被用來對付線蟲動物、真菌、雜草還有一些土壤的問題。
其他用途
鈣、鈉與鋅的溴化物在溴的市場中占有一席之地,這些鹽類在水裡產生稠密的化合物,可以用來做鑽井液,有時也被稱做clearbrinefluids。
溴也可以用來生產含溴植物油,含溴植物油在許多橘子口味的軟性飲料中當作乳劑。在此化合物於1940年代被發現後,它被廣泛地使用,直到在1970年代中期,英國與美國限制了它的使用並且研發出了替代用的乳劑。但在1997年美國的軟性飲料仍然可以含有含溴植物油。
Tralomethrin
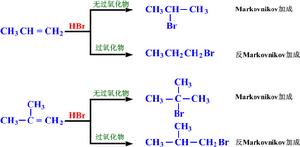
某些染料、農業化學藥品與藥品是有機溴化合物。1-溴-3-氯丙烷、1-溴乙基苯與1-溴化烷是利用烯類與溴化氫的反馬氏規則加成來製備的。溴化乙錠(EtBr)在凝膠電泳中當作DNA的染色劑。
高折射率的化合物。
水淨化與消毒用化合物。
溴化鉀被一些攝影業者使用來防止霧(不希望出現的銀的還原)的生成。
溴蒸氣被用於敏化銀版攝影法用的銀版的第二步,該版之後會經過汞蒸氣的處理。溴的角色是加強剛被碘化的銀版的光敏。
生理作用
溴在人體中還未找到已知的功能,但有機溴化合物的確自然存在。海中的有機物是有機溴化合物的主要來源,在1999年有超過1600種化合物被發現。其中最常見的是溴甲烷,海藻估計製造了56,000公噸的此化合物,夏威夷的蘆筍藻所製成的香精油中就含有80%的溴甲烷。一個有名且已被人類長時間使用的有機溴化合物是泰爾紫,這種含溴的紫色物質存在於一種體型中等的掠食性海蝸牛:腹足綱的紫螺蝸牛之中。這種天然的有機溴化合物直到1909年才被保羅·弗里德蘭德(PaulFriedländer)所發現。大部分自然界中的有機溴化合物是由溴化過氧化酶(en:vanadiumbromoperoxidase)所產生的。
元素來源
溴在自然界中和其他鹵素一樣,基本沒有單質狀態存在。它的化合物常常和氯的化合物混雜在一起,但是數量少得多,在一些礦泉水、鹽湖水(如死海)和海水中含有溴。鹽滷和海水是提取溴的主要來源。從製鹽工業的廢鹽汁直接電解可得。整個大洋水體的溴儲量可達100萬億噸。地球上99%的溴元素以Br-的形式存在於海水中,所以人們也把溴稱為“海洋元素“。
根據美國國家地質局2013年1月發布的全球礦產統計數據:2012年全球溴產量為58萬噸,較2011年下降10萬噸,中東地區是全球最主要的溴產區,2012年以色列溴產量為20萬噸,占全球總產量的34.48%;2012年約旦溴產量為20萬噸,產量較2011年下滑33.3%,這是全球溴產量減少的最主要原因。
化合物:一般指含溴為-1氧化態的化合物。包括金屬溴化物、非金屬溴化物以及溴化銨等。鹼金屬、鹼土金屬溴化物以及溴化銨易溶於水。難溶溴化物與難溶氯化物相似,但前者的溶解度通常小於相應的氯化物。溴化氫的水溶液稱為氫溴酸,氫溴酸是一種強酸。也存在一些屬於溴化物的鹵素互化物,如溴化碘(IBr)。鹼金屬和鹼土金屬的溴化物可由相應的碳酸鹽或氫氧化物與氫溴酸作用製得。如:溴化錳、溴化鋇、溴化銅、溴化鎂、溴化鉈、溴化汞等。
製備方法
溴的雙原子分子Br2不會自然存在,溴主要是以溴鹽的形式散布在地殼中。由過濾法,溴鹽在海水裡的含量約65ppm,但它在海里的濃度比氯小。溴可以在溴含量豐富的鹵井與死海(接近50000ppm)中商業開採。
一年(2007)有接近556,000公噸(價值約25億美金)的溴被製造,其中最主要的生產國是美國,以色列與中國。溴的生產量自1960年代以來已經成長了六倍,美國溴含量最多的地方在哥倫比亞縣與猶尼昂縣。中國的溴來源位於山東省,而以色列的溴則源於死海的水。使用氯氣來處理富含溴的滷水,在過程中,溴離子被氯氣所氧化而形成溴分子。
2Br+Cl2→2Cl+Br2
由於溴的商業運用以及很長的保存時間,人們不會刻意的去製備它。但小量的溴可以經由固態溴化鈉與濃硫酸(H2SO4)製備。反應的第一步是製造氣態的溴化氫(HBr),但於此反應條件下,部分的溴化氫會被進一步硫酸氧化形成溴分子(Br2)與二氧化硫(SO2)。
NaBr(s)+H2SO4(aq)→HBr(aq)+NaHSO4(aq)
2HBr(aq)+H2SO4(aq)→Br2(g)+SO2(g)+2H2O
還可以用氫溴酸和過氧化氫反應製備。
2HBr(aq)+H2O2(aq)→2H2O(l)+Br2(g)
使用相似的化合物,如使用稀鹽酸與次氯酸鈉也是可以的。最重要的是,該酸的陰離子(以上述的例子,硫酸根與氯離子)的電負度比溴還大,使取代反應能夠發生。
溴單質(Br2)在自然界不存在,溴主要是以溴化物的形式散布在地殼和海洋中。溴鹽在海水裡的含量約65ppm,溴在海里的濃度比氯小。溴可以在溴含量豐富的鹵井與死海(接近50000ppm)中商業開採。一年(2007)有接近556,000公噸(價值約25億美金)的溴被製造,溴最主要的生產國是美國,以色列與中國。溴的生產量自1960年代以來已經成長了六倍,美國溴含量最多的地方在哥倫比亞與猶尼昂。中國的溴來源位於山東省,而以色列的溴則源於死海的水。使用氯氣來處理富含溴的滷水來製備溴,空氣吹出法是工業上製備溴素的主要方法。由於溴的商業用途和難保存的特點,人們不會一次性的大量的去製備它。實驗室中少量的溴可以經由固態溴化鈉和溴酸鉀混合滴加濃硫酸(H2SO4)並加熱來製備。
實驗室製法:將氫溴酸與過氧化氫混合,溶液就會變為橙紅色(有溴生成),這時將其蒸餾就得到純度很高的液溴。
反應方程式:2HBr+H2O2=Br2+2H2O
反應放熱,要注意控制其溫度。溴可以腐蝕橡膠製品,所以在進行有關溴的實驗時要避免使用膠塞和膠管。
在實驗室里,也可以加熱溴化鉀-溴酸鉀與濃硫酸的混合物並蒸餾來制溴單質。
毒性
元素狀態的溴是有毒且有刺激性的。因為溴是一種氧化劑,它不能與大部分的有機或無機化合物穩定的共存,所以輸送溴時需要謹慎,通常是使用內襯著鉛的鋼製桶子,並以堅固的金屬架支撐。
當某些特定的含溴離子化合物在酸性環境下與高錳酸鉀(KMnO4)混合時,會產生淡棕色的溴霧,它聞起來像是漂白水,並且對黏膜有很強的刺激性。一旦有人暴露於其中,他應該立即移動至有新鮮空氣的地方,如果他出現了某些症狀,那么他將會需要藥物治療。
吸入低濃度溴後可引起咳嗽、胸悶、黏膜分泌物增加,並有頭痛、頭暈、全身不適等,部分人可引起胃腸道症狀;吸入較高濃度後,鼻咽部和口腔黏膜可被染色,口中呼氣有特殊的臭味,有流淚、怕光、劇咳、嘶啞、聲門水腫甚至產生窒息,部分患者可發生過敏性皮炎,接觸高濃度溴可造成皮膚重度灼傷。長期吸入溴,可有蓄積性,除表現黏膜刺激症狀外,還伴有神經衰弱綜合徵等。溴氣的預防,主要應做好生產設備及管道密閉,加強局部通風,注意個人防護。
治療,一次誤服大量溴化物者速飲高滲鹽水並探咽導吐,隨即以等滲鹽水洗胃,其後給予硫酸鈉導瀉。因溴離子在體內分布與氯離子相同,且可互相替代,二者經由腎臟排泄甚少區別,用氯化物後,氯離子排出增加,溴離子相應地增加排出,故對中毒病兒,給服適量氯化銨或氯化鈉(食鹽),對原有心臟病或心衰水腫的患兒,不宜套用大量氯化鈉,可用氯化銨代替。小兒每日用量為75mg/kg,分4次內服(開始可每小時內服1次),直至血內溴化物降至4.85mmol/L(50mg/dl)以下時停用同時給飲大量液,體重症病人可用生理鹽水靜脈滴注(約2500ml/m2)或加入適量葡萄糖溶液並可酌用甘露醇及利尿劑,加速毒物由尿排泄,因氯化物入量過多,則從組織中游離出來的溴離子來不及由腎排出,致使血清滇的濃度暫時性升高,加重病情,嚴重中毒可用透析療法其他為對症處理。
安全措施
泄漏:迅速撤離泄漏污染區人員至安全區,並立即進行隔離,小泄漏時隔離150m,大泄漏時隔離300m,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿防酸鹼工作服。不要直接接觸泄漏物。儘可能切斷泄漏源,防止進入下水道、排洪溝等限制性空間。
小量泄漏:用蘇打或石灰中和吸收。也可以用大量水沖洗,洗水稀釋後放入廢水系統。
大量泄漏:構築圍堤或挖坑收容;用泡沫覆蓋,降低蒸氣災害。噴霧狀水冷卻和稀釋蒸氣。用泵轉移至槽車或專用收集器內,回收或運至廢物處理場所處置。
滅火方法
燃燒性:不燃
滅火劑:霧狀水、氨水、沙土等。
滅火注意事項:消防人員必須佩戴氧氣呼吸器、穿全身防護服。噴水保持容器冷卻,直至滅火結束。用霧狀水趕走泄漏的液體。用氨水從遠處噴射,驅趕溴蒸氣,並使之中和。但對泄漏出來的溴液不可用氨水噴射,以免引起強烈反應,放熱而產生大量劇毒的溴蒸氣。
緊急處理
吸入:迅速脫離現場至新鮮空氣處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:誤服者用水漱口,給飲牛奶或蛋清或純鹼水。就醫。
皮膚接觸:立即脫去被污染衣著,先用水沖洗,然後用1體積(25%)氨水、1體積松節油和10體積(95%)乙醇的混合液塗敷,也可先用苯、甘油等除去溴,然後再用水沖洗。就醫。
眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
實驗室製法:將氫溴酸和過氧化氫混合,溶液就會變為橙紅色(有溴生成),此時將其蒸餾就得到純度很高的液溴。
反應方程式:2HBr+H2O2=Br2+2H2O
反應放熱,要注意控制溫度。溴可以腐蝕橡膠製品,因此在進行有關溴的實驗時要避免使用膠塞和膠管。
在實驗室里,也可以加熱溴化鉀-溴酸鉀和濃硫酸的混合物並蒸餾來制溴單質。
元素周期表
主族元素
類金屬
▪硼(5) ▪矽(14) ▪鍺(32) ▪砷(33) ▪銻(51)
▪碲(52) ▪釙(84)
金屬元素
鹼金屬
▪鋰(3) ▪鈉(11) ▪鉀(19) ▪銣(37) ▪銫(55)
▪鍅(87)
鹼土金屬
▪鈹(4) ▪鎂(12) ▪鈣(20) ▪鍶(38) ▪鋇(56)
▪鐳(88)
其他金屬
▪鋁(13) ▪銦(49) ▪鎵(31) ▪錫(50) ▪鉈(81)
▪鉛(82) ▪鉍(83) ▪Uut(113) ▪Uuq(114) ▪Uup(115)
▪Uuh(116) ▪Uus(117)
非金屬元素
稀有氣體
▪氦(2) ▪氖(10) ▪氬(18) ▪氪(36) ▪氙(54)
▪氡(86) ▪Uuo(118)
鹵族元素
▪氟(9) ▪氯(17) ▪溴(35) ▪碘(53) ▪砹(85)
其他元素
▪氫(1) ▪碳(6) ▪氮(7) ▪氧(8) ▪磷(15)
▪硫(16) ▪硒(34)
副族元素
金屬元素
鑭系
▪鑭(57) ▪鈰(58) ▪鐠(59) ▪釹(60) ▪鉕(61)
▪釤(62) ▪銪(63) ▪釓(64) ▪鋱(65) ▪鏑(66)
▪鈥(67) ▪鉺(68) ▪銩(69) ▪鐿(70) ▪鑥(71)
錒系
▪錒(89) ▪釷(90) ▪鏷(91) ▪鈾(92) ▪鎿(93)
▪鈽(94) ▪鎇(95) ▪鋦(96) ▪錇(97) ▪鐦(98)
▪鑀(99) ▪鐨(100) ▪鍆(101) ▪鍩(102) ▪鐒(103)
過渡金屬
▪鈧(21) ▪鈦(22) ▪釩(23) ▪鉻(24) ▪錳(25)
▪鐵(26) ▪鈷(27) ▪鎳(28) ▪銅(29) ▪鋅(30)
▪釔(39) ▪鋯(40) ▪鈮(41) ▪錢(42) ▪鎝(43)
▪釕(44) ▪銠(45) ▪鈀(46) ▪去(47) ▪鎘(48)
▪鉿(72) ▪鉭(73) ▪鎢(74) ▪錸(75) ▪鋨(76)
▪銥(77) ▪鉑(78) ▪金(79) ▪釒盧(104) ▪釒杜(105)
▪釒喜(106) ▪釒波(107) ▪釒黑(108) ▪釒麥(109) ▪鐽(110)
▪錀(111) ▪鎶(112) ▪汞(80)
生命元素
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||

