發現簡史
繼德國商人波蘭特發現磷、德國化學家孔克爾制出磷後,英國化學家波義耳也獨立制出了磷,他也是最早研究磷性質及化合物的化學家,他在1682年發表的論文《一種觀察到的冷光的新實驗》中寫到“磷在燃燒後生成白煙,白煙與水作用後生成的溶液具有酸性。”其中的白煙正是磷酸酐(五氧化二磷),而與水作用生成的溶液即為磷酸,然而他並未對磷酸進行進一步的研究。
研究磷酸最早的化學家是法國化學家拉瓦錫。1772年,他做這樣的實驗:將磷放在以汞密封的鐘罩里使其燃燒。實驗結果而得出這樣的結論:一定量的磷能燃燒於某容量的空氣中;磷燃燒時生成無水磷的白色粉片,如細雪一般;燃燒後瓶中的空氣約剩原來容量的80%;磷燃燒後較燃燒前約重2.5倍;白色粉片溶於水即成磷酸。拉瓦錫還證明磷酸可用濃硝酸和磷反應製得。
大約過了一百多年,德國化學家李比希做了許多農業化學的實驗,揭開磷和磷酸對植物生命的價值。1840年李比希著的《有機化學在農業和生理學上的作用》中,科學地論證了土壤的肥力問題,並指出磷對植物的作用。同時,他還進一步探究了磷酸及磷酸鹽作為肥料的套用,從此磷酸的生產進入大規模化時代。
物質結構
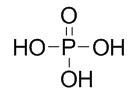
正磷酸是由一個單一的磷氧四面體構成的磷酸。在磷酸分子中P原子是sp雜化的,3個雜化軌道與氧原子間形成3個σ鍵,另一個P—O鍵是由一個從磷到氧的σ配鍵和兩個由氧到磷的d-pπ鍵組成的。σ配鍵是磷原子上的一對孤對電子向氧原子的空軌道配位而形成。d←p配鍵是氧原子的p、p軌道上的兩對孤對電子和磷原子的d、d空軌道重疊而成。由於磷原子3d能級比氧原子的2p能級能量高很多,組成的分子軌道不是很有效的,所以P—O鍵從數目上來看是三重鍵,但從鍵能和鍵長來看是介於單鍵和雙鍵之間。純HPO和它的晶體水合物中都有氫鍵存在,這可能是磷酸濃溶液之所以粘稠的原因。
物理性質
熔點:42℃
沸點:261℃(分解,磷酸受熱逐漸脫水,因此沒有自身的沸點)
市售磷酸是含85%HPO的粘稠狀濃溶液。從濃溶液中結晶,則形成半水合物2HPO·HO(熔點302.3K)。
結(冰)晶點:
磷酸屬於中強酸,其結晶點(冰點)為21℃,當低於此溫度時會析出半水物結(冰)晶。當然,通常磷酸在10℃以上甚至更低溫度下也不結(冰)晶,這是由於磷酸具有過冷的特性,也就是實際上市售的磷酸在低於21℃時會偏離其結(冰)晶點,不會立即結(冰)晶的現象存在。但這樣的低溫只要維持一段時間,在靜止的狀態下,磷酸很容易產生結(冰)晶。
磷酸結晶就像其他液體結晶一樣屬於物理變化而非化學變化。其化學性質不會因結晶而改變,也即磷酸的質量是不會因結晶而受影響的,只要給予溫度熔化或加熱水稀釋溶化,仍可以正常使用。
結晶特性:磷酸濃度高、純度高,結晶性高。根據經驗,當氣溫在4攝氏度上下,濃度大於85%時,其結晶性增大,若不慎混入結(冰)晶磷酸,會造成原本沒有結(冰)晶的磷酸立即感染而結(冰)晶,而且磷酸結(冰)晶異常迅速,直致磷酸儲存容器大部結(冰)晶。磷酸結(冰)晶後,上部磷酸邊稀,下部沉積針狀結(冰)晶體純磷酸。根據經驗,75%磷酸在較低(4℃附近)的溫度下也較難結(冰)晶,因此在較低的氣溫條件下,建議使用75%磷酸比較妥當。
磷酸結(冰)晶好比水結冰,是其本身的物理性能,固有屬性,不能改變,只有妥善保存處理才能防止結(冰)晶。
化學性質
磷酸是三元 中強酸 ,分三步 電離 ,不易揮發,不易分解,有一定 氧化性 。具有 酸的通性 。
pKa:2.12
pKa:7.21
pKa:12.67
(1) 濃磷酸可以和氯化鈉共熱生成氯化氫氣體(與碘化鉀、溴化鈉等也有類似反應),屬於高沸點酸制低沸點酸:
NaCl + HPO(濃) == == NaHPO+ HCl↑
原理:難揮發性酸制 揮發性酸
(2) 磷酸根 離子具有很強的配合能力,能與許多金屬離子生成可溶性的配合物。如Fe 與PO 可以生成無色的可溶性的配合物[Fe(PO)] 和[Fe(HPO)] ,利用這一性質,分析化學上常用PO 掩蔽Fe 離子,濃磷酸能溶解鎢、鋯、矽、矽化鐵等,並與他們形成配合物。
(3) 磷酸受強熱時 脫水,依次生成焦磷酸、三磷酸和多聚的偏磷酸。三磷酸是鏈狀結構,多聚的偏磷酸是環狀結構。
2HPO == == HPO+ HO
3HPO== == HPO+ 2HO
4HPO== == (HPO)+ 4HO
(4)需要特別注意的是, 濃熱的磷酸能腐蝕 二氧化矽,生成雜多酸。但由於反應原理過於複雜,因此中學課程將其簡化為氫氟酸是唯一能與二氧化矽反應的酸。濃熱磷酸還能分解絕大部分礦物,如鉻鐵礦、金紅石、鈦鐵礦等。
酸根離子
鹽類
磷酸鹽 有三類: 正鹽 (含PO),酸式鹽磷酸一氫鹽(含HPO)和磷酸二氫鹽(含HPO)。
三類鹽之間的關係為:
(1) 溶解性
正鹽和一氫鹽:除鉀、鈉、銨等少數鹽外,其餘都難溶於水,但能溶於強酸。
二氫鹽:都易溶於水。
(2)相互轉化
向磷酸中滴加鹼液,隨著鹼液的增多,先後生成磷酸二氫鹽、磷酸一氫鹽、磷酸鹽。
向磷酸鹽溶液中滴加強酸,隨著酸的增多,先後生成磷酸一氫鹽、磷酸二氫鹽、磷酸。
(3) 離子共存 的問題
①HPO 、 HPO 、PO 與H 不能共存。
②HPO 、HPO 與OH 不能共存。
③HPO 與PO 不能共存(化合生成HPO )。
④HPO 與HPO 可共存,HPO 和PO 可共存。
檢驗
磷酸鹽與過量鉬酸銨在濃硝酸溶液中反應有淡黃色磷鉬酸銨晶體析出,這是鑑定磷酸根離子的特徵反應:
PO + 12MoO + 3NH + 24H ==== (NH)[P(MoO)]·6HO↓ + 6HO
製備方法
磷酸的原料主要是磷礦(主要成分為氟磷酸鈣CaF(PO))和以硫酸為主的無機酸。
實驗室製法:實驗室可用強酸+磷酸鹽製備磷酸。
3H + PO ==== HPO (原理:強酸制弱酸)
濕法:工業上常用濃硫酸跟磷酸鈣、磷礦石反應製取磷酸,濾去微溶於水的硫酸鈣沉澱,所得濾液就是磷酸溶液。或讓白磷與硝酸作用,可得到純的磷酸溶液。
3P + 20HNO + 8HO ==== 12HPO+ 20NO↑
熱法:白磷在空氣中燃燒生成五氧化二磷,再經水化製成。注意必須用熱水,因為五氧化二磷會和冷水反應生成劇毒的偏磷酸。
多磷酸的生產:多磷酸的生產主要由正磷酸在適當條件下脫水而成。
重結晶法:將工業磷酸用蒸餾水溶解後,把溶液提純,除去砷和重金屬等雜質,經過濾,使濾液符合食品級要求時,濃縮,製得食用磷酸成品。
安全防護
磷酸無強氧化性,無強腐蝕性,屬於較為安全的酸,屬低毒類,有刺激性。
LD50:1530mg/kg(大鼠經口);2740mg/kg(兔經皮)
刺激性:兔經皮595mg/24小時,嚴重刺激;兔眼119mg嚴重刺激。
接觸時注意防止入眼,防止接觸皮膚,防止入口即可。
遇H發孔劑可燃; 受熱排放有毒磷氧化物煙霧。
磷酸蒸氣能引起鼻黏膜萎縮;對皮膚有相當強的腐蝕作用,可引起皮膚炎症性疾患;能造成全身中毒現象。
若有磷酸蒸氣入眼,應立即用大量生理鹽水沖洗,隨後送醫院救治
空氣中最高容許濃度為1mg/m。生產人員工作時應穿戴防護用具,如工作服、橡皮手套、橡皮或塑膠圍裙、長筒膠靴。注意保護呼吸器官和皮膚,如不慎濺到皮膚,應立即用大量清水沖洗,把磷酸洗淨後,一般可用紅汞溶液或龍膽紫溶液塗抹患處,嚴重時應立即送醫院診治。
套用領域
農業:磷酸是生產重要的磷肥(過磷酸鈣、磷酸二氫鉀等)的原料,也是生產飼料營養劑(磷酸二氫鈣)的原料。
工業:磷酸是一種重要的化工原料,主要作用如下:
處理金屬表面,在金屬表面生成難溶的磷酸鹽薄膜,以保護金屬免受腐蝕。
和硝酸混合作為化學拋光劑,用以提高金屬表面的光潔度。
生產洗滌用品、殺蟲劑的原料磷酸酯。
生產含磷阻燃劑的原料。
1.處理金屬表面,在金屬表面生成難溶的磷酸鹽薄膜,以保護金屬免受腐蝕。
2.和硝酸混合作為化學拋光劑,用以提高金屬表面的光潔度。
3.生產洗滌用品、殺蟲劑的原料磷酸酯。
4.生產含磷阻燃劑的原料。
食品:磷酸是食品添加劑之一,在食品中作為酸味劑、酵母營養劑,可樂中就含有磷酸。磷酸鹽也是重要的食品添加劑,可作為營養增強劑。
醫學:磷酸可用於製取含磷藥物,例如甘油磷酸鈉等。
磷酸主產區
磷酸的生產過程一直受原材料的地域影響,我國磷酸的生產主要集中在雲南、四川、貴州、湖北,而磷酸的精細化套用主要集中在沿海地區,根據 中國磷交所的一份調查報告顯示,我國磷酸生產主要以熱法磷酸為主,提純高純度的磷酸,以滿足工業需求。
生物學影響
飲料添加物
磷酸用在食品添加劑,素來有骨質疏鬆症的疑慮。以往的調查是藉由問卷選填飲用可樂及其他碳酸飲料的頻率,發現飲用碳酸飲料的受試者較易有骨質疏鬆症的問題。研究指出,飲用碳酸飲料者沒有比其他人攝取更多的磷,但身體的鈣磷比卻顯著的降低。《美國臨床營養學雜誌》( American Journal of Clinical Nutrition)中的有項研究在1996年至2001年使用雙倍能量的X光去探測1672位女性及1148位男性的骨密度,發現磷酸確實會降低骨密度,此研究提供了比以往使用問卷調查更有利的證據。
另一項臨床研究指出,磷的攝取會降低骨密度。但此實驗以磷的總攝取量為主,並未明確證明使骨密度降低的主因是磷酸。
但在Heaney及Rafferty使用鈣平衡的方法對於20至40歲的女人一日習慣飲用三杯以上(680 mL)碳酸飲料進行的臨床研究,卻發現含磷酸的碳酸飲料與鈣流失無關。研究比較了水、牛奶以及各種非酒精飲料(兩種含咖啡因,兩種不含咖啡因,兩種含磷酸,兩種含檸檬酸)。他們發現,相較於水,只有牛奶以及另外兩項含有咖啡因的飲品會增加尿液中的鈣含量,而添加有磷酸的咖啡因飲料和含咖啡因的飲料鈣量流失速度差不多,並沒有擴大咖啡因造成流失鈣質的影響。由於研究顯示咖啡因所造成的鈣質流失會逐漸補回來,而磷酸在實驗中又沒有對鈣質流失造成影響。Heaney及Rafferty認為前面實驗受試者骨質疏鬆的原因是受試者飲用碳酸飲料,造成牛奶攝取量的漸少,造成鈣攝取量不足。
咖啡因也是被認為造成骨質疏鬆的元兇之一。
含量分析
GB 3149—92方法
混合指示劑 取0.1%百里酚藍溶液3份(V)和0.1%酚酞溶液2份(V),混合均勻。
1、重量法
亦稱仲裁法,取試樣5g(稱準至0.0002g)放於100ml燒杯中,加10ml鹽酸,蓋上表面皿,煮沸10min,冷卻後轉入500ml容量瓶中,加10ml鹽酸,用水定容後,搖勻。取該溶液50ml放於500ml容量瓶中,再用水定容後,搖勻,是為試樣液。取試樣液20ml放於400ml燒杯中,用水稀釋至100ml,加喹鉬檸酮試液(TS-202)50ml,蓋上表面皿,在電熱板上加熱至杯內溫度達75℃±5℃,保持半分鐘或在水浴中保溫至溶液分層(不能用明火加熱,不論在加試劑或加熱時都不能攪拌混勻,以免形成塊狀物),冷卻過程中轉動3~4次。用預先在175~185℃(或240~260℃)恆重的4號玻璃坩堝過濾,先將上層清液過濾,沉澱用傾瀉法洗滌3~4次,每次約用水20ml,洗液通過坩堝過濾,然後將沉澱轉到玻璃坩堝中,繼續用水洗滌5~6次,置坩堝於175~185℃:烘箱中烘45min(或240~260℃烘箱中烘15min),玻璃坩堝於乾燥器中冷卻至室溫稱重。同測定手續,進行空白試驗。
磷酸含量按下式計算:
HPO(%)=0.04428×(G2-G1)/G×50/500×20/500×100式中G一所取試樣量,g
G2——測定樣品時所得的沉澱量,g;
G1——空白測得的沉澱重量,g;
0.04428——每克磷鉬酸喹啉相當於磷酸的質量,g。
2、容量法
按上述重量法測定手續進行至“冷卻過程中轉動3~4次”,以下操作按下述測定手續進行。用鋪有濾紙、脫脂棉或紙漿的過濾器過濾,先將上層清液過濾,沉澱用傾瀉法洗滌3~4次,每次約用水25~30ml,然後將沉澱轉到過濾器上,繼續用水洗滌至無酸性(取約20ml洗出液,加一滴混合指示劑和1滴0. 25mol/L的氫氧化鈉液,所呈顏色與處理同體積水所呈的顏色相近為止)。將沉澱轉入原燒杯中,加不含二氧化碳的水100ml,攪勻沉澱,約加0.5ml/L氫氧化鈉標準液10ml,充分攪拌至沉澱溶解,加5滴混合指示劑,用0.25mol/L鹽酸標準液滴定,溶液由紫色變為微黃色時為終點。
用同樣測定手續,進行空白試驗。
磷酸含量按下式計算:
HPO(%)=c(V1-VV2)×0.003769/G×50/500×20/500×100
式中c——氫氧化鈉標準溶液濃度,mol/L;
V1——試樣所耗氫氧化鈉標準溶液的體積,ml;
V2——試樣所耗鹽酸標準溶液的體積,ml;
V——在空白試驗中,1m1鹽酸標準溶液相當的氫氧化鈉標準溶液體積,ml;
0.003769——毫摩爾磷酸的質量,g;
G一所取試樣量,g。
本方法平行測定時允許誤差在0~2%以內。
FAO/WHO滴定法 取試樣1.00g放入一具玻塞燒瓶中,加水約100ml,再加百里酚酞試液(TS-248)0.5ml,用1mol/L氫氧化鈉液滴定,每ml相當於HPO0.049g。