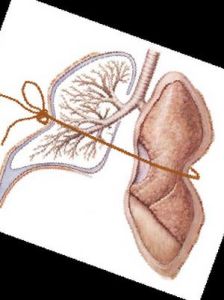
概述
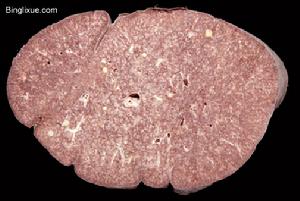 肺橫切片
肺橫切片病因
雖然目前已將之歸入特發性間質性肺炎(ⅡP)範疇,但由於其臨床表現及病理表現與ARDS幾乎一致,而其發病時又無明確病因,所以有人認為它的起發病與病毒急性感染密切相關,只是限於目前的檢測技術尚無法測定病毒而已。病毒與ⅡP的關係一直是該病病因學研究的熱點之一,其中研究最多的是腺病毒和EB病毒。
體症
AIP起病突然、進展迅速、迅速出現呼吸功能衰竭、多需要機械通氣維持、平均存活時間很短,大部分在1~2個月內死亡。AIP的發病無性別差異,文獻中的發病年齡範圍是7~83歲,平均49歲。大多數病人既往體健、發病突然;絕大部分患者在起病初期有類似上呼吸道病毒感染的症狀,可持續1天至幾周,雖經廣泛研究並無病毒感染的證據。半數以上的病人突然發熱、乾咳,繼發感染時可有膿痰;有胸悶、乏力、伴進行性加重的呼吸困難,可有發紺、喘鳴、胸部緊迫或束帶感;很快出現杵狀指(趾)。雙肺底可聞及散在的爆裂音。部分患者可發生自發性氣胸。抗生素治療無效,多於2周至半年內死於急性呼吸衰竭和右心功能衰竭。如早期足量套用糖皮質激素,病情可緩解甚至痊癒。檢查
現在初步認為病毒在ⅡP發生、發展中所起的作用可能有如下3種情況:①由病毒感染的人體細胞所表達的病毒蛋白可以促進慢性炎症和修復過程,如EB病毒的隱性膜蛋白可以提高B-淋巴細胞的Ⅱ類抗原的表達;②病毒的感染可以激活肺泡上皮細胞的Ⅰ型膠原基因;③病毒基因是一種活化因子,它可以與DNA結合或接觸,以調節RNA蛋白轉錄和修改細胞的生物特性。然而遺憾的是,這些研究結果均來自ⅡP的慢性類型;也許是由於病例數偏少的緣由,至今尚未有AIP與病毒關係的研究報告。有研究報導,部分患者肺周邊淋巴細胞、淋巴濾泡及漿細胞中有自身抗體,肺泡壁上有免疫複合物沉積。而諸如血沉,部分病人丙種球蛋白增高,抗核抗體滴度上升,類風濕因子、冷免疫球蛋白、狼瘡細胞陽性,補體水平降低都表明該病可能與炎症免疫過程有關。也有報導稱本病可能具有遺傳因素。AIP的急性肺損傷更傾向於一種大範圍的肺實質性變化-急性呼吸功能衰竭的表現;它與其他ⅡP類型中所見的急性損傷-反覆發生的多灶性損傷迥然不同。這種不同造成了兩者在組織病理和臨床表現上各具特色;並就此推測兩者的發病機制亦有差別。雖然目前的研究已深入到蛋白甚至基因水平,人們已知諸如促炎症因子、抗炎症因子、金屬蛋白酶及抑制因子和凋亡等在ⅡP中的相應作用,但AIP的確切發病機制目前尚不清。病理顯示,肺大體標本呈暗紅色,重量增加,外觀飽滿,質實變硬,觸壓不萎陷。肺切面為暗紅色斑點與灰白色相間,並有交錯分布的灰白纖維組織條索和小灶性瘢痕組織。
 現代醫學設備
現代醫學設備 檢查
檢查診斷
本病並沒有特異性的臨床診斷指標,所以最重要的是想到該病存在的可能。之後應在AIP和ARDS之間作出鑑別,後者往往都有比較明確的誘因,而前者則多難發現。若要明確診斷,就得依賴臨床診斷和肺組織活檢、尤其是開胸肺活檢。絕大部分的特發性間質性肺炎患者為慢性類型,表現為進行性加重的肺部受損,其平均存活期為4年。但有些病人也會在慢性病程的任何階段出現病情的急性加重,而這又往往被誤診為肺部感染。其中的原因尚不清楚。Kondoh曾報導了3例急性加重的ⅡP病例,持續時間為3~20天,於慢性病程發生6~24個月後出現。病情可以定義為:①突然惡化的呼吸困難達數周;②胸片出現新近的瀰漫性肺部浸潤影;③持續惡化的低氧血症(PaO2/FiO2<225);④無感染的依據。病人起病時可表現為流感樣症狀或咳嗽伴發熱;3人均有血白細胞的上升和C-反應蛋白的升高;雖經多種檢測均無感染存在的證據;BALF示中性粒細胞和白蛋白含量的升高;加重後2周所做的開胸肺活檢示無透明膜形成的DAD伴IPF的表現(遺憾的是此前無病理學的記錄)。經激素的治療,3人均病情轉而穩定。Akira也報導了17例類似的病例,其中9例有系統的HRCT和病理資料。他將HRCT的表現分為外周型、多發灶型和瀰漫型肺實質浸潤3種情況,並發現:①全部的外周型病人(6人)和一半的多發灶型病人(3/6)對糖皮質激素治療有反應;②瀰漫型病人全部(5/5)死亡,50%多發灶型病例死亡,而外周型患者則全部存活;③在病理中,多發灶型和瀰漫型肺實質浸潤的病理符合急性DAD,而外周型則為活躍的成纖維細胞灶。在一部分系統性疾病,特別是結締組織病和血管炎中,也可出現與AIP的臨床和病理表現相同的病例。通過對文獻的複習以及從自身的臨床經驗來看,筆者認為,尚不應將這2種類似於AIP的疾病劃入AIP範疇。因為,它們的確切病因尚不清;AIP只見於既往無肺部疾患的病人,而後兩者均已有肺部損傷;這兩大類疾病在對治療的反應和預後上的確存在差異。
實驗室檢查
實驗室檢查不具有特異性;外周血白細胞可增高,少數有嗜酸細胞輕度增高。紅細胞和血紅蛋白因缺氧而繼發增高。血沉多加快,可達60mm/h。血清蛋白電泳示α2或γ球蛋白增高,IgG和IgM常增高,IgA較少增高;血氣分析為I型呼吸衰竭,偶見Ⅱ型。
其他輔助檢查
AIP的影像學表現與ARDS差別不大,或者說它並不具備特異性。在早期,部分患者的胸部平片可以正常;多數則為雙肺中下野散在或廣泛的點片狀、斑片狀陰影,此時與支氣管肺炎不易鑑別。隨著病情的進行性加重,雙肺出現不對稱的瀰漫性網狀、條索狀及斑點狀浸潤性陰影,並逐漸擴展至中上肺野,尤以外帶明顯;但肺尖部病變少見,肺門淋巴結不大;偶見氣胸、胸腔積液及胸膜增厚。胸部CT多為雙肺紋理增粗、結構紊亂、小片狀陰影並可見支氣管擴張征;也有雙側邊緣模糊的毛玻璃樣改變,或為雙側廣泛分布的線狀、網狀、小結節狀甚或實變陰影,偶見細小蜂窩樣影像。Ichikado等總結了14例AIP(3例開胸肺活檢,11例屍檢)的病理結果與HRCT的關係。他首先將肺部的病理表現分為急性滲出、亞急性增殖和慢性纖維化3期,其分別代表如下表現的存在:透明膜、肺泡內的水腫、滲出或出血;Ⅱ型肺泡上皮細胞增生、成纖維細胞在間質及肺泡腔中增殖;大量成纖維細胞和膠原結締組織增殖和肺內蜂窩樣改變。隨後通過HRCT技術,比較病理分期與影像學所見之間的相互關係,他發現:①在滲出期,會有部分殘存的正常肺組織影像接近陰影區[指毛玻璃樣變和(或)實變區]或存在於陰影區之中;不論是何種陰影表現,均不伴有支氣管擴張影像的出現。②在增殖期,毛玻璃樣變和實變區內支氣管擴張影像的出現幾率近乎相同。③在纖維化期,近乎全部肺陰影區均伴有支氣管擴張影像的出現,並發現有1例病人有小蜂窩樣改變。從這一結果的分析中我們可以看出,HRCT對AIP的診斷不具有特異性,影像學的表現也無法做到像病理表現那樣劃界分明;倒是支氣管牽拉性擴張影像的出現預示著滲出期將盡而某種程度的機化業已出現。但無論怎樣,對疑為AIP的患者及時進行HRCT檢查,至少對於指導開胸肺活檢的取樣部位、儘早取得相應的正確診斷和採取適時的治療措施仍是有益的。Akira對AIP和ⅡP急性加重期的CT改變作了比較。他發現:AIP病人從不出現胸膜下玻璃樣變的影像學表現,只有在7天后才會逐漸出現支氣管的牽拉性擴張和蜂窩肺;而在ⅡP的急性加重期,卻可以見到雙側的彌散或多發灶性玻璃樣變和胸膜下的蜂窩樣變同時存在。
治療方案
 現代醫學設備
現代醫學設備併發症
預後與預防
預後:AIP的平均死亡率為78%(60%~100%)。Olson等報導平均存活期為33天。雖然尚無能夠預示存活率的組織病理指征,但有趣的是:存活者多有嚴重的肺實質損害,而死亡者則很少有之。現在ARDS的死亡率因治療手段的不斷改進已降至50%以下;而AIP的死亡率卻一直居高不下。這也促使我們應進一步加強對AIP的研究。
預防:因大量糖皮質激素的套用,預防細菌感染尤為重要。
相關詞條
呼吸內科疾病
| 研究範圍及進展呼吸內科是研究呼吸系統疾病的學科。它是既古老又年輕的學科,說它古老是因為,自從人類認識疾病以來,呼吸系統疾病就一直是危害人類健康的常見病和多發病,八十年代中期的統計資料表明,呼吸系統疾病仍然是導致死亡的主要疾病。在死亡的順序上排列第二。現在我們來認識一下這些可怕的疾病吧? |