概述
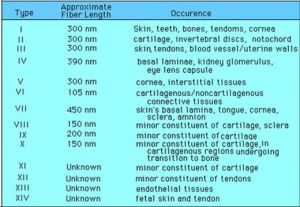 膠原的類型
膠原的類型膠原是動物體內含量最豐富的蛋白質,約占人體蛋白質總量的30%以上。它遍布於體內各種器官和組織,是細胞外基質中的框架結構,可由成纖維細胞、軟骨細胞、成骨細胞及某些上皮細胞合成並分泌到細胞外。
目前已發現的膠原至少有19種,由不同的結構基因編碼,具有不同的化學結構及免疫學特性。Ⅰ、Ⅱ、Ⅲ、Ⅴ及Ⅺ型膠原為有橫紋的纖維形膠原。
各型膠原都是由三條相同或不同的肽鏈形成三股螺鏇,含有三種結構:螺鏇區,非螺鏇區及球形結構域。其中Ⅰ型膠原的結構最為典型。
結構
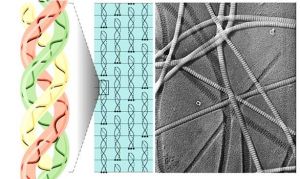 膠原的結構
膠原的結構Ⅰ型膠原的原纖維平行排列成較粗大的束,成為光鏡下可見的膠原纖維,抗張強度超過鋼筋。其三股螺鏇由二條α1(Ⅰ)鏈及一條α2(Ⅰ)鏈構成。每條α鏈約含1050個胺基酸殘基,由重複的Gly-X-Y序列構成。X常為Pro(脯氨酸),Y常為羥脯氨酸或羥賴氨酸殘基。重複的Gly-X-Y序列使α鏈捲曲為左手螺鏇,每圈含3個胺基酸殘基。三股這樣的螺鏇再相互盤繞成右手超螺鏇,即原膠原。
原膠原分子間通過側向共價交聯,相互呈階梯式有序排列聚合成直徑50~200nm、長150nm至數微米的原纖維,在電鏡下可見間隔67nm的橫紋。膠原原纖維中的交聯鍵是由側向相鄰的賴氨酸或羥賴氨酸殘基氧化後所產生的兩個醛基間進行縮合而形成的。
原膠原共價交聯後成為具有抗張強度的不溶性膠原。胚胎及新生兒的膠原因缺乏分子間的交聯而易於抽提。隨年齡增長,交聯日益增多,皮膚、血管及各種組織變得僵硬,成為老化的一個重要特徵。
人α1(Ⅰ)鏈的基因含51個外顯子,因而基因轉錄後的拼接十分複雜。翻譯出的肽鏈稱為前α鏈,其兩端各具有一段不含Gly-X-Y序列的前肽。三條前α鏈的C端前肽借二硫鍵形成鏈間交聯,使三條前α鏈“對齊”排列。然後從C端向N端形成三股螺鏇結構。前肽部分則呈非螺鏇捲曲。帶有前肽的三股螺鏇膠原分子稱為前膠原(procollagen)。膠原變性後不能自然復性重新形成三股螺鏇結構,原因是成熟膠原分子的肽鏈不含前肽,故而不能再進行“對齊”排列。
前α鏈在粗面內質網上合成,並在形成三股螺鏇之前於脯氨酸及賴氨酸殘基上進行羥基化修飾,脯氨酸殘基的羥化反應是在與膜結合的脯氨醯-4羥化酶及脯氨醯-3羥化酶的催化下進行的。維生素C是這兩種酶所必需的輔助因子。維生素C缺乏導致膠原的羥化反應不能充分進行,不能形成正常的膠原原纖維,結果非羥化的前α鏈在細胞內被降解。因而,膳食中缺乏維生素C可導致血管、肌腱、皮膚變脆,易出血,稱為壞血病。