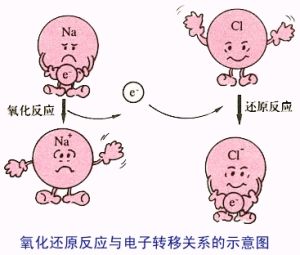
氧化還原反應
氧化還原反應是在反應前後,某種元素的氧化數有變化的化學反應。這種反應可以理解成由兩個半反應構成,即氧化反應和還原反應。
複分解反應都不是氧化還原反應
置換反應都是氧化還原反應
有單質參加的化合反應一定是氧化還原反應
有單質生成的分解反應一定是氧化還原反應
另外要注意,有單質參加反應的化學反應不一定是氧化還原反應,如氧氣生成臭氧
概念
反應的本質是氧化數有變化,即電子有轉移。氧化數升高,即失電子的半反應是氧化反應;氧化數降低,得電子的反應是還原反應。氧化數升高的物質還原對方,自身被氧化,因此叫還原劑,其產物叫氧化產物;氧化數降低的物質氧化對方,自身被還原,因此叫氧化劑,其產物叫還原產物。即:
一般來說,同一反應中還原產物的還原性比還原劑弱,氧化產物的氧化性比氧化劑弱,這就是所謂“強還原劑制弱還原劑,強氧化劑制弱氧化劑”。
肝細胞微粒體記憶體在的還原酶,主要有硝基還原酶和偶氮還原酶,能使硝基化合物和偶氮化合物還原生成胺類。還原反應所需的氫由NADH或NADPH提供。如氯黴素被還原而失效。
凡例
 還原反應
還原反應氫氣與氯氣的化合反應,其總反應式如下:
H2 + Cl2 → 2HCl
我們可以把它寫成兩個半反應的形式:
氧化反應:
H2 → 2H+ + 2e-
還原反應:
Cl2 + 2e- → 2Cl-
 電子-模型圖
電子-模型圖 單質總為0價。第1個半反應中,氫元素從0價被氧化到+1價;同時,在第2個半反應中,氯元素從0價被還原到−1價. (本段中,“價”指氧化數)
兩個半反應加合,電子數削掉:
H2 → 2H+ + 2e-
+ 2e- + Cl2 → 2Cl-
---------------------
H2 + Cl2 → 2H+ + 2Cl-
最後,離子結合,形成氯化氫:
2H+ + 2Cl- → 2HCl
與電化學的關係
每一個氧化還原反應都可以做成一個原電池。其中發生氧化反應的一極為陽極,即外電路的負極;還原反應的一極為陰極,即外電路的正極。兩個電極之間有電勢差(電化學上通常叫電動勢),因此反應可以進行,同時可以用來做功。
名稱來源
氧化反應最早是指金屬或非金屬與氧結合形成氧化物的反應,這類反應中另一種元素的氧化數總是升高。還原反應最早是指金屬從其化合物中被提煉出來的反應,這類反應中金屬的氧化數總是降低。
 還原反應
還原反應再如工業煉鐵的反應:
Fe2O3+3CO=高溫=2Fe+3CO2
這個反應中,三氧化二鐵是氧化劑,而一氧化碳是大家熟悉的還原劑.三氧化二鐵中的氧元素給了一氧化碳,使後者氧元素含量增加變為二氧化碳.鐵由3價變為單質0價(降低,為氧化劑),而碳由2價變為4價(升高,為還原劑)
另外,複分解反應一定不是氧化還原反應.因為複分解反應中各元素的化合價都沒有變化.例如:
Na2CO3+CaCl2=2NaCl+CaCO3(沉澱)
其中鈉元素保持1價,碳酸根保持-2價,氯元素保持-1價,而鈣元素保持2價.
下面是有機反應中介紹的還原反應的定義:
還原反應(Reduction Reaction)
還原反應的概念——化學反應中,使有機物分子中碳原子總的氧化態降低的反應稱為還原反應。如:
分類(還原劑及操作方法):
1.催化氫化反應(催化劑)
2.化學還原反應(化學物質)
3.生物還原反應(微生物發酵或活性酶)
第一節 不飽和烴類的還原
炔、烯和芳香烴均可被還原為飽和烴。對炔、烯的還原廣泛採用催化氫化法。而對芳香烴的還原,除在較劇烈的條件下催化氫化外,通常採用化學還原法。
一、炔、烯的還原
1.多相催化氫化
在催化劑存在下,有機化合物(底物)與氫或其它供氫體發生的還原反應稱為催化氫化(Catalytic Hydroenation)。
分類(催化劑與底物所處的相態):
非均相催化氫化(多相催化氫化和轉移催化氫化)
均相催化氫化
多相催化氫化在醫藥工業的研究和生產中套用很多。主要有以下幾個特點:
①還原範圍廣,反應活性高,速度快
②選擇性好
③反應條件溫和,操作方便
④經濟適用
⑤後處理方便,乾淨無污染。
(1)常用催化劑
①鎳催化劑(Raney Ni、載體鎳、還原鎳和硼化鎳)
②鈀催化劑(氧化鈀、鈀黑和載體鈀)
③鉑催化劑(氧化鉑、鉑黑和載體鉑)。
(2)影響氫化反應速度和選擇性的因素
①作用物的結構。
②作用物的純度。
③催化劑的種類和用量。
④溶劑和介質的酸鹼度。
⑤溫度。
⑥壓力。
⑦接觸時間。
⑧攪拌。
(3)炔烴的氫化
反應分兩個階段:首先氫與炔進行順式加成,生成烯烴;然後進一步氫化,生成烷烴。
(4)烯烴的氫化
烯烴易被氫化成烷烴,催化劑通常為鈀、鉑或鎳。
烯鍵氫化是催化氫化的主要套用,用其它方法很少能完成這類反應。
2.均相催化氫化
均相催化氫化主要用於選擇性還原碳-碳雙鍵。
3.硼氫化反應
硼烷與碳-碳不飽和鍵加成而形成烴基硼烷的反應稱為硼氫化反應。所形成的烴基硼烷加酸水解使碳-硼鍵斷裂而得飽和烴,從而使不飽和鍵還原。
二、芳烴的還原
1.催化氫化法
在乙酸中用鉑作催化劑時,取代基的活性為ArOH>ArNH2>ArH>ArCOOH>ArCH3。不同的催化劑有不同的活性次序,用鉑、釕催化劑可在較低的溫度和壓力下氫化,而鈀則需較高的溫度和壓力。
2.化學還原法—Birch反應
芳香族化合物在液氨中用鈉(鋰或鉀)還原,生成非共軛二烯的反應稱Birch反應。Birch反應歷程為電子轉移類型。
一、還原成醇
醛、酮可由多種方法還原成醇,目前套用最廣泛的是金屬復氫化物還原和催化氫化還原,另外醇鋁還原劑、活潑金屬還原劑、以及其他新試劑也得到較廣泛的套用。
1.金屬復氫化物為還原劑(首選試劑)
特點:
反應條件溫和副反應少
烴基取代的金屬化合物有高度選擇性和較好的立體選擇性
常用的金屬氫化物:
氫化鋁鋰(LiAlH4)、
硼氫化鉀(鈉)[K(Na)BH4]
硫代硼氫化鈉(NaBH2S3)
三仲丁基硼氫化鋰[(CH3CH2CH(CH3))3BHLi]
(1)反應機理 金屬復氫化物具有四氫鋁離子(AlH4-)或四氫硼離子(BH4-)的復鹽結構,具有親核性,可向羰基中帶正電的碳原子進攻,繼而發生氫負離子轉移而進行還原。
(2)試劑的主要性質及反應條件
活性順序:氫化鋁鋰>硼氫化鋰>硼氫化鈉(鉀)
溶劑選擇:
氫化鋁鋰常用無水乙醚或無水四氫呋喃作溶劑,硼氫化鉀(鈉)常選用醇類作為溶劑。
註:
A. 反應時分子中存在的硝基、氰基、亞氨基、雙鍵、鹵素等可不受影響
B. 對α,β-不飽和醛酮的還原,可使用氰基硼氫化鈉或氫化二異丁基鋁,
如:9-硼雙環(3.3.1)-壬烷(9BBN)。
2.醇鋁為還原劑
異丙醇鋁還原羰基化合物時,首先是異丙醇鋁的鋁原子與羰基的氧原子以配位鍵結合,形成六元過渡態,然後生成新的醇-鋁衍生物和丙酮,蒸出丙酮有利於反應完全。
(1)影響因素 本反應為可逆反應。
(2)套用 對分子中含有的烯鍵、炔鍵、硝基、縮醛、腈基及鹵素等可還原基團無影響。
3.催化氫化還原(了解)
二、還原成烴類
常用的方法有:在強酸性條件下用鋅汞齊直接還原為烴(Clemmensen反應);在強鹼性條件下,首先與肼反應成腙,然後分解為烴(Wolff-黃鳴龍反應);催化氫化還原和金屬氫化物還原。
1.Clemmensen還原反應
在酸性條件下,用鋅汞齊或鋅粉還原醛基、酮基為甲基或亞甲基的反應稱Clemmensen反應。常用於芳香脂肪酮的還原,反應易於進行且收率較高。
特點:
(1)底物分子中有羧酸、酯、醯胺等羰基存在時,可不受影響
(2)α-酮酸及其酯類只能將酮基還原成羥基,而對β-或γ-酮酸及其酯類則可將酮基還原為亞甲基
(3)還原不飽和酮時,分子中的孤立雙鍵可不受影響;與羰基共軛的雙鍵被還原;而與酯羰基共軛的雙鍵,則僅僅雙鍵被還原
2.Wolff-黃鳴龍反應
醛、酮在強鹼性條件下,與水合肼縮合成腙,進而放氮分解轉變為甲基或亞甲基的反應稱Wolff-黃鳴龍反應。可用下列通式表示。
適3.催化氫化和金屬復氫化物還原(了解)
三、還原胺化反應
在還原劑存在下,羰基化合物與氨、伯胺或仲胺反應,分別生成伯胺、仲胺或叔胺的反應稱為還原胺化反應。
1. 羰基的還原胺化反應
通過Schiff鹼中間體進行的,首先羰基與胺加成得羥胺,繼之脫水成亞胺,最後還原為胺類化合物。
2. Leuckart反應——在甲酸及其衍生物存在下,羰基化合物與氨、胺的還原胺化反應
羧酸及其衍生物的還原
一、醯鹵的還原——醛
醯鹵在適當的條件下反應,用催化氫化或金屬氫化物選擇性還原為醛,此反應稱Rosenmund反應
催化劑:
鈀催化劑或硫酸鋇為載體的鈀催化劑
金屬氫化物,如:三(叔丁氧基)氫化鋁鋰(LiAl-H[OC(CH3)]3)
二、酯及醯胺的還原
1.還原成醇
(1)金屬氫化物為還原劑(LiAlH4)
羧酸酯還原,可得伯醇
(2)Bouveault-Blance反應
同樣,二元羧酸酯也可用此法還原成二元伯醇。
2.還原成醛 由於醯胺很難用其它方法還原成醛,因而本法更具有合成價值。
如氯化二異丁基鋁AlH(i-C4H9)2可使酯以較好的產率還原成醛,對分子中其它基團無影響。
3.酯的雙分子還原偶聯反應
羧酸酯在惰性溶劑如醚、甲苯、二甲苯中與金屬鈉發生偶聯反應,生成α-羥酮。
利用二元羧酸酯進行分子內的還原偶聯反應,可以有效地合成五元以上的環狀化合物。
4.醯胺的還原
三、腈的還原——胺
1. 催化氫化法
催化氫化還原可在常溫常壓下用鈀或鉑為催化劑,或在加壓下用活性鎳作催化劑,通常其還原產物除伯胺外,還得到大量的仲胺
2. 金屬氫化物為還原劑
氫化鋁鋰(過量)可還原腈成伯胺
乙硼烷(硝基、鹵素等可不受影響)
硼氫化鈉(加入活性鎳、氯化鈀等催化劑)
第四節 含氮化合物的還原
一、硝基化合物的還原
還原硝基化合物常用的方法有活潑金屬還原法、硫化物還原法、催化氫化法、復氫化物還原法以及CO選擇性還原。
1.活潑金屬為還原劑
機理——電子轉移過程。
電子從金屬表面轉移到被還原基團形成負離子,繼而與反應介質水、醇或酸提供的質子結合,從而使不飽和鍵得到還原。
(1)金屬鐵為還原劑 ——含水溶性基團的芳胺
通常將硝基化合物和鐵屑在乙酸中或在少量鹽酸的水中,硝基化合物可順利地還原成胺。在還原過程中-CN、-X、-C=C-的存在可不受影響。
(2)其它金屬為還原劑——Sn和SnCl2、 Zn、鋁、鈦、鎳
2.含硫化合物為還原劑
(1)硫化物為還原劑 (硫化鈉、硫氫化物和多硫化物)
(2)含氧硫化物為還原劑(如連二亞硫酸鈉、亞硫酸鈉、亞硫酸氫鈉)
3.金屬氫化物為還原劑
硝基化合物能被多種金屬氫化物還原成相應的胺。氫化鋁鋰與三氯化鋁的混合物均能有效地還原脂肪族硝基化合物。
4.催化氫化還原(活性鎳、鈀、二氧化鉑、鈀-碳)
5.一氧化碳選擇性還原
二、亞甲胺的還原(亞胺——胺)
1. 催化氫化(鎳、鈀)
2. 金屬氫化物(氫化鋁鋰、硼氫化鈉)
3. 活潑金屬(鐵、鈉)
三、其他含氮化合物的還原
1. 偶氮化合物的還原——伯胺(催化氫化法,活潑金屬法及連二亞硫酸鈉法)
2. 疊氮化合物的還原(催化氫化、金屬氫化物)