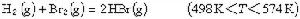基本內容
化學中,反應機理用來描述某一化學變化所經由的全部基元反應。雖然整個化學變化所發生的物質轉變可能很明顯,但為了探明這一過程的反應機理,常常需要實驗來驗證。
機理詳細描述了每一步轉化的過程,包括過渡態的形成,鍵的斷裂和生成,以及各步的相對速率大小,等等。完整的反應機理需要考慮到反應物、催化劑、反應的立體化學、產物以及各物質的用量。
反應機理中各步的順序也是很重要的。有些化學反應看上去是一步反應,但實際上卻經由了多步,例如如下反應:
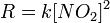 反應機理
反應機理該反應中,實驗測得的速率方程為:
因此,反應可能的反應機理為:
每一步反應都被稱作基元反應,具有特定的速率方程和反應分子數。所有基元反應加和得到的淨反應必須與原反應相同。基元反應分為四類:加成、消除、取代和重排。
總反應的速率方程由反應機理中最慢的一步,也就是速率控制步驟所決定。由於上例中第一步為速控步,是一個雙分子反應,速率方程為。從此很容易便可以求得總反應的速率方程。
1903年,亞瑟·拉普沃斯(Arthur J. Lapworth)通過研究安息香縮合反應,提出了第一個有機反應機理。
參考書目
趙學莊編:《化學反應動力學原理》,上冊,高等教育出版社,北京,1984。