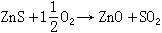還原-氧化反應
正文
有電子得失(有化合價改變)的化學反應。在一個氧化還原反應中,一種物質被氧化,必然伴隨著另一種物質被還原。例如:FeO+C─→Fe+CO (1)
Zn+Cu2+ ─→Zn2+ +Cu (2)
AlCl3+2Al─→3AlCl (3)
式(1)中,碳氧化為CO;FeO則還原為鐵。式(2)中鋅氧化為 Zn2+; Cu2+ 則還原為銅。式(3)中,鋁氧化為AlCl;AlCl3則還原為 AlCl。式(3)稱為歧化反應(見化學遷移反應)。冶金工作者習慣上根據反應的主要目的或手段,給某個冶金過程命名為氧化過程或還原過程。例如,高爐煉鐵過程中雖然有碳的氧化,但冶煉的目的是將鐵礦石還原成鐵,所以將高爐煉鐵劃入還原過程。又如白冰銅吹煉成銅的反應:
Cu2S+O2─→2Cu+SO2 (4)
儘管有Cu2S還原為銅,但吹煉的基本目的是用氧將白冰銅中的硫氧化除去以獲得粗銅,所以稱之為氧化吹煉。這種命名方法反映了冶金工作者在設計、研究和生產工藝上所側重考慮的方面。
還原反應 冶金過程中常見的還原反應有三種:
碳熱還原 碳為還原劑,被還原物來自氧化礦的礦石及其精礦粉的燒結塊或球團,或硫化精礦的燒結塊或焙砂。如高爐煉鐵,鼓風爐煉鉛,豎罐煉鋅,電爐煉製矽鐵、錳鐵等均屬此類型。
金屬熱還原 還原劑為金屬,如Al、Si(更常用含Si75%的 Fe-Si合金)、Mg、Ca、Na等。被還原物為氧化物或氯化物。如用鋁熱還原法生產釩鐵,克勞爾(Kroll)法中用鎂還原TiCl4生產海綿鈦等(見金屬熱還原)。
氣體還原 還原劑為H2、CO、CH4、水煤氣或其他氣態碳氫化合物。如粉末冶金工業經常用氫還原氧化物以製取金屬粉(如W、Mo、Fe等),再壓製成型,燒結成產品。濕法冶金常自金屬鹽溶液中,採用高壓氫還原法製取金屬鈷等。在高爐煉鐵、鼓風爐煉鉛中,除固體碳參加還原反應外,也有大量CO參加反應。
此外,利用不溶陽極或可溶粗金屬陽極進行金屬鹽的酸性水溶液電解時,在陰極上析出金屬(如Cu、Zn、Cd、Co、Ni等)的反應,以及高溫熔鹽電解生產鋁、鎂等的陰極反應,也可屬於還原反應之列。
氧化反應 作為氧化反應來看待的冶金過程有四種:
氧化焙燒 (包括燒結)利用空氣或富氧空氣對硫化礦或其精礦粉焙燒去硫,形成金屬氧化物或硫酸鹽,例如:
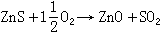 (5)
(5)
ZnS+2O2→ZnSO4 (6)
氯化焙燒 利用氯化劑在氧化氣氛下對硫化礦焙燒去硫,得到金屬氯化物,例如:Cu2S+4NaCl+2O2→2CuCl2+2Na2O+SO2 (7)
上列反應是濕法冶金提取銅使用的氯化焙燒反應。
氧化吹煉 以純氧氣頂吹、底吹或頂底複合吹在轉爐內由生鐵煉成鋼的過程中,脫矽、脫錳、脫碳及脫磷都是氧化反應;在臥式轉爐內利用空氣或富氧空氣吹煉銅鋶(冰銅)得到粗銅也是氧化反應。上述吹煉均屬自熱過程。
氧化精煉 利用氧化性爐渣或鐵礦石為氧化劑,在平爐或電爐內煉鋼,脫去雜質,其氧化反應和轉爐煉鋼時的反應相同。粗銅在反射爐內精煉,利用空氣脫去粗銅內的Fe、Zn、Co、Sn、Pb、S等雜質。
此外,粗金屬鑄成陽極在其鹽的酸性水溶液中的電化溶解,形成金屬陽離子,如Ag+、Au3+、Cu2+、Pb2+、Ni2+、Co2+ 等,也可屬氧化反應之列。
還原-氧化順序 當有許多氧化物同時被還原或許多元素同時被氧化時,則存在還原氧化順序的問題,也即選擇性還原與氧化的問題。進入高爐的原料(礦石、熔劑及燃料)除Fe2O3外,尚含有CaO、MgO、Al2O3、SiO2、MnO、P2O5等氧化物,也可能含有其他氧化物如RxOy(R表稀土金屬)、TiO2、Nb2O5、V2O3、Cr2O3、Cu2O、NiO、SnO、As2O5等。何種元素能被還原進入生鐵,何種元素不能被還原而以氧化物進入爐渣?通過熱力學分析可以回答此問題。從元素氧化的自由焓ΔG°對溫度T的關係圖(見氧勢圖)可看出,在高爐爐缸的溫度範圍 (1300~1600℃)內,以圖中部C氧化為CO的ΔG°線的位置為界,該圖可分為三個區域。中間區域有若干元素如Mn、V、Nb、Cr等,其氧化反應的ΔG°線和碳氧化反應的ΔG°線相交。下部區域有若干元素如Ca、Mg、Ce、Al等,其氧化反應的ΔG°線在碳氧化反應的ΔG°線之下,而不與之相交。上部區域有若干元素,如 Cu、Ni、P等,其氧化反應的ΔG°線在碳氧化反應的ΔG°線之上,也不與之相交。根據圖內ΔG°線的位置得知:①在高爐的操作條件下,CaO、MgO、Al2O3及RxOy不能被還原而全部進入爐渣;Cu、Ni、Sn、P及As全部被還原,進入生鐵;②MnO、Nb2O5、V2O3及Cr2O3則大部分被還原進入生鐵,部分進入爐渣;③矽被還原進入生鐵的部分則取決於高爐的操作條件,爐缸溫度高,將使較多量的矽進入生鐵。
煉製合金鋼時,合金原料加入電弧爐的先後順序取決於元素與氧的親合力。根據元素在鐵液中氧化的ΔG°與溫度T關係圖,可以按氧化反應自由焓變數的大小確定加料先後的順序。
自由焓計算可以提供還原- 氧化反應的理論分析依據。例如,根據式(8),矽在低於2470K時,不可能還原MgO:
Si(固)+2MgO(固)─→2Mg(氣)+SiO2(固) (8)
ΔG°=523000-211.71T (焦)皮吉昂(Pidgeon)法火法煉製純鎂採用白雲石為原料: Si(固)+2(CaO·MgO)(固)─→2Mg(氣)+Ca2SiO4(固) (9)
ΔG°=396640-216.73T (焦)此時最低還原溫度根據式(9)降低為1830K。當採用真空操作時,自由焓計算證明,在壓力小於32毫米汞柱時,在1200℃即可順利操作得到金屬鎂。這說明運用熱力學分析能提供較合適的冶煉操作條件。
參考書目
魏壽昆:《冶金過程熱力學》,上海科學技術出版社,1980。
F.Habashi,Principles of Extractive Metallurgy,Vo1.2,Gorden & Breach, New York,1970.