詞義解釋
基本解釋
胺(àn)氨NH3分子中部分或全部氫原子被烴基取代後而成的有機化合物,胺類大都具有鹼性,能與酸結合而成鹽,是製作合成染料、藥物等的原料。
詳細解釋
胺 【名】氨分子裡的氫被烴基或其他非酸性有機基取代後衍生出的一類有機化合物〖amine〗
胺 (è)【動】 肉類腐爛變臭〖(ofmeat)putrefy〗。《廣韻》:“胺,肉敗臭。”
分類
按照氫被取代的數目,依次分為一級胺(伯胺)RNH2、二級胺(仲胺)R2NH、三級胺(叔胺)R3N、四級銨鹽(季銨鹽)R4N+X-,例如甲胺CH3NH2、苯胺C6H5NH2、乙二胺H2NCH2CH2NH2、二異丙胺[(CH3)2CH]2NH、三乙醇胺(HOCH2CH2)3N、溴化四丁基銨(CH3CH2CH2CH2)4N Br 。
合成
鹵化物氨解(Ammonolysisofhalides)氨或胺氮上有孤對電子,作為親核試劑與鹵代烷發生親核反應,按SN2機理進行。許多有機鹵化物以氨水溶液或氨溶液處理則變成胺類:
X為鹵素
RX+NH3→RNH3+X-
RNH3+X-→RNH2+H2O+X-
用醇製備
胺的主要合成方法是氨的烷基化。工業上使用醇與氨合成有機胺:
ROH+NH3→RNH2+H2O
這些反應需要使用催化劑、特製儀器及額外純化,因為得到的是一、二、三級胺的混合物,需要提高反應的選擇性。
性質
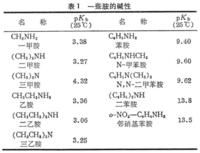 胺的性質
胺的性質胺具有鹼性,在氣相條件下氨比任何一種甲胺的鹼性都弱得多,但在溶液中其鹼性與三甲胺相近,一甲胺和二甲胺的鹼性較三甲胺約強10倍。低級的胺是氣體或易揮發的液體,氣味與氨相似,有的有魚腥味(魚的腥味其實就主要來自三甲胺);高級的胺為固體;芳香胺多為高沸點的液體或低熔點的固體,具有特殊的氣味。胺的沸點比相對分子質量相似的非極性化合物高,比醇或羧酸的沸點低;叔胺的沸點比相對分子質量相近的伯胺和仲胺低。胺是極性化合物。低級胺易溶於水,胺可溶於醇、醚、苯等有機溶劑。
胺與酸作用易成鹽。在許多有機反應中,常把胺作為親核試劑使用。其反應活性通常隨鹼性的強弱而異,取代基的大小對反應活性的影響較大,位阻較大的胺反應活性降低,例如二異丙基乙基胺已完全不能與鹵代烷發生作用。此外,芳香胺的重氮化反應(也就是利用伯胺和亞硝酸在低溫條件下反應生成重氮鹽的反應)也是重要的有機反應之一(主要是用來製備一些不符合取代基定位規則的化合物如1,3,5-三溴苯和一些特殊的化合物如氟苯等)。
如果想要鑑別各類胺則可以使用Hinsberg鑑定法(也就是利用苯磺酸和胺類反應後看是否生成產物然後再用NaOH溶液溶解)。
物理性質
甲胺、二甲胺、三甲胺和乙胺室溫下為氣體,其它低級胺為液體;高級胺為固體;低級胺有氨味,三甲胺有魚腥味,腐胺(丙二胺)屍胺(丁二胺)有惡臭味;
芳香胺為高沸點的液體或低熔點的固體;
胺與水能形成分子間的氫鍵;
一級胺和二級胺本身分子間也能形成氫鍵。
大多數芳胺具有毒性,苯胺可以導致再生障礙
性貧血,通過吸入,食入或透過皮膚吸收而致中
毒,食入0.25mL就嚴重中毒。
β–萘胺與聯苯胺是能夠引起惡性腫瘤的物質。
光譜性質
IR:胺的N-H伸縮振動吸收:RNH2:在3400~3490cm-1處出現2個峰
R2NH:在3300~3500cm-1處出現1個峰
R3N:在上述區域沒有N-H吸收峰
NMR:N-Hδ:0.5~5ppm
-CH-NH2δ:2.2~2.8ppm
製法
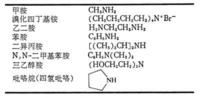 胺的製法
胺的製法胺在自然界中分布很廣,其中大多數是由胺基酸脫羧生成的。例如工業製備胺類的方法多是由氨與醇或鹵代烷反應製得,產物為各級胺的混合物,分餾後得到純品。由醛、酮在氨存在下催化還原也可得到相應的胺。工業上也常由硝基化合物、腈、醯胺或含氮雜環化合物催化還原製取胺類化合物。如圖所
示:
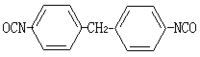
 硝基化合物還原製取胺
硝基化合物還原製取胺結構
 胺的結構
胺的結構套用
 胺的套用
胺的套用
