發現簡史
銪的故事是稀土又稱鑭系元素的複雜歷史的一部分,它開始於1803年鈰的發現。在1839年Carl Mosander從中分離了其它兩種元素:鑭和一個他稱之為didymium(鐠釹混合物)的元素,其實它是兩種稀土的混合物,鐠和釹,在1879年由Karl Auer揭露。即便如此,它還是隱藏著另一種稀有金屬,釤,由Paul-Émile Lecoq de Boisbaudran分離,即便是不純的。在1886年Jean Charles Galissard de Marignac從中提取了釓,但這個故事還是沒有結束。在1901年,Eugène-Anatole Demarçay開展一連串艱苦的硝酸釤鎂結晶工作,然後分離產生了另一種新的元素銪 。
稀土元素的發現從18世紀末到20世紀初,經歷了100多年,發現了數十個,但只肯定了其中的十幾個。銪被認為是20世紀初被發現的一個稀土元素。1892年布瓦博德朗利用光譜分析,鑑定釤中存在兩種新元素,分別命名為Zε和Zζ 。後來在1906年,德馬凱經過研究,確定新元素命名為這兩種元素其實是同一個元素,並命名為 europium,元素符號Eu。銪和另一個稀土元素鑥的發現就完成了自然界中存在的所有稀土元素的發現。它們倆的發現可以認為是打開了稀土元素髮現的第四座大門,完成了稀土元素髮現的第四階段。
發現過程:1896年,德馬凱(E.Demarcay)發現,1904年,烏爾班(G.Urpain)製得了純的銪的化合物。
元素名來源於拉丁文,原意是“歐洲”。1896年由法國化學家德馬爾蓋發現。
 銪
銪銪是稀土金屬中的一種。稀土是歷史遺留的名稱,從18世紀末葉開始被陸續發現。當時人們慣於把不溶於水的固體氧化物稱作土,例如把氧化鋁叫做陶土,氧化鎂叫苦土。稀土是以氧化物狀態分離出來,很稀少,因而得名稀土,稀土元素的原子序數是21(Sc)、39(Y)、57(La)至71(Lu)。它們的化學性質很相似,這是由於核外電子結構特點所決定的。它們一般均生成三價化合物。鈧的化學性質與其它稀土差別明顯,一般稀土礦物中不含鈧。鉕是從鈾反應堆裂變產物中獲得,放射性元素147Pm半衰期2.7年。過去認為鉕在自然界中不存在,直到1965年,荷蘭的一個磷酸鹽工廠在處理磷灰石中,才發現了鉕的痕量成分。因此,中國1968年將鉕劃入64種有色金屬之外。 1787年瑞典人阿累尼斯(C.A.Arrhenius)在斯德哥爾摩(Stockholm)附近的伊特比(Ytterby)小鎮上尋得了一塊不尋常的黑色礦石,1794年芬蘭化學家加多林(J.Gadolin)研究了這種礦石,從其中分離出一種新物質,三年後(1797年),瑞典人愛克伯格(A.G.Ekeberg)證實了這一發現,並以發現地名給新的物質命名為Ytteia(釔土)。後來為了紀念加多林,稱這種礦石為Gadolinite(加多林礦,即矽鈹釔礦)。1803年德國化學家克拉普羅茲(M.H.Klaproth)和瑞典化學家柏齊力阿斯(J.J.Berzelius)及希生格爾(W.Hisinger)同時分別從另一礦石(鈰矽礦)中發現了另一種新的物質---鈰土(Ceria)。1839年瑞典人莫桑得爾(C.G.Mosander)發現了鑭和鐠釹混合物(didymium)。1843年莫桑得爾發現了鋱和鉺。1878年瑞士馬利納克發現了鐿,兩年後他又發現了釓。1879年法國人布瓦普德朗(L.D.Boisbauder)發現了釤,瑞典人克利夫(P.T.Cleve)發現了鈥和銩,瑞典人尼爾松(L.F.Nilson)發現了鈧。1885年奧地利人威斯巴克(A.V.Welsbach)從莫桑得爾認為是“新元素”的鐠釹混合物中發現了鐠和釹。1886年布瓦普德朗發現了鏑。1901年法國人德馬爾賽(E.A.Demarcay)發現了銪。1947年美國人馬瑞斯克(J.A.Marisky)等從鈾裂產物中得到鉕。從1794年加多林分離出釔土至1947年製得鉕,歷時150多年。
礦藏分布
銪在地殼中的含量為0.000106%,是最稀有的稀土元素,主要存在於獨居石和氟碳鈰礦中,自然界有兩種銪的同位素:銪151和銪153。很少量地存在於獨居石中 。
物理性質
銪
yǒuㄧㄡˇ
銪是一種金屬元素,銀白色
元素描述:第一電離能為5.67電子伏特。能燃燒成氧化物;氧化物近似白色。
分子式: Eu
分子量: 151.964
顏色及外觀: 銀色
穩定性: 空氣中極易氧化,應保存在氬氣中
銪為鐵灰色金屬,熔點822°C,沸點1597°C,密度5.2434克/厘米3;是稀土元素中密度最小、最軟和最易揮發的元素。銪為稀土元素中最活潑的金屬:室溫下,銪在空氣中立即失去金屬光澤,很快被氧化成粉末;與冷水劇烈反應生成氫氣;銪能與硼、碳、硫、磷、氫、氮等反應。銪廣泛用於製造反應堆控制材料和中子防護材料。
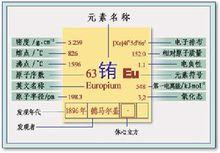
元素名稱:銪
元素原子量:152.0
元素類型:金屬
原子體積:(立方厘米/摩爾):28.9
元素在太陽中的含量:(ppm):0.0005
元素在海水中的含量:(ppm)
太平洋表面 0.0000001
地殼中含量:(ppm):2.1
 銪
銪原子序數:63元素符號:Eu
元素中文名稱:銪
元素英文名稱:Europium
相對原子質量:151.9
核內質子數:63
核外電子數:63
核電荷數:63
相對原子質量:151.96
常見化合價: +2,+3
電負性: 1.2
外圍電子層排布:4f76s2
核外電子排布: 2,8,18,25,8,2
電子層:KLMNOP
電子數:2-8-18-32-18-8
同位素及放射線:Eu-147[24.4d] Eu-148[54.5d] Eu-149[93.1d] Eu-150[36y] Eu-151 Eu-152[13.5y] *Eu-153 Eu-154[8.6y] Eu-155[7.4y] Eu-156[15.2d] 電子親合和能:0 KJ·mol-1
第一電離能:546.5 KJ·mol-1
第二電離能: 1085 KJ·mol-1
第三電離能:2404 KJ·mol-1
單質密度: 5.259 g/cm3
單質熔點: 822.0 ℃
單質沸點: 1597.0 ℃
原子半徑: 2.56 埃
離子半徑: 1.07(+2) 埃 0.95(+3)埃
共價半徑: 1.85 埃
常見化合物: 無
氧化態:
Main Eu
Other Eu
質子質量:1.05399E-25
質子相對質量:63.441
所屬周期:6
所屬族數:IIIB
摩爾質量:152
最高價氧化物:
密度:5.259
熔點:822.0
沸點:1597.0
晶胞參數:
a = 458.1 pm
b = 458.1 pm
c = 458.1 pm
α = 90°
β = 90°
γ = 90°
電離能 (kJ /mol)
M - M+ 546.7
M+ - M2+ 1085
M2+ - M3+ 2404
M3+ - M4+ 4110
維氏硬度:167MPa
晶體結構:晶胞為體心立方晶胞,每個晶胞含有2個金屬原子。
顏色和狀態:銀白色金屬
原子半徑:2.56
常見化合價+2,+3
主要用途
銪(Eu):1901年,德馬凱(Eugene-Antole Demarcay)從“釤”中發現了新元素,取名為銪(Europium)。這大概是根據歐洲(Europe)一詞命名的。氧化銪大部分用於螢光粉。Eu 用於紅色螢光粉的激活劑,Eu 用於藍色螢光粉。現在YOS:Eu 是發光效率、塗敷穩定性、回收成本等最好的螢光粉。再加上對提高發光效率和對比度等技術的改進,故正在被廣泛套用。
 稀土-氧化銪(99.99%)
稀土-氧化銪(99.99%)近些年氧化銪還用於新型X射線醫療診斷系統的受激發射螢光粉。氧化銪還可用於製造有色鏡片和光學濾光片,用於磁泡貯存器件,在原子反應堆的控制材料、禁止材料和結構材料中也能一展身手。因它的原子比任何其他元素都能吸收更多的中子,所以常用於原子反應堆中作吸收中子的材料。此外,可用作彩色電視機的螢光粉,這些螢光粉發出閃亮的紅色,用來製造電視螢光屏;雷射材料等。
化學性質
銪為稀土元素中最活潑的金屬:室溫下,銪在空氣中立即失去金屬光澤,很快被氧化成粉末;與冷水劇烈反應生成氫氣;銪能與硼、碳、硫、磷、氫、氮等反應。銪廣泛用於製造反應堆控制材料和中子防護材料 。
氧化銪
英文名europium oxide;europia
分子式:Eu2O3
帶淡紅色的粉末。相對密度7.42.熔點2002度。不溶於水,溶於酸。能吸收空氣中二氧化碳和水。
製法 :
萃取法 以處理獨居石或混合稀土礦所得的氯化稀土溶液為原料。用P204-煤油-HCL-ReCl體系萃取,首先進行釹釤分組,萃余液用以提取輕稀土,將釤及重稀土萃入有機相,然後用2.0mg/L HcL反萃中稀土,得中稀土釤富集物,經鋅粉還原,鹼度法提取銪後,在京草酸沉澱,分離,烘乾,灼燒,制的氧化銪。
毒性:稀土元素的鹽能降低血酶原的含量,使其失活,並抑制凝血活素的生成,使纖維蛋白原沉澱,催化分解磷酸化合物。稀土元素的毒性隨原子量增加而減弱。工作時需帶防毒面罩,如有放射性要進行特殊的防護,對粉塵應防止散落。
氫氧化銪:
分子式: Eu(OH).xHO
分子量: 202.96
顏色及外觀: 白色
溶解性: 不溶於水, 微溶於酸
穩定性: 輕微吸濕
三氯化銪:
通常以水合物的形式存在
分子式: EuCl.6HO
分子量: 366.41
顏色及外觀: 白色
溶解性: 溶於水,微溶於酸
 硫酸銪
硫酸銪穩定性: 輕微吸濕
硫酸銪:
硫酸銪分子式: Eu(SO).xHO
分子量: 592.10
顏色及外觀: 粉紅色晶體
溶解性: 可溶於水,微溶於酸
穩定性: 輕微吸濕
氟化銪:
 氟化銪
氟化銪分子式: EuF分子量: 208.96
顏色及外觀: 白色
溶解性: 不溶於水, 微溶於酸
穩定性: 輕微吸濕
硝酸銪:
分子式: Eu(NO).6HO
CAS No. 10031-53-5
分子量: 337.97
顏色及外觀: 晶體
溶解性: 溶於水和酸
穩定性: 輕微吸濕
碳酸銪:
分子式: Eu(CO).xHO
分子量: 483.95
顏色及外觀: 白色
溶解性: 溶於水,微溶於酸
穩定性: 輕微吸濕
醋酸銪:
分子式: Eu(OCH).xHO
分子量: 329.10
顏色及外觀: 白色
溶解性: 溶於水,微溶於酸
穩定性: 輕微吸濕
套用領域
用作彩色電視機的螢光粉,在雷射材料及原子能工業中有重要的套用。
氧化銪大部分用於螢光粉。Eu 用於紅色螢光粉的激活劑,Eu 用於藍色螢光粉。現在YOS:Eu 是發光效率、塗敷穩定性、回收成本等最好的螢光粉。再加上對提高發光效率和對比度等技術的改進,故正在被廣泛套用。
近些年氧化銪還用於新型X射線醫療診斷系統的受激發射螢光粉 。氧化銪還可用於製造有色鏡片和光學濾光片,用於磁泡貯存器件,在原子反應堆的控制材料、禁止材料和結構材料中也能一展身手。因它的原子比任何其他元素都能吸收更多的中子,所以常用於原子反應堆中作吸收中子的材料。此外,可用作彩色電視機的螢光粉,這些螢光粉發出閃亮的紅色,用來製造電視螢光屏;雷射材料等。
稀土銪配合物 是一種兼具有機化合物高發光量子效率和無機化合物良好穩定性的紅色螢光材料,具有很好的套用前景。
製造方法
常用真空蒸餾氧化銪和金屬鑭的混合物還原來製取 。
富銪鹽酸稀土製備超細高純氧化銪的方法。
一種富銪鹽酸稀土製備超細高純氧化銪的方法,是以富銪鹽酸稀土為原料,其特徵在於所述方法步驟如下:
(1)配料混合:將富銪鹽酸稀土、鹽酸、水進行混合配料;
(2)固-液分離:經過固-液分離,除去不溶性雜質,得到富銪鹽酸稀土溶液料液,料液中稀土的濃度為0.1-1.2mol/L;
(3)電化學還原:將上一步得到的富銪鹽酸稀土溶液在電化學反應器的陰極將三價銪Eu 還原為二價銪Eu ,得到EuCl溶液;
(4)超聲分餾萃取:在超聲萃取設備中,加入EuCl溶液、萃取液、洗液,三種物料配料的體積比為1∶0.5-5.0∶0.1-2.0,操作條件為超聲頻率19-80kHz,超聲作用強度0.2-20.0W/cm ,操作溫度為5-60℃,進行超聲分餾萃取,中間出口液為EuCl精製液,進入下一步;
(5)電化學氧化:將上一步得到EuCl精製液進入電化學反應器中,在電化學反應器的陽極,將二價銪Eu 氧化為三價銪Eu ,生成EuCl精製液;
(6)吸附除雜:在上一步得到的EuCl精製液中,加入吸附除雜劑,進行進一步深度吸附除雜,經固-液分離,除去雜質,製得純淨的EuCl3精製液,進入下一步;
(7)超聲結晶沉澱:在超聲結晶設備中,加入純淨的鹽酸銪精製液、結晶沉澱劑碳酸氫銨或碳酸銨,鹽酸銪精製液與結晶沉澱劑配料的摩爾比為1∶1.1-1.6,操作條件為超聲頻率19-80kHz,超聲作用強度為0.2-20.0W/cm ,操作溫度為5-60℃,進行超聲結晶沉澱,生成碳酸銪Eu(CO)結晶沉澱物,進入下一步;
(8)固-液分離:經固-液分離,得到固相為碳酸銪Eu(CO)結晶沉澱物,進入下一步;
(9)乾燥、灼燒:在25-800℃乾燥,獲得碳酸銪Eu(CO);在800-900℃下灼燒,獲得EuO含量≥99.99%,顆粒粒徑為0.01-10.0μm的超細高純氧化銪產品。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
![銪[化學元素] 銪[化學元素]](/img/a/9ce/nBnauM3X3YjN0MjMzQTOzkDN1UTM1QDN5MjM5ADMwAjMwUzL0kzL2czLt92YucmbvRWdo5Cd0FmLwE2LvoDc0RHa.jpg)
