研究簡史
早在7000年前人類就已經認識鉛了。它分布廣,容易提取,容易加工,既有很高的延展性,又很柔軟,而且熔點低。在《聖經·出埃及記》中就已經提到了鉛。鉛是人類最早使用的金屬之一,公元前3000年,人類已會從礦石中熔煉鉛。鉛在地殼中的含量為0.0016%,主要礦石是方鉛礦。在英國博物館裡藏有在埃及阿拜多斯清真寺發現的公元前3000年的鉛制塑像。在伊拉克烏爾城和其他一些城市發掘古蹟所獲得的材料中,不僅找到屬於公元前4000年間的各種金屬物件,而且有古代波斯人所用的契型文字的黏土板檔案記錄。這些記錄說明,在公元前2350年已經從礦石中提煉出大量鐵、銅、銀和鉛。在公元前1792——前1750年巴比倫皇帝漢穆拉比統治時期,已經有了大規模鉛的生產。在中國殷代墓葬中也發現有鉛制的酒器卣、爵、觚和戈等。中國在商殷至漢代青銅器中鉛的含量有增大的趨勢。青銅中鉛的增加對於液態合金流動性的提高起了重要作用,使鑄件紋飾畢露。不過,古代人對鉛和錫的分別並不是十分明確。羅馬人稱鉛為黑鉛,稱錫為白鉛,以致後來它的元素符號定為Pb。中外古鍊金家和煉丹家們對鉛和鉛的一些化合物進行了實驗,例如在魏伯陽所著的《周易參同契》中說:“胡粉投火中,色壞還為鉛。”用今天的化學方程式表示就是:Pb3O4+2C——→3Pb+2CO2↑還原法制Pb反應為:PbO+C==Pb+CO↑PbO+CO==Pb+CO2實驗現象:生成氣體能使澄清石灰水變渾濁,黃色粉末變成銀白色液體。直到16世紀以前,在用石墨製造鉛筆以前,在歐洲,從希臘,羅馬時代起,人們就是手握夾在木棍里的鉛條在紙上寫字,這正是今天“鉛筆”這一名稱的來源。到中世紀,在富產鉛的美國,一些房屋,特別是教堂,屋頂是用鉛板建造的,因為鉛具有化學惰性,耐腐蝕。最初製造硫酸使用的鉛室法也是利用鉛的這一特性。古羅馬使用鉛非常多。有人甚至認為羅馬入侵不列顛的原因之一是因為康沃爾地區擁有當時所知的最大的鉛礦。甚至在格陵蘭島上鑽出來的冰心中可以測量得出從前5世紀到3世紀地球大氣層中的鉛的含量增高。這個增高今天被認為是羅馬人造成的。鍊金術士以為鉛是最古老的金屬並將它與土星聯繫到一起。在人類歷史上鉛是一種被廣泛套用的金屬。從1980年代中開始,鉛的套用開始驟然下降。主要原因是鉛的生理作用和它對環境的污染。今天汽油、染料、焊錫和水管一般都不含鉛了。中國二里頭文化的青銅器中,即發現有加入鉛作為合金元素,並在整個青銅時代與錫一起,構成了中國古代青銅器最主要的合金元素。物質結構
 鉛,銀白色金屬元素
鉛,銀白色金屬元素鉛為帶藍色的銀白色重金屬,它有毒性,是一種有延伸性的主族金屬。熔點327.502℃,沸點1740℃,密度11.3437g/cm^3,比熱容0.13kJ/(kg·K),硬度1.5,原子體積18.17立方厘米/摩爾,質地柔軟,抗張強度小。
鉛元素在太陽中的含量0.01ppm,元素在海水中的含量太平洋表面0.00001ppm,氧化態MainPb+2,Pb+4。
鉛是質量最大的穩定元素,在自然界中有4種穩定同位素:鉛204、206、207、208,還有20多种放射性同位素。
金屬鉛在空氣中受到氧、水和二氧化碳作用,其表面會很快氧化生成保護薄膜;在加熱下,鉛能很快與氧、硫、鹵素化合;鉛與冷鹽酸、冷硫酸幾乎不起作用,能與熱或濃鹽酸、硫酸反應;鉛與稀硝酸反應,但與濃硝酸不反應;鉛能緩慢溶於強鹼性溶液。
鉛的元素符號Pb是來自拉丁名稱plumbum。
晶胞參數
a=495.08pm
b=495.08pm
c=495.08pm
α=90°
β=90°
γ=90°
【莫氏硬度】1.5
【聲音在其中的傳播速率】1190m/S
【電離能(kJ/mol)】
 鉛粒
鉛粒M+-M2+1450.4
M2+-M3+3081.5
M3+-M4+4083
M4+-M5+6640
M5+-M6+8100
M6+-M7+9100
M7+-M8+11800
M8+-M9+13700
M9+-M10+16700
金屬鉛是藍白色重金屬,質柔軟,延性弱,展性強。空氣中表面易氧化而失去光澤,變暗。
溶於硝酸,熱硫酸、有機酸和鹼液。不溶於稀鹽酸和硫酸。具有兩性:既能形成高鉛酸的金屬鹽,又能形成酸的鉛鹽。元素來源:主要存在於方鉛礦(PbS)及白鉛礦(PbCO3)中,經煅燒得硫酸鉛及氧化鉛,再還原即得金屬鉛。第一電離能7.4167電子伏特。第二電離能15.874電子伏特。熔點327.5℃,沸點1740℃。密度11.3347克/立方厘米。
理化性質
物理性質
 鉛
鉛鉛為帶藍色的銀白色重金屬,熔點327.502°C,沸點1740°C,密度11.3437克/厘米3,硬度1.5,質地柔軟,抗張強度小。
沒有氧化層的鉛色澤光亮,密度高,硬度非常低,延伸性很強。它的導電性能相當低,抗腐蝕性能很高,因此它往往用來作為裝腐蝕力強的物質(比如硫酸)的容器。加入少量銻或其它金屬可以更加提高它的抗腐蝕力。
金屬鉛在空氣中受到氧、水和二氧化碳作用,其表面會很快氧化生成保護薄膜;
鉛與冷鹽酸、冷硫酸幾乎不起作用,能與熱或濃鹽酸、硫酸反應;鉛與稀硝酸反應,但與濃硝酸不反應;鉛能緩慢溶於強鹼性溶液。
化學性質
【元素名稱】鉛(lead)
【CAS號】7439-92-1
【元素符號】Pb
【原子序數】82
【周期序數】6
【族-序數】IVA
【晶體結構】晶胞為面心立方晶胞。
 質子結構圖
質子結構圖【相對原子質量】207.2
【元素類型】金屬元素
【物理性質】帶藍色的銀白色重金屬,熔點327.502°C,沸點1740°C,密度11.3437克/立方厘米,比熱容0.13kJ/(kg·K),硬度1.5,質地柔軟,抗張強度小。
【原子體積】18.17立方厘米/摩爾【元素在太陽中的含量】0.01ppm
【元素在海水中的含量】太平洋表面0.00001ppm
【氧化態】MainPb+2,Pb+4
【晶胞參數】
a=495.08pm
b=495.08pm
c=495.08pm
α=90°
β=90°
γ=90°
【莫氏硬度】1.5
【聲音在其中的傳播速率】1190m/S
【電離能(kJ/mol)】
M-M+715.5
M+-M2+1450.4
M2+-M3+3081.5
M3+-M4+4083
M4+-M5+6640
M5+-M6+8100
M6+-M7+9100
M7+-M8+11800
M8+-M9+13700
M9+-M10+16700
製備方法
工業方法
 白鉛礦
白鉛礦目前世界上煉鉛以火法煉鉛為主,火法煉鉛一般包括原料準備(配料、制粒、燒結焙燒)、還原熔煉製取粗鉛和粗鉛精煉三大工序。煙氣制酸、煙塵綜合回收以及從陽極泥回收金銀等貴金屬也是火法煉鉛工藝的重要組成部分。
鉛精燒結焙燒有兩個目的:一是將原料中的硫氧化除去,並以SO2形式送去制硫酸;二是使部分伴生金屬氧化並與SiO2等脈石成分生成MeO.SiO2低熔點液相,使細粉狀鉛精礦粘結成多孔硬塊,以利還原熔煉。
(1)備料進入燒結工序的物料包括鉛精礦、石英熔劑、燒結返料,三者的配比為30:10:60。鉛精礦一般含有(%):Pb50-60、Zn4-6、Cu0.2、S15-25、Fe14、SiO21-2。此外,還伴生有Ag、Bi、Cd、In等有價金屬。配好的物料,經過混合和制粒,用布料機均勻地平鋪在燒結機上進行燒結焙燒。(2)燒結現代燒結作業均採用帶式燒結機,面積為60-70m3。工作時,鋪滿爐料的燒結機在傳動機械帶動下向前移動,經過點火裝置處爐料被火焰點燃,並在強制通過料層吸入(或鼓出)的大量窯中氧的作用下,料層溫度迅速上升到1073-1173K,爐料中發生了一系列的燒結反應。
爐料中主要鉛礦物PbS與O2反應生成PbO和SO2:
3PbS+5O2====2PbO+PbSO4+2SO2
3PbSO4+PbS====4PbO+4SO2
還有少量金屬鉛生成:
PbS+PbSO4====2Pb+2SO2
在爐料中含量較高的黃鐵礦(FeS2)發生分解並進一步氧化成FeO,Fe2O3和SO2,進而與SiO2,PbO化合,生成為矽酸鹽(2FeO.SiO2、xPbO.SiO2)和亞鐵酸鹽(xPbO.yFe2O3)。以上鹽類在焙燒作業溫度下均呈液相,粉狀爐料在此液相作用下,形成堅硬多孔大塊。這些低熔點鹽是燒結過程的粘結劑。燒結料經過破碎篩分,篩至50-150mm塊料送鼓風爐熔煉,篩下粉料返配料,含SO2煙氣送去制酸。
影響燒結焙燒效果的因素有:①爐料配比與化學成分;②爐料水分;③爐料粒度;④料層厚度;⑤點火溫度;⑥小車運行速度;⑦吸風風量與鼓風壓力、風量;⑧煙氣SO2濃度等。
燒結焙燒典型技術經濟指標為:料層厚度250-300mm,床能力25-30t/(m2·d),台車速度0.8-1.0m/min,燒結塊含硫1.5%-2%,混合料含硫6%,含水5%-6%,成品塊率27%-30%,脫硫率88.5%,點火溫度800-1000℃,煙氣SO2濃度3%-4.5%,鼓風壓力2.5-4.5kPa,強度18-23m3/(m2·min),燒結溫度1000℃,時間16-20min,垂直燒結速度12-15mm/min.
第二種:電解精煉
電解精煉。用矽氟酸和矽氟酸鉛做電解液,粗鉛做陽極,純鉛做陰極,可得純鉛。耐腐蝕,可用作水管。鉛、銻、錫的合金熔點低(約240℃),凝固時膨脹,可作印刷鉛字。鉛玻璃用作X射線防護屏。大量鉛用於生產汽油抗爆劑四乙鉛和蓄電池的極板。
鉛電解精煉現在一般採用是1901年的柏茲所提出的,將粗鉛或經過火法初步精煉的半精煉鉛,在矽氟酸與矽氟酸鉛的水溶液中進行電解的過程。其目的是為了獲得高品位的鉛並回收銤及稀貴金屬。
還有一些鉛提煉的簡單工藝比如
1、將方鉛礦中的硫化鉛部分轉變為硫酸鉛,兩者進一步反應得金屬鉛。
2、將硫化鉛熔燒成氧化鉛,然後與焦炭、石灰石放在鼓風爐中冶煉,可生產金屬鉛。
實驗室製備
實驗室通常用分光光度法
分光光度法的詳細步驟:稱取試樣置於300ml石英或是不含鉛的燒杯中,加入15~70ml適宜比例的鹽酸(ρ=1.19)、硝酸(ρ=1.42)混合酸,緩慢加熱溶解;取下稍冷,加入濃磷酸10ml,硫酸(ρ=1.84)20ml,混勻。於電熱板上加熱至冒硫酸煙,取下冷卻。加水溶解鹽類,稀釋至體積150ml,加熱煮沸,在不斷攪拌下,加入10ml氯化鍶溶液(1.5%)煮沸2~5min,於低溫電熱板上保溫1h後,冷卻至室溫。冷卻過程中,應注意攪拌幾次。用慢速濾紙過濾,用(1+100)硫酸洗滌燒杯和沉澱數次,並以水洗2~3次。打開濾紙,將沉澱用水仔細洗入原燒杯中,充分洗滌濾紙;加入10%碳酸鉀溶液25ml,加熱至沸,微沸1~2min,後於低溫電熱板上保溫30min,冷卻至室溫。用濃鹽酸中和並過量1ml,加熱使沉澱溶解,用水稀釋至體積約100ml,加入10~15ml硫酸(ρ=1.84),煮沸2~5min,於低溫電熱板上保溫1h,冷卻至室溫。冷卻過程中,應注意攪拌幾次。然後用慢速濾紙過濾,用(1+100)硫酸洗滌燒杯和沉澱數次,並以水洗2~3次。打開濾紙,將沉澱用水仔細洗入原燒杯中,充分洗滌濾紙;加入10%碳酸鉀溶液25ml,加熱至沸,微沸1~2min,後於低溫電熱板上保溫30min,冷卻至室溫。如稱樣0.1000~0.2000g時,可省去以上操作。用慢速濾紙過濾並將沉澱全部轉移到濾紙上,用擦棒擦淨燒杯,並用1%碳酸鉀溶液洗滌燒杯及沉澱數次,水洗2~3次。用8~10ML熱鹽酸(5+95)分5次溶解沉澱於20ml量瓶中,並用水洗滌濾紙3~4次,總體積不超過15ml,(稱取的試樣中,含鉛超過50μg時,則需將溶液稀釋至刻度,混勻,分取5ml顯色)。加入1~2滴0.1%百里酚藍溶液,用(1+10)氫氧化銨溶液中和至黃色,以鹽酸(1+10)中和至微紅色,再用氫氧化銨(1+10)中和至黃色。加入抗壞血酸(1%),1ml亞鐵氰化鉀溶液,(0.1%),3ml乙酸—乙酸鈉緩衝溶液,用水稀釋至22ml,混勻,加入1ml氟化銨溶液(0.5%),1ml二甲酚橙溶液,稀釋至刻度,搖勻。放置10min,將部分溶液移入3cm比色皿(含量高時用2cm比色皿)中,以水為參比液,于波長580nm處測量吸光度,減去隨同式樣所作空白的吸光度。同時,從工作曲線上查出相應的鉛含量。工作曲線的繪製:稱取0.00、0.50、1.00、2.00、3.00、4.00、5.00鉛標準溶液(10μg/ml),分別置於7個25ml量瓶中,用水調節至體積5ml,加入1~2滴百里酚藍溶液,下與分析步驟相同。測量吸光度時,應當減去試劑空白的吸光度。然後,以鉛為橫坐標,吸光度為縱坐標繪製工作曲線。計算:按下式計算前的百分含量Pb(%)=m1?V/m?V1×100%式中:V1:分取試液的毫升數;V:試液總毫升數;m1:從工作曲線上查得的鉛量(g);m:試樣重(g)
主要用途
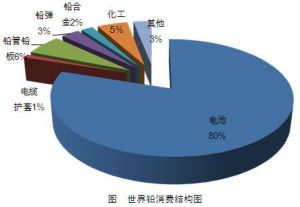 世界鉛消費結構圖
世界鉛消費結構圖鉛在許多工業領域中得到套用,鉛板和鉛管廣泛用於制酸工業、蓄電池、電纜包皮及冶金工業設備的防腐襯裡。
鉛能吸收放射性射線,可作原子能工業及X射線儀器設備的防護材料。
鉛能與銻、錫、鉍等配製成各種合金,如熔斷保險絲、印刷合金、耐磨軸承合金、焊料、榴霰彈彈丸、易熔合金及低熔點合金模具等。
鉛的化合物四乙基鉛可作汽油抗爆添加劑和顏料。
可以作建築工業隔音和裝備上的防震材料等。
2009年美國、日本和中國鉛酸蓄電池耗鉛量所占比例分別達到了86%、86%和81.4%。基於環保的要求,其他領域中鉛的消費都比較低。
安全危害
環境危害
在所有已知毒性物質中,書上記載最多的是鉛。古書上就有記錄認為用鉛管輸送飲用水有危險性。公眾接觸鉛有許多途徑。公眾主要關心石油產品中含鉛問題。顏料含鉛,特別是一些老牌號的顏料含鉛較高,已經造成許多死亡事件,因此有的國家特別制定了環境標準規定顏料中鉛的含量應控制在600PPM之內。有的國家還沒有制定出標準,但是市場出售高鉛含量顏料時貼出標籤警示用戶。食品中也發現鉛的殘留,或是空氣中的鉛降下污染食物,或是罐頭皮的鉛污染罐頭食品。鉛的另外一個重要來源是鉛管。幾十年以前建築住宅時用鉛管或鉛襯裡管道,夏天的天然冰櫃也用鉛襯裡,這些年已經禁用,改用塑膠或其它材料。
一般飲用水中鉛含量的安全界限是100微克/升,而最高可接受水平是50微克/升。後來又進一步規定自來水中可接受的鉛最大濃度為50微克/升(0.05毫克/升)。此外,為了研究鉛對人體健康的影響,科學家著手檢測人體血樣的鉛濃度,作為是否鉛中毒的先期指標。數據表明:如果飲用水接近50微克/升,那么該病人血樣的鉛濃度約在30微克/升以上。吃奶的嬰兒要求應該更為嚴格,平均血鉛濃度要不超過10--15微克/升。
水廠處理水過程中可能加入鈣和重碳酸鹽以保持水呈鹼性,繼而減少水對輸水管道的腐蝕,這個過程會帶來新的風險。但是腐蝕問題很複雜,不是如此這般所能解決的,應該總體淨化,但又價格昂貴。
許多化學品在環境中滯留一段時間後可能降解為無害的最終化合物,但是鉛無法再降解,一旦排入環境,很長時間仍然保持其毒性。由於鉛在環境中的長期持久性,又對許多生命組織有較強的潛在性毒性,所以鉛一直被列入強污染物範圍。
胃疼,頭痛,顫抖,神經性煩躁突觸數量降低,在最嚴重的情況下,可能人事不省,直至死亡。在很低的濃度下,鉛的慢性長期健康效應表現為:影響大腦和神經系統。科學家發現:城市兒童血樣即使鉛的濃度保持可接受水平,仍然明顯影響到兒童智力發育和表現行為異常。我們只有降低飲用水中鉛水平才能保證人們對鉛的攝取總量降低。無鉛汽油的推廣套用為降低環境中的鉛污染立了大功,特別是降低了大氣中的顆粒物中的鉛。鉛還能影響酶和細胞代謝。
鉛與顆粒物一起被風從城市輸送到郊區,從一個省輸送到另一個省,甚至到國外,影響其它地區,成了世界公害。科學家在北美格陵蘭地區的冰山上逐年積凍的地區打鑽鑽取冰柱,下層的年頭久遠,頂層的年頭捱近,依不同層次測定凍的鉛含量。結果表明:1750年以前鉛含量僅為20微克/噸;1860年為50微克/噸;1950年上升為120微克/噸;1965年劇增到210微克/噸。近代工業的發展,全球範圍的污染日趨嚴重。
健康危害
兒童中毒兒童發生鉛中毒的機率是成年人的30多倍!其原因與兒童正處在生長發育階段,許多器官尚不成熟,解毒功能不完善,對鉛較敏感,以及接觸機會較多有關。[4]2007年3月24日北京兒科研究所報告,由世界衛生組織兒童衛生合作中心牽頭,歷時3年的中國部分城市兒童鉛中毒調查結果顯示,中國6歲兒童的血鉛值位居各年齡組兒童之首,北京7%的孩子血鉛含量超標。
國際上普遍認為兒童血鉛達到或超過100微克/升為血鉛偏高。鉛超標會影響兒童的智力,包括說話能力、記憶力和注意力等。孩子血鉛超標告一般不會有明顯的症狀,主要表現為注意力不集中,會有攻擊性,有時肚子會疼。由於這些症狀不具有特異性,因此往往會被家長忽略。
兒童是室內空氣鉛污染的首要受害者。室內環境鉛污染主要有以下四個方面:一是來源於室內某些裝飾品。如使用含鉛油漆或塗料進行住房牆壁、地板和家具等裝飾,造成室內塵土含鉛量升高。新裝修的住宅最好在有效通風換氣3個月後入住;要加強兒童房間的通風換氣,減少兒童在污染環境裡的活動時間。二是來源於煤及煤製品。煤在燃燒過程中會釋放出鉛塵。
另外兩個鉛污染因素分別是:三是來源於室內吸菸。孩子被動吸菸能增加血鉛水平過高的危險性。每克香菸中含0.8微克的鉛。研究表明,有被動吸菸史的兒童發生血鉛水平過高的危險性要高於沒有被動吸菸史的兒童。有人對在吸菸家庭中長大的孩子與在不吸菸家庭中長大的孩子進行對比發現,前者患鉛中毒的比例比後者要高出10倍以上。這說明,香菸燃燒時,煙霧中含有的鉛顆粒雖然量很少,但兒童長期被動吸入也會引起蓄積中毒。對被動吸菸與幼兒血鉛水平關係的研究也表明,幼兒的血鉛水平和鉛中毒率隨家庭中吸菸量的增加及吸菸時間的延長而升高,年齡越小血鉛水平和鉛中毒率越高,2歲左右為最高。一般認為,年齡越小越對煙霧鉛污染易感和脆弱,2歲時可能是兒童被動吸菸鉛吸收的關鍵時期。四是來源於空氣污染。室外大氣鉛濃度會直接影響室內鉛污染水平。
如何讓孩子遠離鉛危害?除了定期給孩子檢測身體微量元素水平外,可以從以下12個方面讓你的寶寶遠離鉛危害:
1、勤洗手,勤剪指甲,養成飯前洗手好習慣;
2、經常清洗兒童的玩具和其他一些有可能被孩子放到口中的物品;
3、應經常用濕布抹去兒童能觸及到的部位的灰塵,食品和奶瓶的奶嘴上要加上罩子;
4、直接從事鉛作業勞動的工人下班前必須按規定洗澡、更衣後才能回家;
5、注意室內通風,特別是以煤為燃料的家庭應儘量多開窗通風;
6、家長不要在室內吸菸;
7、少食某些含鉛較高的食物,如松花蛋、爆米花等;
8、自來水中含鉛量不容忽視,每天早上用自來水時,應將水龍頭打開約1~5分鐘,以減少水中鉛污染,最好使用家用淨水器。推薦RO反滲透水過濾器。
9、兒童應定時進食,空腹時鉛在腸道的吸收率可成倍增加;
10、要保證兒童的日常膳食中含有足夠量的鈣、鐵、鋅等元素,以促進鉛的排出;
11、不要從地攤或者不正規的渠道購買了含鉛量超過規定標準的油畫棒或者蠟筆。
12、少帶孩子逛大街,減少汽車尾氣鉛污染危害。
鉛的問題
千萬不要輕信網上各種所謂的排鉛口服液,中國的保健行業標準尚且不夠完善,經常出現一些根本不具備其宣稱的保健療效的產品。
首先,要明白一點,血鉛進入人體後是十分難排出的,同時血鉛給人,尤其是兒童,造成的傷害是不可逆的。因此要格外重視血鉛超標問題,要定期去做檢測。
血鉛進入人體後相當大的比例以鹽的形式儲存在骨骼當中,且隨著人的壽命增加,骨中的鉛呈逐漸上升趨勢。骨中的鉛一般是不會轉化為血鉛的,因為其為不溶解的形式。但在某些條件下,骨中的鉛可以轉化為血鉛。
血鉛可以以尿液、汗液等方式排除,因此人成年後,一般情況下,血鉛的含量不會改變(動態平衡)。
對於兒童鉛超標(只要高於60就要積極應對,理想狀態時0),只有兩件事可做:一、杜絕可能吸收鉛的來源。二、補充均衡的膳食營養。所謂的排鉛口服液其實就是些高價的營養補充劑,通過食療完全可以得到比其更好的療效。
關於第一條,城市污染的大環境無法改變。因此,要儘量避免兒童站在馬路邊,因為尾氣中含有大量的鉛。
關於第二條,要多吃些富含礦物質(尤其是鐵和鈣)和維生素(尤其是C)的食物。這樣可以減少腸胃對鉛的吸收。
但是,以上兩條並不能“排鉛”,只能防止吸收更多的鉛。排鉛只能靠自身的代謝作用和血鉛轉換為不溶解的骨鉛的方式進行。即“進的少,出的多”,血鉛含量自然就會降低了。兒童的排鉛能力較為低下,因此等你孩子長大後,此情況會好轉。
如果血鉛含量過高(一般是因為職業病等因素),則必須通過服用藥物(金屬絡合劑,其易於與鉛結合而不易於與鈣、鐵等元素結合)進行治療。但此類藥物一般有副作用,可導致鈣等元素流失,因此必須在醫師的指導下進行。
危害防治
泄漏應急處理切斷火源。戴好防毒面具,穿好一般消防防護服。用潔淨的鏟子收集於乾燥淨潔有蓋的容器中,用水泥、瀝青或適當的熱塑性材料固化處理再廢棄。如大量泄漏,收集回收或無害處理後廢棄。
①對於泄漏的PbCl4和Pb(ClO4)2,應戴好防毒面具等全部防護用品。用乾砂土混合,分小批倒至大量水中,經稀釋的污水放入廢水系統。
②對於泄漏的PbO、四甲(乙)基鉛和Pb3O4,應戴好防毒面具等全部防護用品。用乾砂土混合後倒至空曠地掩埋;污染地面用肥皂或洗滌劑刷洗,經稀釋的污水放入廢水系統。
③對於泄漏的PbF2,應戴好防毒面具等全部防護用品。在泄漏物上撒上純鹼;被污染的地面用水沖洗,經稀釋的污水放入廢水系統。
④對於泄漏的Pb(BrO3)2、PbO2和Pb(NO3)2,應戴好防毒面具等全部防護用品。被污染的要面用水沖洗,經稀釋的污水放入廢水系統。
⑤對於泄漏的烷基鉛,用不燃性分散劑製成乳液刷洗。如無分散劑可用砂土吸收,倒至空曠地方掩埋;被污染的地面用肥皂或洗滌劑刷洗,經稀釋的污水放入廢水系統。
處理方法:當水體受到污染時,可採用中和法處理,即投加石灰乳調節pH到7.5,使鉛以氫氧化鉛形式沉澱而從水中轉入污泥中。用機械攪拌可加速澄清,淨化效果為80%~96%,處理後的水鉛濃度為0.37~0.40mg/L。而污泥再做進一步的無害化處理。對於受鉛污染的土壤,可加石灰、磷肥等改良劑,降低土壤中鉛的活性,減少作物對鉛的吸收。
防護措施
呼吸系統防護:作業工人應該佩戴防塵口罩。
眼睛防護:必要時可採用安全面罩。
防護服:穿工作服。 手防護:必要時戴防護手套。
其它:工作現場禁止吸菸、進食和飲水。工作後,淋浴更衣。實行就業前和定期的體檢。保持良好的衛生習慣。
急救措施
皮膚接觸:脫去污染的衣著,用肥皂水及流動清水徹底沖洗。
眼睛接觸:立即翻開上下眼瞼,用流動清水或生理鹽水沖洗。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。呼吸困難時給輸氧。呼吸停止時,立即進行人工呼吸。就醫。
食入:給飲足量溫水,催吐,就醫。
滅火方法
乾粉、砂土。
藥理作用
鉛在治療上很少套用,但在工業上用途很廣,慢性鉛中毒系重要職業病之一。鉛的吸收甚緩,主要經消化道及呼吸道吸收。吸收後絕大部分沉積於骨中。沉積骨中的鉛鹽並不危害身體,中毒的深淺主要決定於血液及組織中的含鉛量,血中鉛含量如超過0.05-0.1mg%,即產生中毒症狀。鈣與鉛的代謝有平行關係,凡能影響體內鈣代謝的因素也能影響鉛的代謝。鉛主要由腸與腎排泄,腸排泄量一般較腎多。尿中鉛量超過0.05-0.08mg/l時,應考慮有鉛中毒可能。慢性中毒症狀極為多樣化,特徵也多,主要有:腸胃道的紊亂如食欲不振、便秘(有時為腹瀉)、由於小腸痙攣而發生鉛絞痛,齒齦及頰黏膜上由於硫化鉛的沉著而形成的灰藍色鉛線等。神經系統受侵犯而發生頭痛、頭暈、疲乏、煩躁易怒、失眠,晚期可發展為鉛腦病,引起幻覺、譫妄、驚厥等;外周可發生多發性神經炎,出現鉛毒性癱瘓。中毒早期,血液中出現大量含嗜鹼性物質的幼稚紅細胞,如點彩紅細胞、網織紅細胞、多染色紅細胞等,一般認為這是骨髓中血細胞生長障礙的表現,晚期可抑制骨髓及破壞紅細胞而產生貧血。治療的特效藥為螯合劑依地酸鈣鈉,或青黴胺。二巰基丙醇療效常不可靠。
中藥化學成分
主要為金屬鉛,優良品中鉛可達99%;因礦石的質量、冶煉與精製方法之不同,常夾少量銀、金、錫、銻、鐵等其他金屬。在大氣中,因與氧氣、水氣、二氧化碳接觸,鉛表面常生成氧化鉛、鹼式碳酸鉛等的薄層而失去金屬光澤。
安全標誌
 安全標誌
安全標誌毒理資料
毒性
 含鉛物質標誌
含鉛物質標誌亞急性毒性:10μg/立方米,大鼠接觸30至40天,紅細胞膽色素原合酶(ALAD)活性減少80%~90%,血鉛濃度高達150~200μg/100ml。出現明顯中毒症狀。10μg/立方米,大鼠吸入3至12個月後,從肺部洗脫下來的巨噬細胞減少了60%,多種中毒症狀。0.01mg/立方米,人職業接觸,泌尿系統炎症,血壓變化,死亡,婦女胎兒死亡。
慢性毒性:長期接觸鉛及其化合物會導致心悸,易激動,血象紅細胞增多。鉛侵犯神經系統後,出現失眠、多夢、記憶減退、疲乏,進而發展為狂躁、失明、神志模糊、昏迷,最後因腦血管缺氧而死亡。血鉛水平往往要高於2.16微摩爾/升時,才會出現臨床症狀,因此許多兒童體內血鉛水平雖然偏高,但卻沒有特別的不適,輕度智力或行為上的改變也難以被家長或醫生髮現。這也是為什麼兒童鉛中毒在國外被稱為“隱匿殺手”的原因。
致癌:鉛的無機化合物的動物試驗表明可能引發癌症。另據文獻記載,鉛是一種慢性和積累性毒物,不同的個體敏感性很不相同,對人來說鉛是一種潛在性泌尿系統致癌物質。
致畸:沒有足夠的動物試驗能夠提供證據表明鉛及其化合物有致畸作用。
致突變:用含1%的醋酸鉛飼料餵小鼠,白細胞培養的染色體裂隙-斷裂型畸變的數目增加,這些改變涉及單個染色體,表明DNA複製受到損傷。
代謝和降解:環境中的無機鉛及其化合物十分穩定,不易代謝和降解。鉛對人體的毒害是積累性的,人體吸入的鉛25%沉積在肺里,部分通過水的溶解作用進入血液。若一個人持續接觸的空氣中含鉛1μg/立方米,則人體血液中的鉛的含量水平為1~2μg/100ml血。從食物和飲料中攝入的鉛大約有10%被吸收。若每天從食物中攝入10μg鉛,則血中含鉛量為6~18μg/100ml血,這些鉛的化合物小部分可以通過消化系統排出,其中主要通過尿(約76%)和腸道(約16%),其餘通過不大為人們所知道的各種途徑,如通過出汗、脫皮和脫毛髮以代謝的最終產物排出體外。
殘留與蓄積:鉛是一種積累性毒物,人類通過食物鏈攝取鉛,也能從被污染的空氣中攝取鉛,美國人肺中的含鉛量比非洲、近東和遠東地區都高,這是由於美國大氣中鉛污染比這些地區嚴重。人體解剖的結果證明,侵入人體的鉛70%~90%最後以磷酸鉛(PbHPO4)形式沉積並附著在骨骼組織上,現代美國人骨骼中的含鉛量和古代人相比高100倍。這一部分鉛的含量終生逐漸增加,而蓄積在人體軟組織包括血液中的鉛達到一定程度(人的成年初期)後,幾乎不再變化,多餘部分會自行排出體外(如上所述),表現出明顯的周轉率。魚類對鉛有很強的富集作用。
遷移和轉化:據加拿大渥太華國立研究理事會1978年對鉛在全世界環境中遷移研究報導,全世界海水中鉛的濃度均值為0.03μg/L,淡水0.5μg/L。全世界鄉村大氣中鉛含量均值為0.1μg/立方米,城市大氣中鉛的濃度範圍1~10μg/立方米。世界土壤和岩石中鉛的本底值平均為13mg/kg。鉛在世界土壤的環境轉歸情況是:每年從空氣到土壤15萬噸,從空氣轉移到海洋25萬噸,從土壤到海洋41.6萬噸。每年從海水轉移到底泥為40~60萬噸。由於水體、土壤、空氣中的鉛被生物吸收而向生物體轉移,造成全世界各種植物性食物中含鉛量均值範圍為0.1~1mg/kg(乾重),食物製品中的鉛含量均值為2.5mg/kg,魚體含鉛均值範圍0.2~0.6mg/kg,部分沿海受污染地區甲殼動物和軟體動物體內含鉛量甚至高達3000mg/kg以上。
鉛的工業污染來自礦山開採、冶煉、橡膠生產、染料、印刷、陶瓷、鉛玻璃、焊錫、電纜及鉛管等生產廢水和廢棄物。另外,汽車排氣中的四乙基鉛是劇毒物質。水體受鉛污染時(Pb0.3~0.5mg/L),明顯抑制水的自淨作用,2~4mg/L時,水即呈渾濁狀。
鉛及其化合物對人體有毒,攝取後主要貯存在骨骼內,部分取代磷酸鈣中的鈣,不易排出。中毒較深時引起神經系統損害,嚴重時會引起鉛毒性腦病,多見於四乙鉛的中毒。維生素B1和C、芸香苷可改進鉛中毒患者的新陳代謝,並加速鉛的排出。乙二胺四乙酸二鈉鈣等有驅鉛作用。中草藥金錢草煎劑等也能治鉛中毒。
危險特性
粉體在受熱、遇明火或接觸氧化劑時會引起燃燒爆炸。
燃燒產物
氧化鉛
應急監測
四羧醌試紙比色法《空氣中有害物質的測定方法》,杭士平主編
速測儀法;分光光度法;陽極溶出伏安法《突發性環境污染事故應急監測與處理處置技術》萬本太主編
實驗室監測
監測方法來源類別
原子吸收法GB7475-87水質
mcso-四(對磺基苯)卟啉光度法WS/T126-1999作業場所空氣
氫化物發生-原子吸收法WS/T127-1999作業場所空氣
原子吸收法GB/T15555.2-95固體廢物浸出液
石墨爐原子吸收法GB/T17141-1997土壤
火焰原子吸收法GB/T17140-1997土壤
火焰原子吸收法GB/T15264-94空氣品質
原子吸收法CJ/T101-99城市生活垃圾
原子吸收法《固體廢棄物試驗分析評價手冊[6]》中國環境監測總站等譯固體廢棄物
環境標準
中國(TJ36-79)車間空氣中有害物質的最高容許濃度0.03mg/立方米[鉛煙];0.05mg/立方米[鉛塵]
中國(TJ36-79)居住區大氣中有害物質的最高允許濃度0.0007mg/立方米(日均值)
中國(GB3095-1996)環境空氣品質標準季平均:1.50ug/立方米
年平均:1.00ug/立方米
中國(GB16297-1996)大氣污染物綜合排放標準(鉛及其化合物)①最高允許排放濃度(mg/立方米):
0.90(表1);0.70(表2)
②最高允許排放速率(kg/h):
二級0.005~0.39;三級0.007~0.60(表1)
二級0.004~0.33;三級0.006~0.51(表2)
③無組織排放監控濃度限值:
0.0060mg/立方米(表2);0.0075mg/立方米(表1)
中國(GB5749-2006)生活飲用水水質標準0.01mg/L
中國(GB3838-2002)地表水環境質量標準(mg/L)Ⅰ類0.01;Ⅱ類0.01;Ⅲ類0.05;Ⅳ類0.05;Ⅴ類0.1
中國(GB/T14848-93)地下水質量標準(mg/L)Ⅰ類0.005;Ⅱ類0.01;Ⅲ類0.05;Ⅳ類0.1;Ⅴ類>0.1
中國(GB3097-1997)海水水質標準(mg/L)Ⅰ類0.001;Ⅱ類0.005;Ⅲ類0.010;Ⅳ類0.050
中國(GB5048-92)農田灌溉水質標準0.1mg/L(水作、旱作、蔬菜)
中國(GB11607-89)漁業水質標準0.05mg/L
中國(GB8978-1996)污水綜合排放標準1.0mg/L
中國(GB15618-1995)土壤環境質量標準(mg/kg)一級35;二級250~350;三級500
中國(GB5058.3-2007)固體廢棄物浸出毒性鑑別標準值5mg/L
中國(GWKB3-2000)生活垃圾焚燒污染控制標準焚燒爐大氣污染物排放限值:1.6mg/立方米(測定均值)
中國(GB8172-87)城鎮垃圾農用控制標準100mg/kg
分布情況
概述
中國鉛鋅業生產布局,依據鉛鋅礦產地的分布和建設條件,經40多年來的發展、建設,現已形成東北、湖南、兩廣、滇川、西北等五大鉛鋅採選冶和加工配套的生產基地,其鉛產量占全國總產量的85%以上,鋅產量占全國總產量的95%。
東北生產基地
東北地區是中國開發較早的鉛鋅生產基地之一。早在50年代初期,其鉛產量占全國鉛產量的80%以上,在中國鉛鋅生產居於重要地位。東北基地以七礦兩廠為主,即青城子鉛鋅礦、八家子鉛鋅礦、柴河鉛鋅礦(現已閉坑)、桓仁銅鋅礦、紅透山銅鋅礦、西林鉛鋅礦(現已破產閉坑)、天寶山鉛鋅礦和瀋陽冶煉廠、葫蘆島鋅廠。七礦兩廠不僅是東北鉛鋅生產基地的支柱廠礦,也是培養造就科技人才的基地。六七十年代曾向全國新建的鉛鋅企業輸送大批具有實踐經驗的科技和管理人才以及生產技術工人,為中國鉛鋅業的發展做出了積極貢獻。
湖南生產基地
湖南鉛鋅礦產資源豐富,而且富礦多,大部分礦產地可開發利用。該基地鉛鋅廠礦是五六十年代建成的,由水口山礦務局、桃林鉛鋅礦、黃沙坪鉛鋅礦、東坡鉛鋅礦和株洲冶煉廠等組成的湖南鉛鋅生產基地,是當時全國自產原料的全國最大的鉛鋅生產基地,在全國產量占有重要地位。
兩廣生產基地
廣東、廣西兩省區的鉛鋅資源豐富,兩省區是70年代形成的我國大型鉛鋅生產基地之一。廣東以凡口鉛鋅礦和韶關冶煉廠為主,其次是丙村鉛鋅礦、昌化鉛鋅礦、大尖山鉛鋅礦。廣西有泗頂鉛鋅礦、大新鉛鋅礦、河三鉛鋅礦、柳州鋅品廠和大廠礦務局等。
滇川生產基地
雲南鉛鋅礦產資源十分豐富,現鉛鋅保有儲量均居全國之首。該基地鉛鋅企業也是五六十年代建成的,主要是會澤鉛鋅礦、瀾滄老廠鉛鋅礦和昆明冶煉廠、箇舊雞街冶煉廠。雲南鉛鋅礦產資源具有廣闊的開發前景,90年代開始興建超大型鉛鋅礦床金頂礦山。四川有會東鉛鋅礦、會理鉛鋅礦兩個主要礦山以及一批中小型礦山,鉛鋅精礦產量猛增。
西北生產基地
西北地區鉛鋅礦產資源也很豐富,主要分布在甘陝青三省,而且西成礦帶經勘查儲量又有大幅度的增長,資源前景十分可觀。該基地鉛鋅生產以白銀有色金屬公司為主,有白銀廠小鐵山鉛鋅礦、第三冶煉廠和西北鉛鋅冶煉廠,陝西有鉛硐山鉛鋅礦、二里河鉛鋅礦、銀洞梁鉛鋅礦等和青海錫鐵山礦務局。西北鉛鋅產量較少,但開發前景可觀。一是有豐富的鉛鋅礦產資源,位於甘陝交界的西成-鳳太礦帶,經近20餘年勘查出10多個大中型鉛鋅銀金礦床,其中廠壩-李家溝鉛鋅達到超大型規模,銀達到大型。二是廠壩正在抓緊建設一座大型礦山,將成為西北冶煉廠主要礦物原料供給基地,是全國大型鉛鋅礦山之一。
除上述五大鉛鋅生產基地外,內蒙古、江西、貴州等省區也建設了一批中小型礦山。其中內蒙古梧桐花鉛鋅礦、白音諾鉛鋅礦、翁牛特旗硐子鉛鋅礦等礦山。內蒙古是全國生產鉛鋅精礦主要省區之一,開發前景巨大。江西有銀山鉛鋅礦等。貴州有赫章鉛鋅礦、杉樹林鉛鋅礦等。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||

