發展
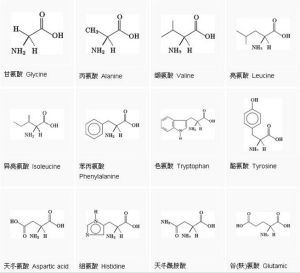
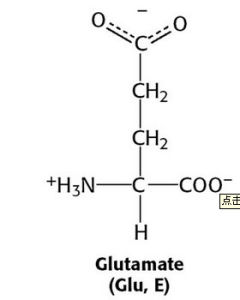 胺基酸
胺基酸我國的胺基酸產業發展很快,具有一定的規模,與世界胺基酸行業發展基本類似,很多國內企業生產的胺基酸都是用於食品加工。然而,藥用胺基酸的市場需求正在不斷增長,我國是有13億人口的大國,也是人口老年化發展進程非常迅速的國家,我國對藥用胺基酸及其衍生物的需求量和富含胺基酸飲品(口服液)需求量都十分巨大。近年來,中國胺基酸行業市場規模不斷擴大,至2011年行業規模以上企業銷售收入已達635.50億元。
隨著胺基酸行業競爭的不斷加劇,大型胺基酸企業間併購整合與資本運作日趨頻繁,國內優秀的胺基酸生產企業愈來愈重視對行業市場的研究,特別是對產業發展環境和產品消費者的深入研究。
簡介
 胺基酸
胺基酸胺基酸(amino acids)廣義上是指含有一個鹼性氨基又含有一個酸性羧基的有機化合物,但一般的胺基酸,則是指構成蛋白質的結構單位。胺基酸是構成生命大
廈的基本磚石之一。蛋白質是生物體內重要的活性分子,包括催化新陳代謝的酶。
兩個或兩個以上的胺基酸化學聚合成肽,一個蛋白質的原始片段,是蛋白質生成胺基酸的前體。胺基酸(aminoacids)廣義上是指既含有一個鹼性氨基又含有一個酸性羧基的有機化合物,正如它的名字所說的那樣。但一般的胺基酸,則是指構成蛋白質的結構單位。在生物界中,構成天然蛋白質的胺基酸具有其特定的結構特點,即其氨基直接連線在α-碳原子上,這種胺基酸被稱為α-胺基酸。在自然界中共有300多種胺基酸,其中α-胺基酸21種。α-胺基酸是肽和蛋白質的構件分子,也是構成生命大廈的基本磚石之一。
構成蛋白質的胺基酸都是一類含有羧基並在與羧基相連的碳原子下連有氨基的有機化合物,目前自然界中尚未發現蛋白質中有氨基和羧基不連在同一個碳原子上的胺基酸。胺基酸(胺基酸食品)是蛋白質(蛋白質食品)的基本成分。蜂王漿中含有20多種胺基酸。除蛋白氨酸、纈氨酸、異亮氨酸、賴氨酸、蘇氨酸、色氨酸、苯丙氨酸等人體本身不能合成、又必需的胺基酸外,還含有豐富的丙氨酸、谷氨酸、天門冬氨酸、甘氨酸、胱氨酸、脯氨酸、酷氨酸、絲氨酸等。科學家分析了蜂王漿(蜂王漿食品)中29種游離胺基酸及其衍生物,脯氨酸含量最高,占總胺基酸含量的58%。
基本結構
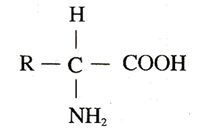 胺基酸通式
胺基酸通式胺基酸為分子結構中含有氨基(-NH2)和羧基(-COOH),並且氨基和羧基都直接連線在一個-CH-結構上的有機化合物。通式是H2NCHRCOOH,R基為可變基團。
除甘氨酸外,其它蛋白質胺基酸的α-碳原子均為不對稱碳原子,因此胺基酸可以有立體異構體,即鏇光異構,有兩種構型:D型和L型,組成蛋白質的胺基酸,都屬L型。
根據氨基連結在羧酸中碳原子的位置,可分為α、β、γ、δ……的胺基酸。
理化性質
物理特性
 胺基酸
胺基酸胺基酸為無色品體,熔點超過200℃,比一般有機化合物的熔點高很多。α一胺基酸有酸、甜、苦、鮮4種不同味感。谷氨酸單鈉鹽和甘氨酸是用量最大的鮮味調味料。氨基隘一般鄙溶於水、酸溶液和鹼溶液中,不溶或微溶於乙醇或乙醚等有機溶劑。胺基酸在水中的溶解度差別很大,例如酪氨酸的溶解度最小,25℃時,100g水中酪氨酸僅溶解0.045g,但在熱水巾酪氨酸的溶解度較大。賴氨酸和精氨胲常以鹽酸鹽的形式存在,因為它們極易溶於水,因潮解而難以製得結晶。
(1)色澤和顏色各種常見的胺基酸易成為無色結晶,結晶形狀因胺基酸的結構不同而有所差異。如L一谷氨酸為四角柱形結晶,D一谷氨酸則為菱形片狀結晶。
(2)熔點胺基酸結晶的熔點較高,一般在200~300℃,許多胺基酸在達到或接近熔點時會分解成胺和CO2。
(3)溶解度絕大部分胺基酸都能溶於水。不同胺基酸在水中的溶解度有差別,如賴氨酸、精氨酸、脯氨酸的溶解度較大,酪氨酸、半胱氨酸、組氨酸的溶解度很小。各種胺基酸都能溶於強鹼和強酸中。但胺基酸不溶或微溶於乙醇。
(4)味感胺基酸及其衍生物具有一定的味感,如酸、甜、苦、成等。其味感的種類與胺基酸的種類、立體結構有關。從立體結構上講,一般來說,D一型胺基酸都具有甜味,其甜味強度高於相應的L一型胺基酸。
(5)紫外吸收特性各種常見的胺基酸對可見光均無吸收能力。但酪氨酸、色氨酸和苯丙氨酸在紫外光區具有明顯的光吸收現象。而大多數蛋白質中都含有這3種胺基酸,尤其是酪氨酸。因此,可以利用280hm波長處的紫外吸收特性定量檢測蛋白質的含量。
胺基酸的一個重要光學性質是對光有吸收作用。20種Pr——AA在可見光區域均無光吸收,在遠紫外區(<220nm)均有光吸收,在紫外區(近紫外區)(220nm~300nm)只有三種AA有光吸收能力,這三種胺基酸是苯丙氨酸、酪氨酸、色氨酸,因為它們的R基含有苯環共軛雙鍵系統。苯丙AA最大光吸收在259nm、酪AA在278nm、色AA在279nm,蛋白質一般都含有這三種AA殘基,所以其最大光吸收在大約280nm波長處,因此能利用分光光度法很方便的測定蛋白質的含量。分光光度法測定蛋白質含量的依據是朗伯—比爾定律。在280nm處蛋白質溶液吸光值與其濃度成正比。
化學特性
胺基酸具有兩性,即大多數胺基酸都呈顯不同程度的酸性和鹼性,呈顯中性的較少。所以既能與酸結合成鹽,也能與鹼結合成鹽。
胺基酸解離常數列表:
| 縮寫 | 中文譯名 | 支鏈 | 分子量 | 等電點 | 羧基解離常數 | 氨基解離常數 | Pkr(R) | R基 | |
|---|---|---|---|---|---|---|---|---|---|
| Gly | G | 甘氨酸 | 親水性 | 75.07 | 6.06 | 2.35 | 9.78 | -H | |
| Ala | A | 丙氨酸 | 疏水性 | 89.09 | 6.11 | 2.35 | 9.87 | -CH₃ | |
| Val | V | 纈氨酸 | 疏水性 | 117.15 | 6.00 | 2.39 | 9.74 | -CH-(CH₃)₂ | |
| Leu | L | 亮氨酸 | 疏水性 | 131.17 | 6.01 | 2.33 | 9.74 | -CH₂-CH(CH₃)₂ | |
| Ile | I | 異亮氨酸 | 疏水性 | 131.17 | 6.05 | 2.32 | 9.76 | -CH(CH₃)-CH₂-CH₃ | |
| Phe | F | 苯丙氨酸 | 疏水性 | 165.19 | 5.49 | 2.20 | 9.31 | -CH₂-C₆H₅ | |
| Trp | W | 色氨酸 | 疏水性 | 204.23 | 5.89 | 2.46 | 9.41 | -C₈NH₆ | |
| Tyr | Y | 酪氨酸 | 疏水性 | 181.19 | 5.64 | 2.20 | 9.21 | 10.46 | -CH₂-C₆H₄-OH |
| Asp | D | 天冬氨酸 | 酸性 | 133.10 | 2.85 | 1.99 | 9.90 | 3.90 | -CH₂-COOH |
| Asn | N | 天冬醯胺 | 親水性 | 132.12 | 5.41 | 2.14 | 8.72 | -CH₂-CONH₂ | |
| Glu | E | 谷氨酸 | 酸性 | 147.13 | 3.15 | 2.10 | 9.47 | 4.07 | -(CH₂)₂-COOH |
| Lys | K | 賴氨酸 | 鹼性 | 146.19 | 9.60 | 2.16 | 9.06 | 10.54 | -(CH₂)₄-NH₂ |
| Gln | Q | 谷氨醯胺 | 親水性 | 146.15 | 5.65 | 2.17 | 9.13 | -(CH₂)₂-CONH₂ | |
| Met | M | 甲硫氨酸 | 疏水性 | 149.21 | 5.74 | 2.13 | 9.28 | -(CH₂)-S-CH₃ | |
| Ser | S | 絲氨酸 | 親水性 | 105.09 | 5.68 | 2.19 | 9.21 | -CH₂-OH | |
| Thr | T | 蘇氨酸 | 親水性 | 119.12 | 5.60 | 2.09 | 9.10 | -CH(CH₃)-OH | |
| Cys | C | 半胱氨酸 | 親水性 | 121.16 | 5.05 | 1.92 | 10.70 | 8.37 | -CH₂-SH |
| Pro | P | 脯氨酸 | 疏水性 | 115.13 | 6.30 | 1.95 | 10.64 | -C₃H₆ | |
| His | H | 組氨酸 | 鹼性 | 155.16 | 7.60 | 1.80 | 9.33 | 6.04 | |
| Arg | R | 精氨酸 | 鹼性 | 174.20 | 10.76 | 1.82 | 8.99 | 12.48 |
性質
纈氨酸
 胺基酸
胺基酸無色晶體,熔點極高,一般在200℃以上。不同的胺基酸其味不同,有的無味,有的味甜,有的味苦,谷氨酸的單鈉鹽有鮮味,是味素的主要成分。各種胺基酸在水中的溶解度差別很大,並能溶解於稀酸或稀鹼中,但不能溶於有機溶劑。通常酒精能把胺基酸從其溶液中沉澱析出。
紫外吸收性質
胺基酸的一個重要光學性質是對光有吸收作用。20種Pr——AA在可見光區域均無光吸收,在遠紫外區(<220nm)均有光吸收,在紫外區(近紫外區)(220nm—300nm)只有三種AA有光吸收能力,這三種胺基酸是苯丙氨酸、酪氨酸、色氨酸,因為它們的R基含有苯環共軛雙鍵系統。苯丙AA最大光吸收在259nm、酪AA在278nm、色AA在279nm,蛋白質一般都含有這三種AA殘基,所以其最大光吸收在大約280nm波長處,因此能利用分光光度法很方便的測定蛋白質的含量。分光光度法測定蛋白質含量的依據是朗伯—比爾定律。在280nm處蛋白質溶液吸光值與其濃度成正比。
酸鹼性質
1、兩性解離與等電點
 胺基酸
胺基酸胺基酸在水溶液或結晶內基本上均以兼性離子或偶極離子的形式存在。所謂兩性離子是指在同一個胺基酸分子上帶有能釋放出質子的NH3正纈氨酸離子和能接受質子的COO-負離子,因此胺基酸是兩性電解質。
胺基酸的等電點:胺基酸的帶電狀況取決於所處環境的PH值,改變PH值可以使胺基酸帶正電荷或負電荷,也可使它處於正負電荷數相等,即淨電荷為零的兩性離子狀態。使胺基酸所帶正負電荷數相等即淨電荷為零時的溶液PH值稱為該AA
2、解離常數
解離式中K1和K2′分別代表α-碳原子上-COOH和-NH3的表現解離常數。在生化上,解離常數是在特定條件下(一定溶液濃度和離子強度)測定的。等電點的計算可由其分子上解離基團的表觀解離常數來確定。
3、多氨基(鹼性胺基酸)和多羧基(酸性胺基酸)胺基酸的解離
解離原則:先解離α-COOH,隨後其他-COOH;然後解離α-NH3+,隨後其他-NH3。總之羧基解離度大於氨基,α-C上基團大於非α-C上同一基團的解離度。等電點的計算:首先寫出解離方程,兩性離子左右兩端的表觀解離常數的對數的算術平均值。一般pI值等於兩個相近PK值之和的一半。如天冬氨酸賴氨酸。
4、胺基酸的酸鹼滴定曲線
以甘氨酸為例:摩爾甘氨酸溶於水時,溶液PH為5.97,分別用標準NaOH和HCL滴定,以溶液PH值為縱坐標,加入HCL和NaOH的摩爾數為橫坐標作圖,得到滴定曲線。該曲線一個十分重要的特點就是在PH=2.34和PH=9.60處有兩個拐點,分別為其PK1和PK2。規律:pH<pK1′時,[R]>[R±]>[R];pH>pK2′時,[R]>[R±]>[R+];pH=pI時,淨電荷為零,[R]=[R-];pH<pI時,淨電荷為“+”;pH>pI時,淨電荷為“-”。
蛋白質胺基酸
分類
20種蛋白質胺基酸在結構上的差別取決於側鏈基團R的不同。通常根據R基團的化學結構或性質將20種胺基酸進行分類。
側鏈基團極性分類1、非極性胺基酸:丙氨酸、纈氨酸、亮氨酸、異亮氨酸、脯氨酸、苯丙氨酸、色氨酸、甲硫氨酸
2、極性胺基酸:
1)極性不帶電荷胺基酸:甘氨酸、絲氨酸、蘇氨酸、半胱氨酸、酪氨酸、天冬醯胺、谷氨醯胺
2)極性帶正電荷的胺基酸(鹼性胺基酸):賴氨酸、精氨酸、組氨酸
3)極性帶負電荷的胺基酸(酸性胺基酸):天冬氨酸、谷氨酸
胺基酸分子化學結構分類1、脂肪族胺基酸:丙氨酸、纈氨酸、亮氨酸、異亮氨酸、甲硫氨酸、天冬氨酸、谷氨酸、賴氨酸、精氨酸、甘氨酸、絲氨酸、蘇氨酸、半胱氨酸、天冬醯胺、谷氨醯胺
2、芳香族胺基酸:苯丙氨酸、酪氨酸
3、雜環族胺基酸:組氨酸、色氨酸
4、雜環亞胺基酸:脯氨酸
營養學角度分類1、必需胺基酸(essentialaminoacid):指人體(或其它脊椎動物)不能合成或合成速度遠不適應機體的需要,必需由食物蛋白供給的胺基酸。成人必需胺基酸的需要量約為蛋白質需要量的20%-37%。共有8種其作用分別是:
賴氨酸:促進大腦發育,是肝及膽的組成成分,能促進脂肪代謝,調節松果腺、乳腺、黃體及卵巢,防止細胞退化。
色氨酸:促進胃液及胰液的產生。
苯丙氨酸:參與消除腎及膀胱功能的損耗。
甲硫氨酸:參與組成血紅蛋白、組織與血清,有促進脾臟、胰臟及淋巴的功能。
蘇氨酸:有轉變某些胺基酸達到平衡的功能。
異亮氨酸:參與胸腺、脾臟及腦下腺的調節以及代謝;腦下腺屬總司令部作用於甲狀腺、性腺。
亮氨酸:作用平衡異亮氨酸。
纈氨酸:作用於黃體、乳腺及卵巢。
2、半必需胺基酸和條件必需胺基酸:
精氨酸:精氨酸與脫氧膽酸製成的複合製劑(明諾芬)是主治梅毒、病毒性黃疸等病的有效藥物。
組氨酸:可作為生化試劑和藥劑,還可用於治療心臟病,貧血,風濕性關節炎等的藥物。
人體雖能夠合成精氨酸和組氨酸,但通常不能滿足正常的需要,因此,又被稱為半必需胺基酸或條件必需胺基酸,在幼兒生長期這兩種是必需胺基酸。人體對必需胺基酸的需要量隨著年齡的增加而下降,成人比嬰兒顯著下降。
3、非必需胺基酸(nonessentialaminoacid):指人(或其它脊椎動物)自己能由簡單的前體合成,不需要從食物中獲得的胺基酸。例如甘氨酸、丙氨酸等。
檢測
1、茚三酮反應(ninhydrinreaction)
試劑顏色備註
茚三酮(弱酸環境加熱)藍色(脯氨酸、羥脯氨酸為黃色)(檢驗α-氨基)
2、坂口反應(Sakaguchireaction)
α-萘酚+鹼性次溴酸鈉紅色(檢驗胍基精氨酸有此反應)
3、米隆反應
HgNO3+HNO3+熱紅色(檢驗酚基酪氨酸有此反應)
4、Folin-Ciocalteau反應
磷鎢酸-磷鉗酸藍色(檢驗酚基酪氨酸有此反應)
5、黃蛋白反應
濃硝酸煮沸黃色(檢驗苯環酪氨酸、苯丙氨酸、色氨酸有此反應)
6、Hopkin-Cole反應(乙醛酸反應)
乙醛酸+濃H2SO4乙醛與濃H2SO4接觸面處產生紫紅色環(檢驗吲哚基色氨酸有此反應)
7、Ehrlich反應
P-二甲氨基苯甲醛+濃鹽酸藍色(檢驗吲哚基色氨酸有此反應)
8、硝普鹽試驗
Na2(NO)Fe(CN)2*2H2O+稀氨水紅色(檢驗巰基半胱氨酸有此反應)
9、Sulliwan反應
1,2萘醌、4磺酸鈉+Na2SO3紅色(檢驗巰基半胱氨酸有此反應)
10、Folin反應
1,2萘醌、4磺酸鈉在鹼性溶液深紅色(檢驗α-胺基酸)
肽鍵(peptidebond):一個胺基酸的羧基與另一個胺基酸的氨基縮合,除去一分子水形成的醯胺鍵。
肽(peptide):兩個或兩個以上氨基通過肽鍵共價連線形成的聚合物。是胺基酸通過肽鍵相連的化合物,蛋白質不完全水解的產物也是肽。肽按其組成的胺基酸數目為2個、3個和4個等不同而分別稱為二肽、三肽和四肽等,一般含10個以下胺基酸組成的稱寡肽(oligopeptide),由10個以上胺基酸組成的稱多肽(polypeptide),它們都簡稱為肽。肽鏈中的胺基酸已不是游離的胺基酸分子,因為其氨基和羧基在生成肽鍵中都被結合掉了,因此多肽和蛋白質分子中的胺基酸均稱為胺基酸殘基(aminoacidresidue)。
多肽有開鏈肽和環狀肽。在人體內主要是開鏈肽。開鏈肽具有一個游離的氨基末端和一個游離的羧基末端,分別保留有游離的α-氨基和α-羧基,故又稱為多肽鏈的N端(氨基端)和C端(羧基端),書寫時一般將N端寫在分子的左邊,並用(H)表示,並以此開始對多肽分子中的胺基酸殘基依次編號,而將肽鏈的C端寫在分子的右邊,並用(OH)來表示。目前已有約20萬種多肽和蛋白質分子中的肽段的胺基酸組成和排列順序被測定了出來,其中不少是與醫學關係密切的多肽,分別具有重要的生理功能或藥理作用。
多肽在體內具有廣泛的分布與重要的生理功能。其中谷胱甘肽在紅細胞中含量豐富,具有保護細胞膜結構及使細胞內酶蛋白處於還原、活性狀態的功能。而在各種多肽中,谷胱甘肽的結構比較特殊,分子中谷氨酸是以其γ-羧基與半胱氨酸的α-氨基脫水縮合生成肽鍵的,且它在細胞中可進行可逆的氧化還原反應,因此有還原型與氧化型兩種穀胱甘肽。
近年來一些具有強大生物活性的多肽分子不斷地被發現與鑑定,它們大多具有重要的生理功能或藥理作用,又如一些“腦肽”與機體的學習記憶、睡眠、食慾和行為都有密切關係,這增加了人們對多肽重要性的認識,多肽也已成為生物化學中引人矚目的研究領域之一。
多肽和蛋白質的區別,一方面是多肽中胺基酸殘基數較蛋白質少,一般少於50個,而蛋白質大多由100個以上胺基酸殘基組成,但它們之間在數量上也沒有嚴格的分界線,除分子量外,現在還認為多肽一般沒有嚴密並相對穩定的空間結構,即其空間結構比較易變具有可塑性,而蛋白質分子則具有相對嚴密、比較穩定的空間結構,這也是蛋白質發揮生理功能的基礎,因此一般將胰島素劃歸為蛋白質。但有些書上也還不嚴格地稱胰島素為多肽,因其分子量較小。但多肽和蛋白質都是胺基酸的多聚縮合物,而多肽也是蛋白質不完全水解的產物。
主要功能
組成蛋白質
胺基酸是構成蛋白質的最基本物質,與生物的生命活動有著密切的關係。胺基酸通過肽鍵連線起來成為肽與蛋白質,兩個或兩個以上的胺基酸脫水縮合成肽,它是一個蛋白質的原始片段,是蛋白質生成的前體。人體對蛋白質的需要實際上是對胺基酸的需要。
調節代謝平衡
如果人體缺乏任何一種必需胺基酸,就可導致生理功能異常,影響抗體代謝的正常進行,最後導致疾病。同樣,如果人體內缺乏某些非必需胺基酸,會產生抗體代謝障礙。精氨酸和瓜氨酸對形成尿素十分重要;胱氨酸攝入不足就會引起胰島素減少,血糖升高。
食物營養作用
食物中的有效成分稱為營養素。 胺基酸作為營養素,有以下作用。
幫助蛋白質在機體內被消化和吸收作為機體內第一營養要素的蛋白質,它在食物營養中的作用是顯而易見的,但它在人體內並不能直接被利用,而是通過變成胺基酸小分子後被利用的。即它在人體的胃腸道內並不直接被人體所吸收,而是在胃腸道中經過多種消化酶的作用,將大分子蛋白質分解為小分子的多肽或胺基酸後,在小腸內被吸收,沿著肝門靜脈進入肝臟。一部分胺基酸在肝臟內進行分解或合成蛋白質;另一部分胺基酸繼續隨血液分布到各個組織器官,任其選用,合成各種特異性的組織蛋白質。
起氮平衡作用當每日膳食中蛋白質的質和量適宜時,攝入的氮量由糞、尿和皮膚排出的氮量相等,稱之為氮的總平衡。實際上是蛋白質和胺基酸之間不斷合成與分解之間的平衡。正常人每日食進的蛋白質應保持在一定範圍內,突然增減食入量時,機體尚能調節蛋白質的代謝量維持氮平衡。食入過量蛋白質,超出機體調節能力,平衡機制就會被破壞。完全不吃蛋白質,體內組織蛋白依然分解,持續出現負氮平衡,如不及時採取措施糾正,終將導致個體死亡。
轉成糖或脂肪胺基酸分解代謝所產生的a-酮酸,隨著不同特性,循糖或脂的代謝途徑進行代謝。a-酮酸可再合成新的胺基酸,或轉變為糖或脂肪,或進入三羧循環氧化分解成CO2和H2O,並放出能量。
產生一碳單位某些胺基酸分解代謝過程中產生含有一個碳原子的基團,包括甲基和亞甲基等。
一碳單位具有兩個特點:不能在生物體內以游離形式存在;必須以四氫葉酸為載體。
參與構成酶、激素、部分維生素酶的化學本質是蛋白質,含氮激素的成分是蛋白質或其衍生物,有的維生素是由胺基酸轉變或與蛋白質結合存在。酶、激素、維生素在調節生理機能、催化代謝過程中起著十分重要的作用。
醫療套用
胺基酸在醫藥上主要用來製備胺基酸注射液,也用作治療藥物和用於合成多肽藥物。用作藥物的胺基酸有一百幾十種,其中包括構成蛋白質的胺基酸有20種和非構成蛋白質的胺基酸有100多種。
由多種胺基酸組成的複方製劑在現代靜脈營養輸液以及“要素飲食”療法中占有非常重要的地位,對維持危重病人的營養,搶救患者生命起積極作用,成為現代醫療中不可少的醫藥品種之一。胺基酸主要用於治療肝病疾病、消化道疾病、腦病、心血管病和呼吸道疾病,也常用於提高肌肉活力、兒科營養和解毒等。
含胺基酸食物
胺基酸含量比較豐富的食物有魚類、豆類、花生、杏仁、香蕉、雞蛋、銀耳和新鮮果蔬,動物內臟、瘦肉、乳類、山藥、藕等含胺基酸也較多。
賴氨酸:鱔魚、泥鰍、魷魚、帶魚、鰻魚、海參、墨魚、蝸牛,其次有山藥、銀杏、凍豆腐、豆腐皮。
亮氨酸:存在於動物蛋白質和奶製品中,如牛奶、乳製品、蛋、豬肉、牛肉、雞肉、豆類等,全谷、葉菜、燕麥和小麥胚芽中也發現有亮氨酸存在,同時大蒜黑木耳也含有豐富的亮氨酸。
色氨酸:含色氨酸最多的是小米,每100克含色氨酸202mg,此外,牛奶、香菇、葵花子、海蟹、黑芝麻、黃豆、南瓜子、肉鬆、油豆腐、雞蛋、魚片等也是富含色氨酸的食物。
蛋氨酸:豆製品,黑芝麻醬,海藻類含有豐富蛋氨酸。
蘇氨酸:發酵食品(穀物製品)、雞蛋、茼蒿、奶、花生、米、胡蘿蔔、葉菜類、番木瓜、苜蓿等。
纈氨酸:白乾酪、魚、禽類、牛、花生、芝麻籽和濱豆。
精氨酸:被稱為“大腦食糧”。
異亮氨酸:糙米,豆類,肉類,堅果,大豆粉,和全麥。
苯丙氨酸:苯丙氨酸在大部分的食物里都可以找到。肉和奶製品中苯丙氨酸的含量尤其的高,燕麥和小麥胚芽里苯丙氨酸的含量很低。
必需胺基酸
人體所需的胺基酸約有22種,分非必需胺基酸和必需胺基酸(須從食物中供給)。
必需胺基酸指人體不能合成或合成速度遠不適應機體的需要,必需由食物蛋白供給,這些胺基酸稱為必需胺基酸。共有10種其作用分別是:
(一)賴氨酸:促進大腦發育,是肝及膽的組成成分,能促進脂肪代謝,調節松果腺、乳腺、黃體及卵巢,防止細胞退還;
(二)色氨酸:促進胃液及胰液的產生;
(三)苯丙氨酸:參與消除腎及膀胱功能的損耗;
(四)蛋氨酸;參與組成血紅蛋白、組織與血清,有促進脾臟、胰臟及淋巴的功能;
(五)蘇氨酸:有轉變某些胺基酸達到平衡的功能;
(六)異亮氨酸:參與胸腺、脾臟及腦下腺的調節以及代謝;腦下腺屬總司令部作用於(1)甲狀腺(2)性腺;
(七)亮氨酸:作用平衡異亮氨酸;
(八)纈氨酸:作用於黃體、乳腺及卵巢。
(九)組氨酸:作用於代謝的調節;
(十)精氨酸:促進傷口癒合,精子蛋白成分。
代謝途徑
脫氨基作用
細胞內從有機化合物分子上除去氨基的酶促反應,是機體內胺基酸代謝的第一步。脫氨基作用有氧化脫氨、非氧化脫氨和聯合脫氨等方式。其中以聯合脫氨基最為重要。
轉氨基作用
轉氨作用是胺基酸脫氨的重要方式,除Gly、Lys、Thr、Pro外,大部分胺基酸都能參與轉氨基作用。α-胺基酸和α-酮酸之間發生氨基轉移作用,結果是原來的胺基酸生成相應的酮酸,而原來的酮酸生成相應的胺基酸。
脫羧作用
生物體內大部分胺基酸可進行脫羧作用,生成相應的一級胺。胺基酸脫羧酶專一性很強,每一種胺基酸都有一種脫羧酶,輔酶都是磷酸吡哆醛。胺基酸脫羧反應廣泛存在於動、植物和微生物中,有些產物具有重要生理功能,如腦組織中L-Glu脫羧生成r-氨基丁酸,是重要的神經介質。His脫羧生成組胺,有降低血壓的作用。Tyr脫羧生成酪胺,有升高血壓的作用。但大多數胺類對動物有毒,體內有胺氧化酶,能將胺氧化為醛和氨。
合成
 胺基酸
胺基酸組成蛋白質的大部分胺基酸是以埃姆登-邁耶霍夫(Embden-Meyerhof)途徑與檸檬酸循環的中間物為碳鏈骨架生物合成的。例外的是芳香族胺基酸、組氨酸,前者的生物合成與磷酸戊糖的中間物赤蘚糖-4-磷酸有關,後者是由ATP與磷酸核糖焦磷酸合成的。
微生物和植物能在體內合成所有的胺基酸,動物有一部分胺基酸不能在體內合成。必需胺基酸一般由碳水化合物代謝的中間物,經多步反應(6步以上)而進行生物合成的,非必需胺基酸的合成所需的酶約14種,而必需胺基酸的合成則需要更多的,約有60種酶參與。
生物合成的胺基酸除作為蛋白質的合成原料外,還用於生物鹼、木質素等的合成。另一方面,胺基酸在生物體內由於氨基轉移或氧化等生成酮酸而被分解,或由於脫羧轉變成胺後被分解。
相關事件
 孝感一中教室
孝感一中教室2012年5月5日,聯考臨近,孝感一中一個高三班的學生集體在教室內打吊瓶補充胺基酸,教室半空中拉上了鐵絲,掛著很多吊瓶,不少同學正在一邊學習一邊打吊瓶,整個教室至少有20瓶吊瓶。校方及學生認為胺基酸能促進大腦發育,防止細胞退化,可以補充能量。
華中科技大學同濟醫學院營養與食品衛生系教授黃連珍表示,這種補充胺基酸的方法完全沒必要,不值得提倡。胺基酸來源自蛋白質,平時的食物如雞蛋、牛奶、豬肉中,都含有大量的蛋白質,特別是雞蛋,是完全的動物蛋白質,營養價值高,高三學生通過正常飲食,比如一天吃一兩個雞蛋或喝點牛奶,就可以獲得足夠的胺基酸。另外,大腦的活動不僅僅需要胺基酸,還需要其他物質,比如糖分,而經常打胺基酸還可能造成營養不均衡等現象。
密碼子表
密碼子(codonm),RNA分子中每相鄰的三個核苷酸編成一組,在蛋白質合成時,代表某一種胺基酸。科學家已經發現,信使RNA在細胞中能決定蛋白質分子中的胺基酸種類和排列次序。也就是說,信使RNA分子中的四種核苷酸(鹼基)的序列能決定蛋白質分子中的20種胺基酸的序列。鹼基數目與胺基酸種類、數目的對應關係是怎樣的呢?為了確定這種關係,研究人員在試管中加入一個有120個鹼基的信使RNA分子和合成蛋白質所需的一切物質,結果產生出一個含40個胺基酸的多肽分子。可見,信使RNA分子上的三個鹼基能決定一個胺基酸。
人體作用
胺基酸的作用有很多,它能夠將我們人體內有毒物質排出體外,有效的減輕輻射、污染對人體所造成的傷害。排除機體在劇烈的運動以後體內的代謝產物,從而具有促進精神、機體、肌肉等多方面的快速恢復,因此對提高機體機能有很好的幫助。