簡介
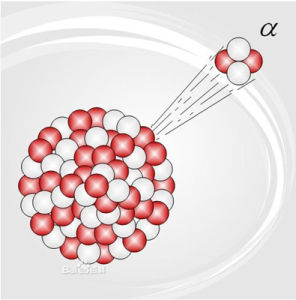
α粒子
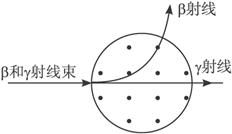 阿爾法射線
阿爾法射線通常具有放射性而原子量較大的化學元素,會透過α衰變放射出α粒子,從而變成較輕的元素,直至該元素穩定為止。由於α粒子的體積比較大,又帶兩個正電荷,很容易就可以電離其他物質。因此,它的能量亦散失得較快,穿透能力在眾多電離輻射中是最弱的,人類的皮膚或一張紙已能隔阻α粒子。但是它有很強的電離本領。α粒子就是氦原子核。
α射線
α射線,也稱“甲種射線”。是放射性物質所放出的α粒子流。它可由多种放射性物質(如鐳)發射出來。α粒子的動能可達4-9MeV。從α粒子在電場和磁場中偏轉的方向,可知它們帶有正電荷。由於α粒子的質量比電子大得多,通過物質時極易使其中的原子電離而損失能量,所以它能穿透物質的本領比β射線弱得多,容易被薄層物質所阻擋,但是它有很強的電離作用。從α粒子的質量和電荷的測定,確定α粒子就是氦的原子核。
α射線是一種帶電粒子流,由於帶電,它所到之處很容易引起電離。α射線有很強的電離本領,這種性質既可利用。也帶來一定破壞性,對人體內組織破壞能力較大。由於其質量較大,穿透能力差,在空氣中的射程只有幾厘米,只要一張紙或健康的皮膚就能擋住。
發現
盧瑟福1898年發現鈾和鈾的化合物所發出的射線有兩種不同類型:一種是極易吸收的,他稱之為α射線;另一種有較強的穿透能力,他稱之為β射線。後來法國化學家維拉爾又發現具有更強穿透本領的第三種射線γ射線。由於組成α射線的α粒子帶有巨大能量和動量,就成為盧瑟福用來打開原子大門、研究原子內部結構的有力工具。
盧瑟福用鐳發射的α粒子作“炮彈”,用“閃爍法”觀察被轟擊的粒子的情況。1919年,終於觀察到氮原子核俘獲一個α粒子後放出一個氫核,同時變成了另一種原子核的結果,這個新生的原子核後來被證實為是氧17原子核。這是人類歷史上第一次實現原子核的人工嬗變,使古代鍊金術士夢寐以求的把一種元素變成另一種元素的空想有可能成為現實。當時盧瑟福寫了一本書就取名為《新鍊金術》。
危害
只釋放出α粒子的放射性同位素在人體外部不構成危險。然而,釋放α粒子的物質(鐳、鈾等等)一旦被吸入或注入,那將十分危險,它能直接破壞細胞內的DNA。
相互作用
非彈性
 阿爾法射線
阿爾法射線如果在相互作用過程中,殼層電子獲得的能量不足以使它脫離原子而成為自由電子,而僅僅使電子從低能級躍遷到高能級,使原子處於激發態,這種相互作用就稱為激發。受激的原子隨即發射出一定能量的X射線而回到基態。該激發能也可傳遞給核外電子,使該電子獲得足夠的能量逃離原子核的束縛而成為一個自由電子(即俄歇電子),此過程稱為俄歇效應。
彈性
α粒子在物質中運動時,還會受到原子核及核外電子的庫侖場與核力場的相互作用,從而改變其運動方向,這種現象稱之為散射。根據散射前後α粒子和散射核的總動能是否守恆可分為彈性散射和非彈性散射。
α粒子可以與核外電子發生彈性碰撞(elasticimpact/collision),要求α粒子傳遞給核外電子的能量小於其最低激發能;α粒子也可與原子核發生彈性碰撞,α粒子損失能量,而原子核獲得動能發生反衝,引起晶格原子位移形成缺陷,即引起輻射損傷。稱為核碰撞能量損失或從吸收介質的作用來講稱為核阻止。
核反庫侖
核反應(nuclearreaction):α粒子引起核反應的機率相當小,它與Be、B、F、Li、Na、O等元素相互作用發生(α,n)反應時將產生中子,這是目前製備同位素中子源的主要方法。
庫侖激發(Coulombexcitation):α粒子與原子核之間的庫侖相互作用可能引起介質原子核從基態躍遷到激發態,稱為庫侖激發。