研究簡史
發現簡史
錳最早的使用可以追溯到石器時代。早在17000年前,錳的氧化物(軟錳礦)就被舊石器時代晚期的人們當作顏料用於洞穴的壁畫上,後來在古希臘斯巴達人使用的武器中也發現了錳。古埃及人和古羅馬人則使用錳礦給玻璃脫色或染色。
 甘恩
甘恩 雖然軟錳礦很早就被人們所利用 ,但是,一直到18世紀的70年代以前,西方化學家們仍認為軟錳礦是含錫、鋅和鈷等的礦物。18世紀後期,瑞典化學家T.O.柏格曼研究了軟錳礦,認為它是一種新金屬氧化物,並曾試圖分離出這個金屬,卻沒有成功。瑞典化學家舍勒也同樣沒有從軟錳礦中提取出金屬,便求助於他的好友、柏格曼的助手——甘恩。1774年,甘恩用舍勒提純的軟錳礦粉和木炭在坩堝中加熱一小時後得到了紐扣狀的金屬錳塊 ,柏格曼將它命名為manganese。
國外發展歷史
 錳黝簾石
錳黝簾石 19世紀初期 ,英國和法國的科學家開始研究錳在鋼鐵製造中的套用,並分別於1799年和1808年在英國獲得了認可。1816年,一位德國研究者發現錳能增強鐵的硬度,卻不會降低鐵的延展性和韌性。1826年,德國的皮埃格在坩堝中製造出含錳量為80%的錳鋼。1840年,J.M.希茨在英國生產出金屬錳。1841,帕薩開始了鏡鐵的工業化規模生產。1875年,帕薩開始了含錳量為65%的錳鐵的商業生產。
1860年,錳的套用有了重大突破。貝塞麥當時正在盡力研製以他的名字命名的制鋼工藝,但是他卻遇到了難題——鋼中殘留了過多的氧氣和硫。這個難題在1856年的時候被馬希特解決了,他建議貝塞麥將鏡鐵(含錳量較低的錳鐵)加入到鋼水用於除硫。貝塞麥法的誕生標誌著早期工業革命的"鐵時代"向"鋼時代"的演變,這在冶金髮展史上具有劃時代的意義。
1866年,威廉·西門子在煉鋼過程中使用錳鐵控制磷和硫的含量,並將該方法申請專利。1868年,勒克朗謝製造出第一塊乾電池,後經改進,該電池使用二氧化錳作為乾電池的陰極去極化劑,錳在電池領域的套用推動了二氧化錳需求的增長。1875年以後,歐洲各國開始用高爐生產含錳15%~30%的鏡鐵和含錳達80%的錳鐵。1890年電爐生產錳鐵的工藝誕生,1898年鋁熱法生產金屬錳的方法出現,電爐脫矽精煉法也被用於生產低碳錳鐵。1939年開始用電解法生產金屬錳。隨著技術的不斷改進,錳年產量也在不斷增加。根據美國地質調查局2015年公布的數據,2013年全球錳礦產量約為1800萬噸。錳的消費領域也不斷擴大,除了大部分用於鋼鐵領域外,還被廣泛用於電池、化工、電子、農業、醫學等領域中 。
國內發展歷史
我國錳礦的地質找礦工作始於1886年 ,並於1890年首先在湖北興國州(今陽新)發現錳礦。新中國成立以後才開始大規模的錳礦地質勘查工作。截止2012年底,我國已探明儲量的礦區有213處。
我國錳礦山的開採始於1890年,當時開採的是湖北陽新錳礦,後因質量不佳,不久就停采了。經過一百多年的發展,現在我國在錳礦開採、選礦、冶煉、深加工和綜合利用等方面已經形成了較完整的體系,錳礦石的產量也不斷增加。
此外,隨著我國鋼鐵、電子電池等工業的迅猛發展,錳的消費量激增,而我國的錳礦貧礦多,富礦少,無法滿足國內對錳資源的需求,導致錳礦石的進口量也從1983年開始逐年增加,我國也成為了世界上主要的錳礦石進口國。2010年國內共進口1160萬噸(按乾噸算)錳礦石,占全世界總交易量(2000萬噸)的58%。2011年,我國錳礦石進口量為1297萬噸,比2010年增加12.1%,創我國年度進口歷史新高。2012年,我國錳礦進口量為1138萬噸 。
我國進口的錳礦石主要來自澳大利亞、加彭、加納、南非、巴西、印度、緬甸、東歐等國家和地區。隨著我國錳行業的不斷發展,我國的錳製品也開始出口,日本、荷蘭、韓國、美國、俄羅斯、烏克蘭、印度、孟加拉、朝鮮、泰國等國都是我國錳製品的主要出口地。近幾年,由於錳資源的內需較大,國際市場疲軟,再加上政府對相關錳製品徵稅等因素影響,我國錳製品出口量有所下降。2012年我國(錳桃等)錳製品出口量累計數量87705.052噸,同比下降17%。2013年全年進口錳礦1660.8萬噸,同比增長34.29%,進口金額為319171.6萬美元,同比增長46%。相比2012年,2013年我國進口錳礦可謂量價齊增。這一方面是由於我國粗鋼產量增長對錳合金的剛性需求持續增強,另一方面則是南非等錳礦主產國產量增長以及對中國市場的投放力度加大。
近些年來,我國錳行業發展中的問題也越來越突出,如錳礦石主要由中小型礦區生產,開採利用率低,回收率也低,有些礦山還存在亂采亂挖的現象,技術設備落後,環境污染嚴重,產業布局結構不合理,產能過剩,對國外礦石依賴度高等,這些問題都制約了我國錳行業的發展。
2013年國家各項環保及淘汰落後產能政策出台 ,意在調控鋼材產量以及電解錳產量。目前電解錳產能嚴重過剩,產量供大於求局勢緊張。雖在政府正常調控下或能減少電解錳過剩產能,但也需要一定的過渡時間。為了解決這些問題,我國錳相關企業應該密切關注國內、國際市場,及時調整錳礦石的進口量和產量,發揮行業聯合會的積極作用,增強國際市場價格話語權。相關部門也應該鼓勵和引導企業實施走出去戰略,加大海外投資建廠力度,保障我國錳礦市場供應。此外,國家相關部門也應該整合錳礦資源,取締非法採礦,淘汰效率低下小礦山,提高行業準入門檻,提高勘查、開採集中度,加大對新工藝、新設備的投資引進力度,繼續落實節能減排工作,促進相關行業健康發展。
理化性質
物理性質
 金屬錳(玻封)
金屬錳(玻封) 銀白色金屬,質堅而脆。屬於VIIB族元素。密度7.44克/立方厘米。熔點1244℃。在固態狀態時它以四種同素異形體存在α錳(體心立方),β錳(立方體),γ錳(面心立方),δ錳(體心立方)。電離能為7.435電子伏特。
元素符號:Mn
元素原子量:54.94
CAS號:7439-96-5
元素類型:金屬元素
體積彈性模量:120(GPa)
原子化焓:280.3 (kJ /mol @25℃)
 錳片
錳片 熱容:26.32 J /(mol· K)導電性:0.0069510^6/(cm ·Ω )原子體積:7.39(立方厘米/摩爾)
元素在太陽中的含量:10(ppm)
元素在海水中的含量:
太平洋表面:0.0001(ppm)
地殼中含量:950(ppm)
質子數:25
中子數:30
相對原子質量:54.938049
原子序數:25
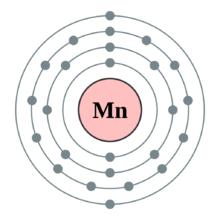 錳的核外電子排布
錳的核外電子排布 所屬周期:4所屬族數:VIIB
價電子排布:1s2 2s2 2p6 3s2 3p6 3d5 4s2
外圍電子層排布:3d5 4s2
電子層:K-L-M-N
電子層分布:2-8-13-2
晶體結構:晶胞為體心立方晶胞,每個晶胞含有2個金屬原子。晶胞參數:
a = 891.25 pm
b = 891.25 pm
 錳的各氧化價態的電極電勢
錳的各氧化價態的電極電勢 c = 891.25 pm
α = β =γ = 90°
莫氏硬度:6
電離能(kJ /mol)
M - M+ 717.4
M+ - M2+ 1509.0
M2+ - M3+ 3248.4
M3+ - M4+ 4940
M4+ - M5+ 6990
M5+ - M6+ 9200
M6+ - M7+ 11508
M7+ - M8+ 18956
M8+ - M9+ 21400
M9+ - M10+ 23960
聲音在其中的傳播速率:5150(m/S)
化學性質
錳在元素周期表上位於第四周期,第VIIB族,屬於比較活潑的金屬,加熱時能和氧氣化合,易溶於稀酸生成二價錳鹽。
1、化合價
錳的化合價有+2、+3、+4、+5+6和+7。其中以+2(Mn2+的化合物)、+4(二氧化錳,為天然礦物)和+7(高錳酸鹽,如KMnO4)、+6(錳酸鹽,如K2MnO4)為穩定的氧化態。
在酸性溶液中,+3價的錳、+5價的錳和+6價的錳均比較容易發生歧化反應:
![錳[化學元素]](/img/4/42e/nBnauM3X3gjN1gDM2QzNzQzN1UTM1QDN5MjM5ADMwAjMwUzL0czLxUzLt92YucmbvRWdo5Cd0FmLwE2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] ![錳[化學元素]](/img/7/dd9/nBnauM3XzQDOzUTO0YzNzQzN1UTM1QDN5MjM5ADMwAjMwUzL2czLwUzLt92YucmbvRWdo5Cd0FmLwE2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] ![錳[化學元素]](/img/9/60c/nBnauM3X2ATMwgjNyUjNxIDN0UTMyITNykTO0EDMwAjMwUzL1YzL0AzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] 較穩定,不容易被氧化,也不容易被還原。KMnO和MnO有強氧化性。Mn(OH)不穩定,易被空氣中的氧氣氧化為水合MnO[MnO(OH)即使是水中微量的溶解氧也能將其氧化;KMnO也能發生歧化反應,但反應不如在酸性溶液中進行得完全。
下面列出部分其化合價對應的化合物:
 錳各種價態的化合物
錳各種價態的化合物 -3價:Na[Mn(CO)]
-1價:Na[Mn(CO)]
0價:Mn單質
+1價:K[Mn(CN)]
+2價:MnO 二價錳鹽
+3價:MnF K[Mn(CN)]
+4價:MnO
+5價:NaMnO
+6價:MnO
+7價:MnO MnOF
2、化學反應
(1)和氧氣的反應
在空氣中易氧化,生成褐色的氧化物覆蓋層。它也易在升溫時氧化。氧化時形成層狀氧化銹皮,最靠近金屬的氧化層是MnO(一氧化錳),而外層是MnO(四氧化三錳):
![錳[化學元素]](/img/2/8d9/nBnauM3X4gTMwIzM3YDOzQzN1UTM1QDN5MjM5ADMwAjMwUzL2gzLyQzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] ![錳[化學元素]](/img/d/61d/nBnauM3X1cDOxITOwMzNzQzN1UTM1QDN5MjM5ADMwAjMwUzLzczL1IzLt92YucmbvRWdo5Cd0FmLzE2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] 在高於800℃的溫度下氧化時,MnO的厚度逐漸增加,而MnO層的厚度減少。在800度以下出現第三種氧化層MnO。在約450℃以下最外面的第四層氧化物MnO是穩定的。
(2)和水、酸的反應
錳和鐵化學性質相似,常溫與水反應緩慢,當自身高溫時,反應迅速,水變為氫氣,錳被氧化,形成複雜氧化物:
![錳[化學元素]](/img/9/5e2/nBnauM3X4MDN1gzM1UzNzQzN1UTM1QDN5MjM5ADMwAjMwUzL1czL1IzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] 錳易溶於稀酸,並有氫氣放出,生成二價錳離子:錳和濃硫酸、濃硝酸等氧化性酸反應生成二氧化硫、二氧化氮,自身被氧化成二價錳:
![錳[化學元素]](/img/2/cf9/nBnauM3XzYDMzUzMxADOzQzN1UTM1QDN5MjM5ADMwAjMwUzLwgzL4czLt92YucmbvRWdo5Cd0FmLzE2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] ![錳[化學元素]](/img/9/d1a/nBnauM3XygjMzkDO4MDOzQzN1UTM1QDN5MjM5ADMwAjMwUzLzgzL4gzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] ![錳[化學元素]](/img/5/5c6/nBnauM3XxcjMycjN3ETOzQzN1UTM1QDN5MjM5ADMwAjMwUzLxkzL4MzLt92YucmbvRWdo5Cd0FmLyE2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] 錳和錳礦是有些極大的分別的。
製備方法
工業製備
電解法
工業上可以用通直流電電解硫酸錳溶液的方法製備金屬錳。這種方法成本較高,但成品純度好。
製備溶液採用錳礦粉與無機酸反應加熱製取錳鹽溶液,同時向溶液中加入銨鹽作緩衝劑,用加氧化劑氧化中和的方法除去鐵,加硫化淨化劑除去重金屬,然後過濾分離,在溶液中加入電解添加劑作為電解溶液。工業生產廣泛採用硫酸浸錳方法製取電解液,用氯化錳鹽溶液電解製取金屬錳的方法還未形成規模性生產。
製取硫酸錳所用的錳礦粉分菱錳礦和軟錳礦兩種。用菱錳礦粉製取硫酸錳的主要化學反應為:
![錳[化學元素]](/img/9/099/nBnauM3X1cTO4IDNwEDOzQzN1UTM1QDN5MjM5ADMwAjMwUzLxgzL4IzLt92YucmbvRWdo5Cd0FmLyE2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] 用軟錳礦製取硫酸錳,先要對軟錳礦進行還原焙燒,還原成一氧化錳,然後用硫酸浸取,其主要化學反應為:
![錳[化學元素]](/img/4/472/nBnauM3X0ADNwUTOwYDOzQzN1UTM1QDN5MjM5ADMwAjMwUzL2gzLxgzLt92YucmbvRWdo5Cd0FmLwE2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] 電解操作過程。向隔模電解槽注入含硫酸銨的硫酸錳水溶電解液,接通直流電,產生電析作用,在陰極板上析出金屬錳,陽極板析出氧氣。 化學方程式為:
![錳[化學元素]](/img/4/a13/nBnauM3X3AzNxgDM4czNzQzN1UTM1QDN5MjM5ADMwAjMwUzL3czL2QzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] 周期性地更換陰極板,對電析產物進行鈍化、水洗、烘乾、剝離等處理,獲得金屬錳產品。
實驗室製備
實驗室製備可以用火法製備金屬錳,火法冶煉包括矽還原法(電矽熱法)和鋁還原法(鋁熱法)。
一、 鋁 還原法 (鋁熱法)
 鋁熱反應
鋁熱反應 鋁熱法是採用鋁作還原劑,利用還原氧化錳釋放的化學熱進行冶煉的一種生產金屬錳方法。MnO比熱效果小反應實際上不能進行;而MnO比熱效果大,活性氧含量過大,反應幾乎是爆發式進行。因此Mn3O4最好。反應的方程式為:
![錳[化學元素]](/img/8/4f0/nBnauM3XxEzN1YTOzgDOzQzN1UTM1QDN5MjM5ADMwAjMwUzL4gzL0UzLt92YucmbvRWdo5Cd0FmLxE2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] 由於鋁還原法不能去除雜質,需要用純度高的軟錳礦(MnO)甚至用電解二氧化錳作原料。Al還原法需要耗鋁成本高,但具有反應過程激烈,生產設備和工藝比較簡單的優點。但即使用含錳量特別高的原料冶煉,合金仍然夾雜有磷、鋁等有害雜質,此法很少用來生產金屬錳。
二、矽還原法 (電矽熱法)
電矽熱法生產金屬錳套用得比較廣泛,這種方法的主要優點是生產成本比較低,然而與電解法相比,對錳礦品位要求比較高,獲得的金屬錳純度不高,含錳為94%~98%。當採用矽錳與錳礦熔煉時:MnO在1000℃高溫下分解成MnO和O在熔融爐渣中,MnO被Si置換分解:
![錳[化學元素]](/img/8/f4d/nBnauM3X1IjM5cTN4MDOzQzN1UTM1QDN5MjM5ADMwAjMwUzLzgzL1IzLt92YucmbvRWdo5Cd0FmLwE2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] MnO最後被Si再還原為金屬錳。用矽(Si)或低碳矽錳還原,發熱量小,必須在電爐內進行,過程反應為:
![錳[化學元素]](/img/2/3c8/nBnauM3XxgDMzEzN5IzNzQzN1UTM1QDN5MjM5ADMwAjMwUzLyczLyUzLt92YucmbvRWdo5Cd0FmLyE2LvoDc0RHa.jpg) 錳[化學元素]
錳[化學元素] 上式反應屬可逆反應,需添加石灰使SiO造渣,使反應向右進行。
套用領域
用途在鋼鐵工業中主要用於鋼的脫硫和脫氧;也用作為合金的添加料,以提高鋼的強度、硬度、彈性極限、耐磨性和耐腐蝕性等;在高合金鋼中,還用作奧氏體化合元素,用於煉製不鏽鋼、特殊合金鋼、不鏽鋼焊條等。此外,還用於有色金屬、化工、醫藥、食品、分析和科研等方面。
合金
錳鋼的脾氣十分古怪而有趣:如果在鋼中加入2.5—3.5%的錳,那么所製得的低錳鋼簡直脆得像玻璃一樣,一敲就碎。然而,如果加入13%以上的錳,製成高錳鋼,那么就變得既堅硬又富有韌性。高錳鋼加熱到淡橙色時,變得十分柔軟,很易進行各種加工。另外,它沒有磁性,不會被磁鐵所吸引。如今,人們大量用錳鋼製造鋼磨、滾珠軸承、推土機與掘土機的鏟斗等經常受磨的構件,以及鐵錳錳軌、橋樑等。上海新建的文化廣場觀眾廳的屋頂,採用新穎的網架結構,用幾千根錳鋼鋼管焊接而成。在縱76米、橫138米的扇形大廳里,中間沒有一根柱子。由於用錳鋼作為結構材料,非常結實,而且用料比別的鋼材省,平均每平方米的屋頂只用45公斤錳鋼。1973年興健的上海體育館(容納一萬八千人),也同樣採用錳鋼作為網架屋頂的結構材料。在軍事上,用高錳鋼製造鋼盔、坦克鋼甲、穿甲彈的彈頭等。煉製錳鋼時,是把含錳達60一70%的軟錫礦和鐵礦一起混合冶煉而成的。
輔助
錳是煉鋼時用錳鐵脫氧而殘留在鋼中的,錳有很好的脫氧能力,能把鋼中的FeO還原成鐵,改善鋼的質量;還可以與硫形成MnS,從而減輕了硫的有害作用。降低鋼的脆性,改善鋼的熱加工性能;錳能大部分溶於鐵素體,形成置換固溶體,使鐵素體強化提高鋼的強度和硬度。錳是鋼中的有益元素。
飲食
錳是正常機體必需的微量元素之一,它構成體內若干種有重要生理作用的酶,正常每天從食物中攝入錳3-9毫克。
 錳砂
錳砂 錳是幾種酶系統包括錳特異性的糖基轉移酶和磷酸烯醇丙酮酸羧激酶的一個成分並為正常骨結構所必需。其攝入量差別很大,主要取決於是否食入含量豐富的食品如非精製的穀類食物,綠葉蔬菜和茶.此微量元素的通常攝入量為每天2~5mg,吸收率為5%~10%.
錳缺乏的人曾報導過1例:一位食用每天含0.1mg錳的純化飲食者出現短暫性皮炎,低膽固醇血症以及鹼性磷酸酶水平增加。2周內他失去約60%其估計的體內錳池但在另外4周的缺乏飲食期間未再進一步丟失.錳缺乏在臨床文獻中已有記載。
錳中毒通常只限於採礦和精煉礦石的人,長期接觸錳可引起類似帕金森綜合徵或Wilson病那樣的神經症狀.
 錳砂
錳砂 富錳的食品
成年人每日錳供給量為每千克體重0.1毫克。食物中茶葉、堅果、粗糧、乾豆含錳最多,蔬菜和乾鮮果中錳的含量略高於肉、乳和水產品,魚肝、雞肝含錳量比其肉多。一般葷素混雜的膳食,每日可供給5毫克錳,基本可以滿足需要。偏食精米、白面、肉多、乳多錳的含量低。當正常人出現體重減輕、性功能低下、頭髮早白可懷疑錳攝入不足。
植物作用
植物主要吸收錳離子(Mn)。Mn是細胞中許多酶(如脫氫酶、脫羧酶、激酶、氧化酶和過氧化物酶)的活化劑,尤其是影響糖酵解和三羧酸循環。錳使光合中水裂解為氧。缺錳時,葉脈間缺綠,伴隨小壞死點的產生。缺綠會在嫩葉中或老葉中出現,依植物種類和生長速率決定。
分布情況
 錳
錳 截至2007年底,中國錳礦(礦石)查明資源儲量79293.5萬噸,其中基礎儲量22443.7萬噸(儲量為12714.1萬噸),資源量為56849.8萬噸。我國錳礦查明資源儲量分布於全國23個省、自治區、直轄市,但主要集中在廣西(28125.9.萬噸,占35.5%)、湖南(15845.0萬噸,占20.0%)、雲南(9215.7萬噸,占11.6%)、貴州(7981.5萬噸,占10.1%)、遼寧(4190.1萬噸,5.3%)和重慶(4127.6萬噸,占5.2%),六省合計69485.8萬噸,占全國錳礦查明資源儲量總量的87.6%。
中國錳礦資源較多,分布廣泛,在全國21個省(區)均有產出;有探明儲量的礦區213處,總保有儲量礦石5.66億噸,居世界第3位。中國富錳礦較少,在保有儲量中僅占6.4%。從地區分布看,以廣西、湖南為最豐富,占全國總儲量的55%;貴州、雲南、遼寧、四川等地次之。從礦床成因類型來看,以沉積型錳礦為主,如廣西下雷錳礦、貴州遵義錳礦、湖南湘潭錳礦、永州零陵區珠山鎮錳礦、遼寧瓦房子錳礦、江西樂平錳礦等;其次為火山-沉積礦床,如新疆莫托沙拉鐵錳礦床;受變質礦床,如四川虎牙錳礦等;熱液改造錳礦床,如湖南瑪瑙山錳礦;表生錳礦床,如廣西欽州錳礦。從成礦時代來看,自元古宙至第四紀均有錳礦形成,以震旦紀和泥盆紀為最重要。
安全措施
危害防治
若發生事故或感不適,立即就醫 (可能的話,出示其標籤)。
一旦起火,用 (滅火設備類型的)滅火。
穿戴適當的防護服、手套和護目鏡或面具。
健康危害
急性錳中毒常見於口服濃於1%高錳酸鉀溶液,引起口腔黏膜糜爛、噁心、嘔吐、胃部疼痛;3%~5%溶液發生胃腸道黏膜壞死,引起腹痛、便血,甚至休克;5~19克錳可致命。在通風不良條件下進行電焊,吸入大量新生的氧化錳煙霧,可發生咽痛、咳嗽、氣急,並驟發寒戰和高熱( 金屬煙熱)。
慢性錳中毒一般在接觸錳的煙、塵3~5年或更長時間後發病。早期症狀有頭暈、頭痛、肢體酸痛、下肢無力和沉重、多汗、心悸和情緒改變。病情發展,出現肌張力增高、手指震顫、腱反射亢進,對周圍事物缺乏興趣和情緒不穩定。後期出現典型的震顫麻痹綜合徵,有四肢肌張力增高和靜止性震顫、言語障礙、步態困難等以及有不自主哭笑、強迫觀念和衝動行為等精神症狀。
錳煙塵可引起肺炎、塵肺,尚可發生結膜炎、鼻炎和皮炎。
學科聯繫
精神科
 錳礦
錳礦 錳 -- 和精神科關係最密切的金屬元素
生理功能
1. 可促進骨骼的生長發育。
2. 保護細胞中線粒體的完整。
3. 保持正常的腦功能。
4. 維持正常的糖代謝和脂肪代謝。
5. 可改善機體的造血功能。
影響健康
錳缺乏症狀可影響生殖能力,有可能使後代先天性畸形,骨和軟骨的形成不正常及葡萄糖耐量受損。另外,錳的缺乏可引起神經衰弱綜合症,影響智力發育。錳缺乏還將導致胰島素合成和分泌的降低,影響糖代謝。
易被濕潤的黏膜表面吸收生成亞硫酸、硫酸。對眼及呼吸道黏膜有強烈的刺激作用。大量吸入可引起肺水腫、喉水腫、聲帶痙攣而致窒息。
輕度中毒時,發生流淚、畏光、咳嗽,咽、喉灼痛等;嚴重中毒可在數小時內發生肺水腫;極高濃度吸入可引起反射性聲門痙攣而致窒息。皮膚或眼接觸發生炎症或灼傷。慢性影響:長期低濃度接觸,可有頭痛、頭昏、乏力等全身症狀以及慢性鼻炎、咽喉炎、支氣管炎、嗅覺及味覺減退等。少數工人有牙齒酸蝕症。
食品攝取
 錳質土
錳質土 錳的安全和足夠的每日攝入量如下表所示:
| 組 別 | 年齡(歲) | 錳(毫克) |
| 嬰 兒 | 0--0.5 | 0.5--0.7 |
| 0.5--1.0 | 0.7--1.0 | |
| 兒童和青少年 | 1--3 | 1.0--1.5 |
| 4--6 | 1.5--2.0 | |
| 7--10 | 2.0--3.0 | |
| 11以上 | 2.5--5.0 | |
| 成 人 | 18以上 | 2.5--5.0 |
食物來源
錳的主要食物來源有:核桃、麥牙、赤糖蜜、萵苣、乾菜豆、花生、馬鈴薯、大豆、向日葵籽、小麥、大麥以及肝等。
營養學
簡介
錳廣泛分布於生物圈內,但是人體內含量甚微。成年人體內錳的總量約為200-400umol,分布在身體各種組織和體液中。骨、肝、胰、腎中錳濃度較高;腦、心、肺和肌肉中錳的濃度低於20nmol/g;全血和血清中的錳濃度分別為200nmol/L和20nmol/L。錳線上粒體中的濃度高於在細胞漿或其它細胞器中的濃度,所以線粒體多的組織錳濃度較高。在1913年已經知道錳是動物組織的成分之一,但從1931年才陸續在多種實驗動物中發現缺錳的表現,從而確認錳是動物的必需微量元素之一。
食物來源
穀類、堅果、葉菜類富含錳。茶葉內錳含量最豐富。精製的穀類、肉、魚、奶類中錳含量比較少。動物性食物雖然含量不高,但吸收和存留較高,仍不失錳的良好來源。
代謝吸收
全部小腸都能吸收錳。錳的吸收是一種迅速的可飽和過程,很可能是通過一種高親和性、低容量的主動運輸系統和一個不飽和的簡單擴散作用完成的。錳的吸收機制有可能包括兩個步驟,首先是從腸腔攝取,然後是跨過黏膜細胞輸送,兩個動力過程同時進行。在吸收過程中錳、鐵與鈷競爭相同的吸收部位,三者中任何一個數量高都會抑制另外兩個的吸收。錳幾乎完全經腸道排泄,僅有微量經尿排泄。吸收的錳經腸道的排泄非常快。
生理功能
錳在體內一部分作為金屬酶的組成成分,一部分作為酶的激活劑起作用。
生理需要
成年人的錳的適宜攝入量為3.5mg/d,最高可耐受攝入量為10mg/d。
過量表現
有人報告在肝功能受損、膽道不通暢或兼有兩者的病人中發現錳中毒,病人的腦MRI檢查呈明顯異常,中毒減輕後此種異常亦隨之改善。此外,關於口服毒性問題雖然還沒有肯定的結論,但已經有一些報告提示這一問題值得充分重視與研究。例如,有人曾發現神經系統功能障礙者腦中錳濃度高於正常;有暴力行為的人發現錳高於正常。
錳缺乏症
有人提出,錳缺乏可能是人類的一個潛在的營養問題 。錳缺乏還可能與某些疾病有關。有人曾報告,在骨質疏鬆、糖尿病、動脈粥樣硬化、癲癇、創傷癒合不良的患者中存在膳食錳攝入少,血錳、組織錳低的問題。
中國乃至世界錳礦儲量最大的地方在廣西的大新縣下雷鎮。
生命元素
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
元素性質
| 為了方便閱讀者查閱元素周期表中各元素符號的性質及特點,比較系統的歸納和總結各元素的套用價值及注意事項,從而為需要相關知識的人們形成知識的鏈條,本次主要是對有些元素的內容進行補充及完善。 |
![錳[化學元素] 錳[化學元素]](/img/2/552/nBnauM3XzUDO5UzMxgDOyYDO1UTM1QDN5MjM5ADMwAjMwUzL4gzLyAzLt92YucmbvRWdo5Cd0FmLxE2LvoDc0RHa.jpg)
