發現簡史
釓於1880年由馬里納克Charles Galissard de Marignac在日內瓦發現。他早就懷疑Carl Mosander報告的didymium(鐠釹混合物)並不是一種新的元素而是混合物。他的推測被在巴黎的Marc Delafontaine和Paul-Emile Lecoq de Boisbaudran確認了,報告稱它的光譜線會從不同的來源而變化。確實,在1879年他們已經從一些didymium中分離了釤,其是從發現於烏拉爾山脈的鈮釔礦中提取的。在1880年,Marignac從didymium中提取了另一種新的稀土,Paul-Émile Lecoq de Boisbaudran也在1886年實現了,後者稱它為gadolinium(釓)。
自莫桑德爾先後發現鑭、鉺和鋱以後,各國化學家特別注意從已發現的稀土元素去分離新的元素。在發現釤後的第2年,1880年瑞士科學家馬里納克發現了兩個新元素並分別命名為gamma alpha和gamma beta。後來證實gamma beta和釤是同一元素。1886年布瓦博德朗製得純淨的gamma alpha,並確定它是一種新元素。命名為gadolinium,元素符號Gd。這是為了紀念芬蘭礦物學家加多林(J.Gadonlin)。 釓、釤、鐠、釹都是從當時被認為是一種稀土元素的didymium中分離出來的。由於它們的發現,didymium不再被保留。而正是它們的發現打開了發現稀土元素的第三道大門,是發現稀土元素的第三階段。但這僅是完成了第三階段的一半工作。確切的講應該是打開了鈰的大門或完成了鈰的分離,另一半就將是打開釔的大門或是完成釔的分離。
礦藏分布
當下世界上已知的稀土礦物及含有稀土元素的礦物有250多種,稀土元素含量較高的礦物有60多種,有工業價值的不到10種。中國稀土資源極其豐富,其特點可概括為:儲量大、品種全、有價值的元素含量高、分布廣。中國稀土的工業儲量(按氧化物計)是國外稀土工業儲量的2.2倍。國外稀土資源集中在美國、印度、巴西、澳大利亞和蘇聯等國,工業儲量(按氧化物計)為701.11萬噸。
物理性質
 金屬釓
金屬釓釓為銀白色金屬,有延展性,熔點1313°C,沸點3266°C,密度7.9004克/厘米³。釓在室溫下有磁性。釓在乾燥空氣中比較穩定,在濕空氣中失去光澤;釓有最高的熱中子俘獲面,可用作反應堆控制材料和防護材料;用釓鹽經磁化製冷可獲得接近絕對零度的超低溫。1880年,瑞士的馬里格納克將“釤”分離成兩個元素,其中一個由索里特證實是釤元素,另一個元素得到波依斯包德萊的研究確認,1886年,馬里格納克為了紀念釔元素的發現者,研究稀土的先驅荷蘭化學家加多林(Gado Linium),將這個新元素命名為釓。釓在現代技革新中將起重要作用。
CAS號:7440-54-2
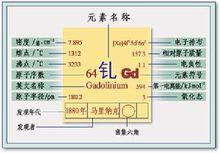
元素名稱:釓
元素在太陽中的含量:(ppm):0.002
元素在海水中的含量:(ppm):太平洋表面 0.0000006
地殼中含量:(ppm):7.7
元素原子量:157.25
氧化態:
Main Gd+2, Gd+3
 金屬釓
金屬釓Other晶體結構:晶胞為六方晶胞。
晶胞參數:
a = 363.6 pm
b = 363.6 pm
c = 578.26 pm
α = 90°
β = 90°
γ = 120° 維氏硬度:570MPa
 釓鐵合金
釓鐵合金聲音在其中的傳播速率:(m/S) 2680電離能 (kJ /mol)
M - M+ 592.5
M+ - M2+ 1167
M2+ - M3+ 1990
M3+ - M4+ 4250
相對原子質量:157.25
常見化合價: +3
電負性: 1.2
外圍電子層排布:4f7 5d1 6s2
核外電子排布: 2,8,18,25,9,2
核電荷數:64
晶體類型:密排六方
同位素及放射線: Gd-148[75y] Gd-150[1800000y] Gd-152(放 α[1.1E11y]) Gd-154 Gd-155 Gd-156 Gd-157 *Gd-158 Gd-159[18.6h] Gd-160 Gd-162[8.4m]
元素周期表的位置:64
電子層分布情況: 2-8-18-25-9-2
電子層:K-L-M-N-O-P
電子親合和能: 0 KJ·mol-1
第一電離能: 594 KJ·mol-1
第二電離能: 1170 KJ·mol-1
第三電離能: 0 KJ·mol-1
單質密度: 7.895 g/cm3
單質熔點: 1311.0 ℃
單質沸點: 3233.0 ℃
原子半徑: 2.54 埃
離子半徑: 0.938(+3) 埃
共價半徑: 1.61 埃
體積彈性模量:Gpa:37.9
原子化焓:kJ /mol @25℃:352
熱容:J /(mol· K):37.03
導電性:10^6/(cm ·Ω ):0.00736
導熱係數:W/(m·K):10.6
熔化熱:(千焦/摩爾):10.050
汽化熱:(千焦/摩爾) :359.40
元素在宇宙中的含量:(ppm):0.002
原子體積:(立方厘米/摩爾) :19.9
化學性質
能與水緩慢反應;溶於酸形成相應的鹽。
元素用途:常用作原子反應堆中吸收中子的材料。也用於微波技術、彩色電視機的螢光粉。
在潮濕的空氣中變晦暗。溶於酸,不溶於水。氧化物為白色粉狀。鹽類無色。有良好的超導電性能、高磁矩及室溫居里點等特殊性能。釓有以下同位素:152Gd、154Gd~158Gd、160Gd。
套用
套用領域
釓的重要性質是7個軌道上每個軌道有一個電子,是稀土元素中最大數的不成對電子。依存這個不成對電子的磁力矩最大,可以期待這個特性能夠被有效利用。
醫療領域:
在醫療套用方面,釓-二乙烯二胺五醋酸(DTPA)的絡合物,正好可以像X射線造影劑鋇那樣,作為MRI(磁共振成像診斷)的畫面濃淡的調節劑來使用。也就是利用釓周圍的水受到釓原子核磁場力矩的影響,顯示出和沒有受到影響的水性質不同這一點,使用對照畫面,有利於病情的診斷 。
工業領域:已經為人所熟知的被稱為磁冷凍的工業技術,就是將受到磁場作用變為磁鐵時發熱,撤掉磁場磁性消失時吸熱的性質用於冷卻的利用。可以製造小型高效的製冷器。
在磁泡記憶裝置中,使用釓-鉀-石榴石作為媒體物質。磁泡記憶就是在物質的垂直方向上加上磁場,使其變成了圓筒狀的磁場,把磁場加強,不久就產生這個磁場消失的現象。利用磁泡記憶裝置可以存儲信息,一般被用於信息收藏。
釓的其他用途是與鋱和鏑一樣用於光纖、光碟。光磁記錄是用光來代替磁讀取磁化處和未被磁化處,具有高密度,可改寫記錄的特徵。
核能領域:在原子能工業中,利用銪和釓的同位素的中子吸收截面大的特性,作輕水堆和快中子增殖堆的控制棒和中子吸收劑 。
利用釓是所有元素中對熱中子強烈反應的特點,除用於原子反應堆的控制外,還可以將不可見中子用釓吸收並使之發光,作為在X線膠捲上感光的螢光化劑使用。
具體用途
它的主要用途有:
(1)其水溶性順磁絡合物在醫療上可提高人體的核磁共振(NMR)成像信號 。
(2)其硫氧化物可用作特殊亮度的示波管和x射線螢光屏的基質柵網。
(3)在釓鎵石榴石中的釓對於磁泡記憶存儲器是理想的單基片。
(4)在無Camot循環限制時,可用作固態磁致冷介質。
(5)用作控制核電站的連鎖反應級別的抑制劑,以保證核反應的安全。
(6)用作釤鈷磁體的添加劑,以保證性能不隨溫度而變化。
另外,氧化釓與鑭一起使用,有助於玻璃化區域的變化和提高玻璃的熱穩定性。氧化釓還可用於製造電容器、x射線增感屏。 在世界上目前正在努力開發釓及其合金在磁致冷方面的套用,現已取得突破性進展,室溫下採用超導磁體、金屬釓或其合金為致冷介質的磁冰櫃已經問世。
製備方法
釓,源自矽鈹釓礦石。可由氟化釓GdF3·2H2O用鈣還原而製得 。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
![釓[化學元素] 釓[化學元素]](/img/e/960/nBnauM3X3MzN0MDO1EDM0kDN1UTM1QDN5MjM5ADMwAjMwUzLxAzL4EzLt92YucmbvRWdo5Cd0FmLxE2LvoDc0RHa.jpg)
