性質
含有羧基-COOH的化合物,式中R可以是氫、鏈烴基、環烴基或芳烴基。羧酸廣泛存在於自然界。根據與羧基相連的烴基不同,可分為脂肪酸、芳香酸、飽和酸和不飽和酸等。根據分子中羧基數目不同,又可分為一元羧酸、二元羧酸和多元羧酸。脂肪酸由於是脂肪水解的產物而得名,是一類非常重要的化合物。
命名
早期發現的羧酸通常根據來源命名 。例如,甲酸最初是由蒸餾赤蟻製得,稱為蟻酸。乙酸最初由食醋中得到,稱為醋酸。丁酸具有典型酸敗奶油氣味,稱為酪酸。己酸、辛酸、癸酸又分別稱為羊油酸、羊脂酸、羊蠟酸,因為它們都存在於山羊的脂肪中。苯甲酸存在於安息香膠中,稱為安息香酸。各種羧酸的命名方法有以下幾種:
簡單的羧酸
按普通命名法命名。選含有羧基的最長碳鏈為主鏈,取代基的位置從羧基鄰接的碳原子開始,用希臘字母α、β、γ、δ等依次標明。
芳香酸
當作苯甲酸的衍生物來命名。
比較複雜的羧酸
按國際命名法命名。選含有羧基的最長碳鏈為主鏈,從羧基碳原子開始編號,再加取代基的名稱和位置。
脂肪族二元羧酸取分子中含有兩個羧基的最長碳鏈作為主鏈,加取代基的名稱和位置來命名。
物理性質低級脂肪酸C~C是液體,可溶於水,具有刺鼻的氣味。中級脂肪酸C~C也是液體,部分溶於水,具有難聞的氣味。高級脂肪酸是蠟狀固體,無味,不溶於水。
二元脂肪酸和芳香酸都是結晶固體。芳香酸在水中溶解度較小,可從水中重結晶。飽和二元羧酸除高級同系物外,都易溶於水和乙醇。
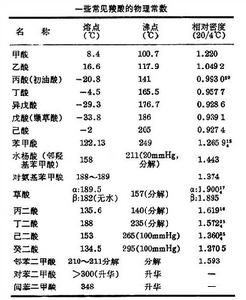
一些常見羧酸的物理常數(見表)。羧酸的沸點比分子量相近的醇的沸點高。這是由於羧酸分子是由兩個氫鍵締合起來的(結構式如)。直鏈飽和一元羧酸和二元羧酸的熔點隨碳原子數目增加而呈鋸齒狀上升。含偶數碳原子羧酸的熔點高於鄰近兩個含奇數碳原子的羥酸。
 羧酸
羧酸化學性質
羧酸最顯著的性質是酸性。在水溶液中,羧酸與羧酸根和氫離子之間存在著平衡:
羧酸的酸性是由於羰基的π 鍵與羥基氧原子上的未共用電子對發生共軛作用(見共軛效應),使羥基氧原子上的電子云向羰基移動,有利於氫以質子形式離解(結構式如)。羧酸是一種弱酸,但其酸性比碳酸強。羧酸能與金屬氧化物或金屬氫氧化物形成鹽。羧酸的鹼金屬鹽在水中的溶解度比相應羧酸大,低級和中級脂肪酸鹼金屬鹽能溶於水,高級脂肪酸鹼金屬鹽在水中能形成膠體溶液,肥皂就是長鏈脂肪酸鈉。
羧酸與醇反應生成酯,稱為酯化反應,它是羧酸的重要化學反應。許多羧酸酯都具有重要的工業用途。酯化反應也可看成是羧基中的羥基被烷氧基取代的反應。與此類似,羧酸中的羥基還可被鹵素、羧酸根和氨基取代(見取代反應),分別生成醯鹵、酸酐和醯胺等衍生物。
羧酸中的羰基,由於與羥基的共軛作用,反應性降低。例如羧酸不能被催化還原,而只能被氫化鋁鋰或乙硼烷還原成一級醇。
羧酸中羧基與烴基連結的碳-碳鍵較弱,容易斷裂。大多數一元羧酸或它們的鹽受熱即發生脫羧。例如,乙酸鈉與蘇打、石灰共熱即脫羧,生成甲烷。羧酸的鈣鹽或鋇鹽加熱,則生成酮:
各種二元羧酸受熱後,由於兩個羧基位置不同而發生不同的反應,有些脫羧,有些脫水,有些同時脫水,脫羧。
脂肪酸的α氫比其他碳原子上的氫活潑,能被鹵素取代。芳香酸的芳環也可發生鹵代、磺化和硝化等取代反應。
套用
低級脂肪酸是重要的化工原料,在工業上以很大的規模生產。純的乙酸可製造人造纖維、塑膠、香精、藥物等。高級脂肪酸是油脂工業的基礎。二元羧酸廣泛用於纖維和塑膠工業。某些芳香酸如苯甲酸、水楊酸等都具有多種重要的工業用途 。
重要衍生物
羧酸是非常重要的一類化學物質,還可以衍生出不少常見的其他化學物質,主要有:醯鹵、酸酐、酯和醯胺等。這幾類羧酸衍生物各具特性,並均在化學工業中有重要的套用。
取代羧酸
羧酸分子中烴基上的氫原子被其他具有官能團性質的原子或基團取代的化合物,稱為取代羧酸,根據取代官能團的不同,可分為鹵代酸、羥基酸、羰基酸和胺基酸。許多羥基酸和羰基酸是生物代謝的中間產物;一些羥基酸還對某些疾病具有治療價值;胺基酸則是構成蛋白質的本結構單元。
風險術語
R36刺激眼睛。
R37刺激呼吸系統。
R38刺激皮膚。