合金相
正文
━━━━━━━━━━━━━━━━━━━━━━━━固溶體
代位固溶體
形成條件
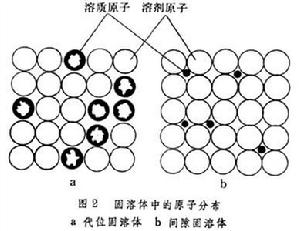
溶質原子的分布
間隙固溶體
缺位固溶體
有序固溶體
中間相
正常價化合物
電子化合物
間隙化合物
拓撲密堆相
Laves相
其他拓撲密堆相
金屬間化合物的實際套用
━━━━━━━━━━━━━━━━━━━━━━━━
當一種(或多種)元素加入到金屬中組成合金時,隨著各組元相對含量、晶體結構類型、電化學性質、原子相對尺寸、電子濃度和合金的溫度等因素的不同,可以得到不同的結構或原子排列方式。這些不同結構和不同原子排列方式的相統稱為合金相。
絕大多數實用的金屬材料都是由一種或幾種合金相所構成的合金。合金相的結構和性質以及各相的相對含量,各相的晶粒大小、形狀和分布對合金的性能起著決定性的作用。
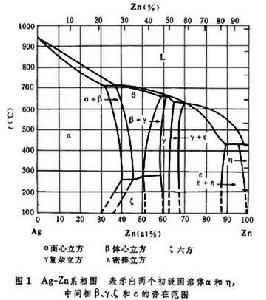
合金相根據在相圖中所處的位置,可以分為固溶體和中間相(或稱金屬間化合物)兩大類。以二元合金為例,在相圖的兩個端部分別與純組元連續相接的單相區,稱為固溶體或初級固溶體。但當第二種元素濃度超過一定限度時,可能形成通常稱為中間相的新相。有時將具有很大成分範圍的中間相稱為次級固溶體,而將只在很窄成分範圍具有同一結構的相稱為金屬間化合物。圖1為Ag-Zn二元相圖,示出初級固溶體和中間相在相圖上的形成位置。
 合金相
合金相固 溶 體
第二組元的原子作為溶質原子完全溶解於固態金屬溶劑中,形成的合金相稱為固溶體。固溶體的一個特點是成分可以在一定範圍內連續變化,這種變化不引起原來溶劑金屬的點陣類型發生改變(見晶體結構)。
固溶體是金屬結構中最常見的合金相類型。絕大多數金屬材料或是由固溶體組成,或是以固溶體為基,其中分布一定的金屬間化合物。在固溶體點陣中,原子之間的結合基本上是金屬鍵。和固態純金屬一樣,固溶體記憶體在著各種各樣的晶體缺陷,如空位、離位原子、位錯、亞晶界和晶粒間界等等;這些缺陷引起固溶體點陣的畸變。此外,由於異類原子的溶入也造成點陣的畸變。這些畸變對金屬的性能產生重大影響,如提高合金的強度和電阻率等。
代位固溶體 固溶體中如果溶質原子半徑和溶劑原子半徑相近,則固溶原子將取代溶劑原子分布在後者的位置上形成代位固溶體(圖2a)。
 合金相
合金相①組元點陣類型的異同 兩組元點陣類型相同是形成連續代位固溶體的先決條件,如果兩組元的點陣類型不同,組元的固溶度只能是有限的。
②組元原子半徑的相對差別 當組元原子半徑相差很大時,形成代位固溶體會使點陣發生嚴重畸變,從而引起點陣畸變能增高;當這種點陣畸變和畸變能達到一定數值時,原來的點陣便變得不穩定,於是就達到了固溶度極限。一般當溶質原子的半徑與溶劑原子的半徑相差在14~15%以內時,才有可能形成固溶度相當大(原子百分數≥10)的代位固溶體。
③組元的電化學性相對差別 組元的電化學性質可用元素的電負性來量度。在元素周期表中位置相近的元素具有相近的電負性,這兩個元素有可能形成無限固溶體。一般地說,元素周期表中相距很遠的元素電負性差別大;元素的電化學性相對差別越大,所形成的化合物越穩定,也就越不易形成代位固溶體。
④電子濃度 一個晶胞內價電子總數與原子總數的比值稱為電子濃度Ce:
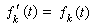
⑤組元的相對熔點 若兩組元的溶點不同,則高熔點組元在低熔點組元中固溶度較大,而低熔點組元溶入高熔點組元的固溶度較小。
⑥溫度 在大多數情況下,固溶度隨溫度的升高而增大;但也有相反的情況,例如鋅在銅中的固溶度隨溫度的升高而減小。
溶質原子的分布 溶質原子在固溶體中的分布可以是完全無序的、部分有序的或者出現偏聚。當固溶體中原子A和B是完全無序分布時,B原子的某一個近鄰位置為A原子所占據的機率PΑ應當恰好等於A原子在固溶體中的濃度xΑ,因而
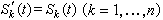 。在一般情況下,固溶體溶質原子的分布不是完全無序的,即PΑ不完全等於xΑ。我們可用參數a來表示溶質原子的分布偏離完全無序的程度:
。在一般情況下,固溶體溶質原子的分布不是完全無序的,即PΑ不完全等於xΑ。我們可用參數a來表示溶質原子的分布偏離完全無序的程度: 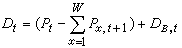
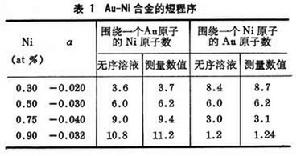
表1列出了在不同 Au-Ni固溶體中的最近鄰原子平均數。從表中可以看到這種合金固溶體偏離完全無序的程度不大。但是在另外一些合金固溶體中,可以達到很高的有序度(短程式),或出現很大程度的偏聚(a為正值)。一般地說,只有在稀固溶體中,或在較高溫度下溶質原子才呈完全無序(任意)分布。
 合金相
合金相 合金相
合金相 合金相
合金相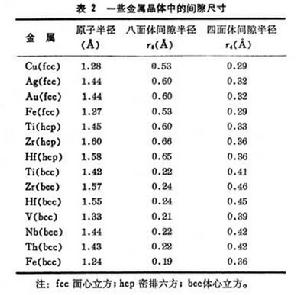 合金相
合金相缺位固溶體 缺位固溶體只在化合物的基礎上形成。在這種固溶體中,溶質元素的原子占據晶體點陣正常位置,而溶劑原子的某些位置是空缺的;例如在維氏體(氧在FeO中的固溶體)的晶體中,氧離子應當占據的位置都被填滿,而一部分鐵離子應當占據的位置是空缺的(圖3)。
 合金相
合金相銅和金形成連續固溶體(面心立方)。在淬火狀態Cu-Au合金的行為是正常的,即遵循一般固溶體的規律,如合金的電阻率隨著成分的改變連續地發生變化,其極大值出現在相當於成分 Cu-Au的地方。但是當合金從高溫緩慢冷卻時,在相當於Cu3Au、Cu-Au處,合金的電阻率顯著下降,只相當急冷時的二分之一到三分之一。這種現象是由於原子重新排列引起的。以Cu3Au合金為例,Cu3Au合金具有面心立方的晶體結構,在高溫面心立方點陣的每個結點上,可能被銅的原子所占據,也可能被金的原子所占據,如果從高溫緩冷下來,銅原子只占據面心的位置,金原子占據立方體的頂角位置,形成有序的結構。這樣,在X射線粉末照片上就會出現一些新的衍射線條,如100、110等,後者在無序面心立方點陣中由於消光而不出現。伴隨著有序化,固溶體的物理性質發生許多變化,例如電阻率急劇降低、電阻溫度係數和硬度增加,范性和點陣常數下降等。在有序化時,固溶體的電化學性質和化學穩定性也有改變。
中 間 相
合金系統形成連續固溶體的情況是不多的,在平衡圖上出現各式各樣的相。這些相的晶體結構一般與組元金屬的晶體結構不同,物理、化學和力學性質也迥異,統稱為中間相。有時也稱為金屬間化合物。很多這類的相併不服從化學價定律,成分可以在相當寬的範圍內變化。形成金屬間化合物的組元中通常至少有一種是金屬元素。
正常價化合物 有些金屬元素例如Mg和周期表中第ⅣA、VA和ⅥA族元素結合形成的化合物屬於這一類(表3)。這些化合物服從正常的化合價規則,有固定成分(一般有A2B,A3B2和AB三種類型),在相圖中用一垂線表示,它們通常有較高的形成熱和熔點,質硬而脆。
 合金相
合金相正常價化合物中的離子化合物,具有和某些化學化合物(離子晶體)相同的晶體結構,如NaCl結構(如MgSe、SnTe),或CaF2結構(如Mg2Si、Mg2Sn),也有以共價鍵結合的化合物如AlSb、GaAs和ZnSe等。
電子化合物 電子化合物不遵循化合價規則,其特徵是化合物中價電子數和原子數的比值 (e/a)為一定值,也即有一定的電子濃度(Ce),這類化合物首先為休謨-饒塞里(W.Hume-Rothery)所發現,它是由過渡族金屬IB族(Cu、Ag、Au),一些ⅧB族(Fe、Ni、Co)和ⅡB、 ⅢB、ⅣB 等族金屬所組成,以金屬鍵結合;例如銅和鋅、鋁、錫分別形成的二元合金中的β、γ、ε相都是電子化合物(表4)。β相的共同特點是它們的電子濃度均等於3/2(21/14),可有三種點陣結構:體心立方的CuZn、Cu5Sn和FEAL;密排六方如Cu3Ga;複雜的β-Mn結構如Cu5Si、Ag3Al。γ相的電子濃度均等於21/13,如呈複雜立方的γ黃銅結構如Cu5Zn8、Cu31Sn8。ε相的電子濃度均為7/4(21/12),呈密排六方結構如CuZn3、Cu3Sn。電子化合物在相圖中有一定的成分範圍。有些三元化合物也服從電子濃度規則,如MgSnNi2,電子濃度為3/2,呈β黃銅結構。
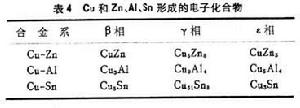 合金相
合金相間隙化合物 氫、碳、氮、硼等原子半徑比較小的元素,既可與過渡族金屬形成間隙固溶體;當這些填隙元素的量超出固溶度時,也能與之結合形成化合物。後者可分為兩類具有不同晶體結構的物質,當組元間原子半徑之比 rX/rM<0.59(M為過渡族金屬,X為填隙元素)時,形成結構簡單的間隙化合物,如果rX/rM>0.59,則形成具有複雜結構的間隙化合物。過渡族金屬的氫化物和氮化物都是結構簡單的間隙化合物,如 TiH2、ZnN、Fe2N等,而硼化物一般為結構複雜的間隙化合物。碳的情況分兩種,尺寸較大的過渡族金屬的碳化物如WC、VC屬前者,而Fe3C、Cr7C3則為後者,在鋼鐵材料中,碳化物占很重要的位置,它們是許多鋼中重要的強化相。
在結構簡單的間隙化合物中,金屬(M)原子一般形成面心立方或密排六方結構,少數情況下也有體心立方及簡單六方結構;非金屬原子(X)則充填在金屬原子之間的間隙位置。其組成一般可以用簡單的化學式表示,如MX、M2X、M4X、MX2等。但它的成分可以在一定範圍內變化。間隙化合物之間也可以互相溶解,具有相同結構的間隙化合物甚至可以互溶形成連續固溶體。這類間隙化合物一般具有很高的熔點(如TaC為3800℃、NbC為3760℃、ZrC為3530℃)、高熱電勢、高強度和高硬度,以及良好的熱穩定性和化學穩定性。其中雖含有50~60%非金屬原子,但是具有明顯的金屬特性,如有金屬光澤、能導電等。在某些情況下這些化合物的導電性質接近於其金屬組元的導電性質,如TiN、ZrH2的電導率分別接近Ti及Zr的電導率。和金屬導體一樣,其電阻率也隨溫度的下降而降低。在低溫,幾乎所有研究過的這類間隙化合物都由常態轉變為超導態。
拓撲密堆相 過渡族金屬生成種類繁多的拓撲密堆相(TCP相)。拓撲密堆相的特點,一方面可以看作是由配位數(CN)12、14、15、16的配位多面體堆垛而成,另一方面也可看作是原子半徑小的原子構成密排層,其中鑲嵌有原子半徑大的原子。是高度密排的結構,其形成除了尺寸因素影響外,又受電子濃度(Ce)因素的影響。相的組成元素及其成分可在較大範圍內變化,但其電子/原子比值 (e/a)變化的範圍很小。下面介紹常見的幾種拓撲密堆相。
Laves相 在二元系合金中,如果兩個組元的原子半徑相差很小,組元間的電化學互動作用不顯著,則容易形成電子化合物;如果兩個組元原子半徑相差大,則容易形成間隙化合物。介於這兩個極端,即A、B兩個組元的原子半徑有一定差別時,常出現一些中間相,它們的特徵是具有簡單的原子比。 Laves相就是一種化學式主要為AB2型的密排立方或六方結構的金屬間化合物。Laves相中原子半徑比rΑ/rB約在1.1~1.6之間。在許多Laves相(AB2)中,過渡族金屬一般為組元B,但有時也可以起組元A的作用。
Laves相的晶體結構有三種類型:①MgCu2型屬立方晶系,每個晶胞有24個原子(圖4)。鎂原子形成閃鋅礦型的結構(8個),銅原子形成四面體(16個)。每個鎂原子有4個近鄰鎂原子和12個近鄰銅原子;每個銅原子有6個近鄰的銅原子和6個近鄰的鎂原子。②MgZn2型屬六方晶系,A原子形成硫鋅礦結構,B原子形成四面體。每個A原子有4個近鄰A原子;12個近鄰B原子。每個B原子有6個近鄰B原子和6個近鄰A原子。③MgNi2屬六方晶系,介於MgCu22之間的結構。三元Laves相中電子濃度同晶體結構有關,其中有部分有序結構的如CuCdZn、CuMgAl,也有完全有序結構的,如CuMgSn。
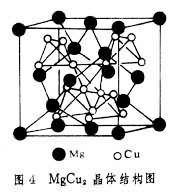 合金相
合金相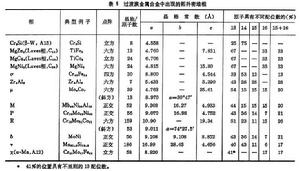 合金相
合金相參考書目
郭可信:高合金鋼與高溫合金中的相,《金屬學報》,14卷,1期,1978。
W. Hume-Rothery & G.V.Reynor,The Structure of Metals and Alloys, Institute of Metals,London,1956.