有機化合物的溶度分組
正文
根據有機化合物在水、乙醚、 5%氫氧化鈉溶液、5%碳酸氫鈉溶液、5%鹽酸、濃硫酸和85%磷酸七種溶劑中的溶解情況,可將它們分為九組(見表)。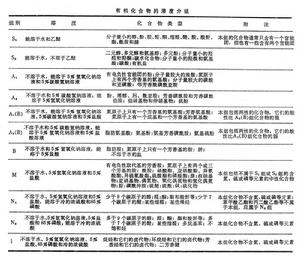 有機化合物的溶度分組
有機化合物的溶度分組物理溶解 溶質與溶劑的分子之間依靠靜電引力而溶解。通常,極性的溶質易溶在極性溶劑中,非極性溶質易溶在非極性溶劑中,即遵守有名的“相似相溶原則”。水是極性溶劑,乙醚是非極性溶劑,非極性的烴易溶於乙醚,不溶於水。如果在烴的分子中引入一個官能團,將使取代物的分子顯出極性,因而增加在水中的溶解度。當官能團在分子中所占的比例適中時,此物在水和乙醚中都能溶解,就是S1組化合物。官能團增多,極性加強,在水中的溶解度大而在乙醚中的溶解度小。當達到不溶於乙醚的程度時,就是S2組化合物。
固體在惰性溶劑中的溶解度除了決定於溶劑的本性外,與固體內部的結晶引力也有關,它的大小也決定了熔點,因此,成分和結構相似的固體物在同一種溶劑中通常以熔點低的溶解度較大。兩種熔化熱接近的固體也以熔點較低的具有較大的溶解度。同樣,兩種熔點相近的固體以熔化熱小的溶解度大。各種同質異晶物中也以熔點最低的一種的溶解度最大。支鏈及其位置或官能團的位置對水中的溶解度影響很大,支鏈多而官能團又靠近分子中部時,在水中的溶解度顯著增大。分子量對溶解度的影響可以表現為:①在同系物中,隨著次甲基數目的增多,分子量增大,分子的性質趨向於與烴的相近,因此在水中的溶解度減小,在乙醚中的溶解度變大;②分子中代入鹵原子後,鹵代物的分子量增大,在水中的溶解度減小, 因此S1組和S2組化合物的鹵代物常不屬於這兩組;③有時代入鹵素原子後能夠改變分子的性質,這比由於分子量增大的影響要大得多,例如三氯乙酸的分子量雖然與壬酸相近,但由於氯原子的誘導效應使它在水中的溶解度很大,而壬酸卻不溶於水。
物理-化學溶解 溶劑對溶質的引力已經超出物理的溶解,但它們之間沒有明顯的化學反應,這種引力的影響通常可表現在以下的幾個方面:①氫鍵的形成;②螯形結構的形成;③締合作用;④鹽的形成。其中以氫鍵最為重要。極性化合物在水中的溶解度的大小決定於分子中能夠形成氫鍵的官能團的數目與烴基在分子中所占的比例。雖然通常極性越強的有機物在水中的溶解度越大,但有時也會被其他的因素所抵消,例如硝基苯的極性比苯酚大,但在水中的溶解度卻比苯酚小,這是由於苯酚能與水形成氫鍵,它的影響大於極性所產生的效應。在苯酚的鄰位引入羰基或硝基後,雖然增加了一個官能團,但羰基或硝基與羥基間通過氫鍵形成螯形結構,因而大大地削弱了與水分子形成氫鍵的能力,使它們在水中的溶解度減小。溶質的分子之間締合後使有效的極性部分減少,在水中的溶解度也減小,在乙醚中的溶解度增大。醚與濃酸能形成不穩定的鹽,用水稀釋後又析出原來的醚;同理醛、酮和酯等中性含氧物溶解在濃硫酸或85%磷酸中時,可能也形成了鹽。
化學溶解 溶質與反應性溶劑起化學反應,稱為化學溶解,分以下幾種情況:
酸性有機化合物在5%氫氧化鈉溶液或5%碳酸氫鈉溶液中的溶解 酸性比碳酸強的有機化合物在這兩種溶液中都能溶解,而酸性比碳酸弱的只能溶在5%氫氧化鈉溶液中。
磺酸、亞磺酸和某些鹵代羧酸是酸性很強的有機酸,一般的羧酸是弱酸,但還能溶在5%碳酸氫鈉溶液中。酚類的酸性通常很弱,屬A2組,但在鄰位或對位引入電負性基團後,能明顯地增強酸性;當酸性超過碳酸後,就屬A1組化合物。同一個碳原子上連有兩個羰基的化合物,可以形成烯醇式結構,具有與酚類相近的酸性。但有的烯醇化反應很慢,因而在5%氫氧化鈉溶液中溶解也非常慢,以致看不出溶解的現象。伯硝基物和仲硝基物有很顯著的酸性,它們能形成酸式的互變異構物。
鹼性有機化合物在 5%鹽酸中的溶解 分子量較大的胺不溶於水,但能溶於5%鹽酸中,用烴基或醯基取代氮原子上的氫原子後,通常根據取代基的電負性的大小按照以下的順序使鹼性增強:
烷基<芳香基<脂肪醯基<芳香醯基<磺醯基
烷基的效應與氫原子類似,因此RNH2、R2NH和R3N的鹼性與NH3相近。芳香基的電負性遠比脂肪基強,因此芳香胺的鹼性要比脂肪胺弱得多。但苯環的鄰位或對位引入電負性基團後,鹼性減弱。胺的氮原子上連有兩個或三個芳香基後,使鹼性消失,成為中性化合物。一個脂肪醯基所產生的效應大約與三個芳香基相當,即脂肪醯胺也是中性化合物。芳香醯胺略有酸性,而芳香磺醯胺肯定已成為酸性化合物。
由兩個脂肪醯基或芳香醯基所形成的醯亞胺都有酸性,以二元酸衍生的醯亞胺最常見。N-取代醯胺是酸性還是中性化合物,要根據取代基的電負性才能決定。例如,乙醯-對硝基苯胺屬A2組,而乙醯苯胺則是 M組化合物。
空間效應對酸性和鹼性的影響 在酚的羥基的鄰位引入取代基後,由於空間效應,能使它在5%氫氧化鈉溶液中的溶度顯著地減小。如果取代基很大,就不溶解。2,4,6- 三叔丁苯胺也有類似的現象,它的鹼性非常弱,2,6-二叔丁基吡啶的鹼性比2,6-二甲基吡啶要弱得多。
空間效應對羧酸也有影響,有的能降低酸性,例如2-甲基-2′-二甲基-2-乙基-4-二甲基戊酸-1的酸性大約只相當於乙酸的1/25,主要是空間效應的影響。另一方面,空間效應有時反而能增強酸性,如鄰位取代苯甲酸的酸性通常比對位取代苯甲酸強,可能是取代基使羧基處於苯環的平面以外,因而羧酸的穩定性變差,傾向於離解為羧酸根離子。在取代酚中,3,5-二甲基-4-硝基苯酚的酸性比對硝基苯酚弱,可能是由於兩個甲基對硝基起了空間阻礙作用。
兩性化合物 分子中兼有酸性和鹼性基團的是兩性化合物。分子量小的胺基酸極性較強,屬S2組。不溶於水的兩性化合物應該根據氨基的鹼性強弱列入 A1(B)或A2(B) 組中。分子量較大的在氮原子上只連有烷基或氫原子的胺基酸屬A2(B)組。此外, 還有許多A2(B)組的有機物,例如不溶於水的氨基酚、氨基硫酚和氨基磺醯胺等,氨基的氮原子上取代芳基後,鹼性變弱,酸性加強,例如圖中a、b、c都是A1(B)組化合物。如果氨基上取代兩個芳基,則鹼性消失,變成A1組化合物,如圖中d。


