起源簡介
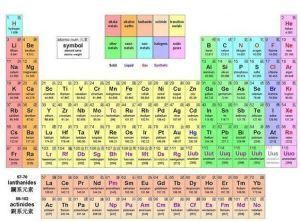
 化學元素周期表
化學元素周期表道爾頓提出科學原子論後,隨著各種元素的相對原子質量的數據日益精確和原子價(化合價)概念的提出,就使元素相對原子質量與性質(包括化合價)之間的聯繫顯露出來。德國化學家德貝萊納就提出了“三元素組”觀點。他把當時已知的54種元素中的15種,分成5組,每組的三種元素性質相似,而且中間元素的相對原子質量等於較輕和較重的兩個元素相對原子質量之和的一半。例如鈣、鍶、鋇,性質相似,鍶的相對原子質量大約是鈣和鋇的相對原子質量之和的一半。法國礦物學家尚古多提出了一個“螺鏇圖”的分類方法。他將已知的62種元素按相對原子質量的大小順序,標記在繞著圓柱體上升的螺鏇線上,這樣某些性質相近的元素恰好出現在同一母線上。這種排列方法很有趣,但要達到井然有序的程度還有困難。另外尚古多的文字也比較曖昧,不易理解,雖然是煞費苦心的大作,但長期未能讓人理解。英國化學家紐蘭茲把當時已知的元素按相對原子質量大小的順序進行排列,發現無論從哪一個元素算起,每到第八個元素就和第一一個元素的性質相近。這很像音樂上的八度音循環,因此,他乾脆把元素的這種周期性叫做“八音律”,並據此畫出了標示元素關係的“八音律”表。顯然,紐蘭茲已經下意識地摸到了“真理女神"的裙角,差點就揭示元素周期律了。不過,條件限制了他做進一步的探索,因為當時相對原子質量的測定值有錯誤,而且他也沒有考慮到還有尚未發現的元素,只是機械地按當時的相對原子質量大小將元素排列起來,所以他沒能揭示出元素之間的內在規律。他的“八音律”在英國化學學會上受到了嘲弄,主持人以不無譏諷的口吻問道:“你為什麼不按元素的字母順序排列?那樣,也許會得到更加意想不到的美妙效果。”德國化學家邁耶爾借鑑了德貝萊納、紐蘭茲等人的研究成果,從化合價和物理性質方面人手,去探索元素間的規律。在他的《近代化學理論》一書中,刊登了元素周期表,表中列出了28個元素,他們按相對原子質量遞增的順序排列,一共分成六族,並給出了相應的原子價是4、3、2、1、1、2。1868年,發表了第二張周期表,增加了24個元素和9個縱行,並區分了主族和副族。邁耶爾的第三張元素周期表發表於1870年,他採用了豎式周期表的形式,並且預留了一些空位給有待發現的元素,但是表中沒有氫元素。可以說,邁耶爾已經發現了元素周期律。
詳細解讀
表格說明
 化學元素周期表
化學元素周期表而同一欄中的則稱為同一族,同一族的元素有著相似的化學性質。
在印刷的周期表中,會列出元素的符號和原子序數。而很多亦會附有以下的資料,以元素X為例:
A:質量數(Massnumber),即在數量上等於原子核(質子加中子)的粒子數目。Z:原子序數,即是質子的數目。由於它是固定的,一般不會標示出來。e:淨電荷,正負號寫在數字後面。n:原子數目,元素在非單原子狀態(分子或化合物)時的數目。除此之外,部份較高級的周期表更會列出元素的電子排布、電負性和價電子數目。
元素讀音
第一周期元素:1氫(qīng)2氦(hài)
第二周期元素:3鋰(lǐ)4鈹(pí)5硼(péng)6碳(tàn)7氮(dàn)8氧(yǎng)9氟(fú)10氖(nǎi)
第三周期元素:11鈉(nà)12鎂(měi)13鋁(lǚ)14矽(guī)15磷(lín)16硫(liú)17氯(lǜ)18氬(yà)
第四周期元素:19鉀(jiǎ)20鈣(gài)21鈧(kàng)22鈦(tài)23釩(fán)24鉻(gè)25錳(měng)26鐵(tiě)27鈷(gǔ)28鎳(niè)29銅(tóng)30鋅(xīn)31鎵(jiā)32鍺(zhě)33砷(shēn)34硒(xī)35溴(xiù)36氪(kè)
第五周期元素:37銣(rú)38鍶(sī)39釔(yǐ)40鋯(gào)41鈮(ní)42鉬(mù)43鎝(dé)44釕(liǎo)45銠(lǎo)46鈀(bǎ)47銀(yín)48鎘(gé)49銦(yīn)50錫(xī)51銻(tī)52碲(dì)53碘(diǎn)54氙(xiān)
第六周期元素:55銫(sè)56鋇(bèi)57鑭(lán)58鈰(shì)59鐠(pǔ)60釹(nǚ)61鉕(pǒ)62釤(shān)63銪(yǒu)64釓(gá)65鋱(tè)66鏑(dī)67鈥(huǒ)68鉺(ěr)69銩(diū)70鐿(yì)71鑥(lǔ)72鉿(hā)73鉭(tǎn)74鎢(wū)75錸(lái)76鋨(é)77銥(yī)78鉑(bó)79金(jīn)80汞(gǒng)81鉈(tā)82鉛(qiān)83鉍(bì)84釙(pō)85砹(ài)86氡(dōng)
第七周期元素:87鍅(fāng)88鐳(léi)89錒(ā)90釷(tǔ)91鏷(pú)92鈾(yóu)93鎿(ná)94鈽(bù)95鎇(méi)96鋦(jú)97錇(péi)98鐦(kāi)99鑀(āi)100鐨(fèi)101鍆(mén)102鍩(nuò)103鐒(láo)104鈩(lú)105 (dù)106 (xǐ)107 (bō)108 (hēi)109䥑(mài)110鐽(dá)111錀(lún)112鎶(gē)[暫定]
註:新元素漢字請使用Win7系統瀏覽,XP系統下無法顯示。104-10
9金屬元素字元XP系統下拼湊顯示為釒盧(lú)釒杜(dù)釒喜(xǐ)釒波(bō)釒黑(hēi)釒麥(mài)。
元素的外層電子殼層結構
遞進循環
原子半徑
(1)除第1周期外,其他周期元素(稀有氣體元素除外)的原子半徑隨原子序數的遞增而減小;
(2)同一族的元素從上到下,隨電子層數增多,原子半徑增大。
注意:原子半徑在IVB族及此後各副族元素中出現反常現象。從鈦至鋯,其原子半徑合乎規律地增加,這主要是增加電子層數造成的。然而從鋯至鉿,儘管也增加了一個電子層,但半徑反而減小了,這是與它們對應的前一族元素是釔至鑭,原子半徑也合乎規律地增加(電子層數增加)。然而從鑭至鉿中間卻經歷了鑭系的十四個元素,由於電子層數沒有改變,隨著有效核電荷數略有增加,原子半徑依次收縮,這種現象稱為“鑭系收縮”。鑭系收縮的結果抵消了從鋯至鉿由於電子層數增加到來的原子半徑應當增加的影響,出現了鉿的原子半徑反而比鋯小的“反常”現象。
元素變化規律
(1)除第一周期外,其餘每個周期都是以金屬元素開始逐漸過渡到非金屬元素,最後以稀有氣體元素結束。
(2)每一族的元素的化學性質相似
元素化合價
(1)除第1周期外,同周期從左到右,元素最高正價由鹼金屬+1遞增到+7,非金屬元素負價由碳族-4遞增到-1(氟無正價,氧無+6價,除外),皆呈階梯式變化。
(2)同一主族的元素的最高正價、負價均相同。
(3)所有單質都顯零價。
單質的熔點
(1)同一周期元素隨原子序數的遞增,元素組成的金屬單質的熔點遞增,非金屬單質的熔點遞減;
(2)同一族元素從上到下,元素組成的金屬單質的熔點遞減,非金屬單質的熔點遞增。
元素金屬性
(1)同一周期的元素電子層數相同。因此隨著核電荷數的增加,原子越容易得電子,從左到右金屬性遞減,非金屬性遞增;
(2)同一主族元素最外層電子數相同,因此隨著電子層數的增加,原子越容易失電子,從上到下金屬性遞增,非金屬性遞減。
最高價氧化物
元素的金屬性越強,其最高價氧化物的水化物的鹼性越強;元素的非金屬性越強,最高價氧化物的水化物的酸性越強。
非金屬
元素非金屬性越強,氣態氫化物越穩定。同周期非金屬元素的非金屬性越強,其氣態氫化物水溶液一般酸性越強;同主族非金屬元素的非金屬性越強,其氣態氫化物水溶液的酸性越弱。
單質的氧化性
一般元素的金屬性越強,其單質的還原性越強,其氧化物的陽離子氧化性越弱;元素的非金屬性越強,其單質的氧化性越強,其簡單陰離子的還原性越弱。
元素周期律
概述
元素周期表是元素周期律用表格表達的具體形式,它反映元素原子的內部結構和它們之間相互聯繫的規律。元素周期表簡稱周期表。元素周期表有很多種表達形式,目前最常用的是維爾納長式周期表。元素周期表有7個周期,有16個族和4個區。元素在周期表中的位置能反映該元素的原子結構。周期表中同一橫列元素構成一個周期。同周期元素原子的電子層數等於該周期的序數。同一縱行(第Ⅷ族包括3個縱行)的元素稱“族”。族是原子內部外電子層構型的反映。例如外電子構型,IA族是ns1,IIIA族是ns2np1,O族是ns2np4,IIIB族是(n-1)d1·ns2等。元素周期表能形象地體現元素周期律。根據元素周期表可以推測各種元素的原子結構以及元素及其化合物性質的遞變規律。當年,門捷列夫根據元素周期表中未知元素的周圍元素和化合物的性質,經過綜合推測,成功地預言未知元素及其化合物的性質。現在科學家利用元素周期表,指導尋找製取半導體、催化劑、化學農藥、新型材料的元素及化合物。
現代化學的元素周期律是1869年俄國科學家德米特里·伊萬諾維奇·門捷列夫(DmitriIvanovichMendeleev)首先整理,他將當時已知的63種元素依原子量大小並以表的形式排列,把有相似化學性質的元素放在同一行,就是元素周期表的雛形。利用周期表,門捷列夫成功的預測當時尚未發現的元素的特性(鎵、鈧、鍺)。1913年英國科學家莫色勒利用陰極射線撞擊金屬產生X射線,發現原子序數越大,X射線的頻率就越長,因此他認為原子核的正電荷決定了元素的化學性質,並把元素依照核內正電荷(即質子數或原子序數)排列,經過多年修訂後才成為當代的周期表。當然還有未知元素等待我們探索.
這張表揭示了物質世界的秘密,把一些看來似乎互不相關的元素統一起來,組成了一個完整的自然體系。
位置規律
判斷元素在周期表中位置應牢記的規律:
(1)元素周期數等於核外電子層數;
(2)主族元素的族數等於最外層電子數。
陰陽離子的半徑大小辨別規律
由於陰離子是電子最外層得到了電子而陽離子是失去了電子
所以,總的來說(同種元素)
(1)陽離子半徑<原子半徑
(2)陰離子半徑>原子半徑
(3)陰離子半徑>陽離子半徑
(4)對於具有相同核外電子排布的離子,原子序數越大,其離子半徑越小。
(不適合用於稀有氣體)
作用意義
1869年,門捷列夫發現了元素周期律和元素周期表,在元素周期律的指導下,利用元素之間的一些規律性知識來分類學習物質的性質,就使化學學習和研究變得有規律可循。現在,化學家們已經能利用各種先進的儀器和分析技術對化學世界進行微觀的探索,並正在探索利用納米技術製造出具有特定功能的產品,使化學在材料、能源、環境和生命科學等研究上發揮越來越重要的作用。
發展歷史
元素周期律的發現是許多科學家共同努力的結果:
1789年,安托萬-洛朗·拉瓦錫出版的《化學大綱》中發表了人類歷史上第一張《元素表》,在該表中,他將當時已知的23種元素分四類。1829年,德貝萊納在對當時已知的54種元素進行了系統的分析研究之後,提出了元素的三元素組規則。他發現了幾組元素,每組都有三個化學性質相似的成員。並且,在每組中,居中的元素的原子量,近似於兩端元素原子量的平均值。
1850年,德國人培頓科弗宣布,性質相似的元素並不一定只有三個;性質相似的元素的原子量之差往往為8或8的倍數。
1862年,法國化學家尚古多創建了《螺鏇圖》,他創造性地將當時的62種元素,按各元素原子量的大小為序,標誌著繞著圓柱一升的螺鏇線上。他意外地發現,化學性質相似的元素,都出現在同一條母線上。
1863年,英國化學家歐德林發表了《原子量和元素符號表》,共列出49個元素,並留有9個空位。上述各位科學家以及他們所做的研究,在一定程度上只能說是一個前期的準備,但是這些準備工作是不可缺少的。而俄國化學家門捷列夫、德國化學家邁爾和英國化學家紐蘭茲在元素周期律的發現過程中起了決定性的作用。
1865年,紐蘭茲正在獨立地進行化學元素的分類研究,在研究中他發現了一個很有趣的現象。當元素按原子量遞增的順序排列起來時,每隔8個元素,元素的物理性質和化學性質就會重複出現。由此他將各種元素按著原子量遞增的順序排列起來,形成了若干族系的周期。紐蘭茲稱這一規律為“八音律”。這一正確的規律的發現非但沒有被當時的科學界接受,反而使它的發現者紐蘭茲受盡了非難和侮辱。直到後來,當人人已信服了門氏元素周期之後才警醒了,英國皇家學會對以往對紐蘭茲不公正的態度進行了糾正。門捷列夫在元素周期的發現中可謂是中流砥柱,不可避免地,他在研究工作中亦接受了包括自己的老師在內的各個方面的不理解和壓力。
門捷列夫出生於1834年,俄國西伯利亞的托博爾斯克市,他出生不久,父親就因雙目失明出外就醫,失去了得以維持家人生活的教員職位。門捷列夫14歲那年,父親逝世,接著火災又吞沒了他家中的所有財產,真是禍不單行。1850年,家境困頓的門捷列夫藉著微薄的助學金開始了他的大學生活,後來成了彼得堡大學的教授。
幸運的是,門捷列夫生活在化學界探索元素規律的卓絕時期。當時,各國化學家都在探索已知的幾十種元素的內在聯繫規律。
1865年,英國化學家紐蘭茲把當時已知的元素按原子量大小的順序進行排列,發現無論從哪一個元素算起,每到第八個元素就和第一個元素的性質相近。這很像音樂上的八度音循環,因此,他乾脆把元素的這種周期性叫做“八音律”,並據此畫出了標示元素關係的“八音律”表。
顯然,紐蘭茲已經下意識地摸到了“真理女神”的裙角,差點就揭示元素周期律了。不過,條件限制了他作進一步的探索,因為當時原子量的測定值有錯誤,而且他也沒有考慮到還有尚未發現的元素,只是機械地按當時的原子量大小將元素排列起來,所以他沒能揭示出元素之間的內在規律。
可見,任何科學真理的發現,都不會是一帆風順的,都會受到阻力,有些阻力甚至是人為的。當年,紐蘭茲的“八音律”在英國化學學會上受到了嘲弄,主持人以不無譏諷的口吻問道:“你為什麼不按元素的字母順序排列?”
門捷列夫顧不了這么多,他以驚人的洞察力投入了艱苦的探索。直到1869年,他將當時已知的63種元素的主要性質和原子量,寫在一張張小卡片上,進行反覆排列比較,才最後發現了元素周期規律,並依此制定了元素周期表。
元素周期表的發現,是近代化學史上的一個創舉,對於促進化學的發展,起了巨大的作用。看到這張表,人們便會想到它的最早發明者——門捷列夫。
元素命名
IUPAC命名法
很多人注意到,元素周期表最後幾位元素永遠是以um結尾的,其實這只是一種臨時命名規則,叫IUPAC元素系統命名法。在這種命名法中,會為未發現元素和已發現但尚未正式命名的元素取一個臨時西方文字名稱並規定一個代用元素符號,使用拉丁文數字頭以該元素之原子序來命名。此規則簡單易懂且使用方便,而且它解決了對新發現元素搶先命名的惡性競爭問題,使為新元素的命名有了依據。如ununquadium便是由un(一)-un(一)-quad(四)-ium(元素)四個字根組合而成,表示“元素114號”。元素114命名為flerovium(Fl),以紀念蘇聯原子物理學家喬治·弗洛伊洛夫(GeorgyFlyorov,1913-1990);而ununhexium便是由un(一)-un(一)-hex(六)-ium(元素)四個字根組合而成,表示“元素116號”。元素116名為livermorium(Lv),以實驗室所在地利弗莫爾市為名。
系統命名法
元素周期表第113號元素和115號以及117號之後開始沒有特定的名稱,而是用系統命名法。具體規則為:
1:u
2:b
3:t
4:q
5:p
6:h
7:s
8:o
9:e
0:n
比如第112號元素為Uub(2010年起被命名為為Cn)、第113號元素為Uut、第114號Uuq(2012年10月起被命名為為Fl)、116號Uuh(2012年10月起被命名為Lv),以此類推。
新命名
“(釒爾)”“(鏌)”“(石田)”“(氣奧)”是4個化學新元素113號Nh、115號Mc、117號Ts、118號Og新定的中文名字,其中後兩個是新造字,被依次定音為“nǐ”“mò”“tián”“ào”。2017年5月9日下午,中國科學院、國家語言文字工作委員會、全國科學技術名詞審定委員會聯合召開發布會,向社會正式公布了四個新元素的中文定名。
學習技巧
化合價
 化學元素周期表
化學元素周期表化合價口決
負一硝酸氫氧根(硝酸根NO3-,氫氧根OH-),負二硫酸碳酸根(硫酸根【SO4】2-碳酸根【CO3】2-),還有負三磷酸根(【PO4】3-),只有銨根(NH4+)是正一
記金屬活動性順序表可以按照下面的口訣來記:
鉀鈣鈉鎂鋁、鋅鐵錫鉛氫、銅汞銀鉑金。
周期表分行列,7行18列,
行為周期列為族。
周期有七,
三短(1,2,3)三長(4,5,6)一不全(7),
28818183232滿
6、7鑭錒各15。
族分7主7副1Ⅷ零,
長短為主,長為副。
1到8重複現,
2、3分主副,先主後副。
Ⅷ特8、9、10,
Ⅷ、副全金為過渡。
小故事來背誦
青海
青海有一個富人叫李皮朋,他整天用煤炭煮雞蛋供養著佛奶。他女兒那美女去旅桂林,回來卻留了綠牙。後來只能嫁給了一個叫康太的反革命。剛嫁入門的那天,就被小姑子號稱“鐵姑”狠狠地捏了一把,新娘一生氣,當時就休克了。
這下不得了,娘家要上告了。鐵姑的老爸和她的哥哥夜入縣太爺府,把大印假偷走一直往西跑,跑到一個仙人住的地方。
這裡風景優美:彩色貝殼藍藍的河,一隻烏鴉用一縷長長的白巾牽來一隻鵝,因為它們不喜歡冬天,所以要去南方,一路上還相互提醒:南方多雨,要注意防雷啊。
在來把這個故事濃縮一下(橫列):
第一周期:氫氦----青海
第二周期:鋰鈹硼碳氮氧氟氖----李皮朋碳蛋養佛奶
第三周期:鈉鎂鋁矽磷硫氯氬----那美女旅桂林留綠牙(那美女鬼流露綠牙)
第四周期:鉀鈣鈧鈦釩鉻錳----嫁改康太反革命(錳念meng3)
鐵鈷鎳銅鋅鎵鍺----鐵姑捏痛新嫁者
砷硒溴氪----生氣(硒念xi1)休(溴念xiu4)克
第五周期:銣鍶釔鋯鈮----如此(鍶念si1)一告你
鉬鎝釕----不(鉬念mu4)得了
銠鈀銀鎘銦錫銻----老把銀哥印西堤
碲碘氙----地點仙
第六周期:銫鋇鑭鉿----(彩)色貝(殼)藍(色)河
鉭鎢錸鋨----但(見)烏(鴉)(引)來鵝
銥鉑金汞鉈鉛----一白巾供它牽
鉍釙砹氡----必不愛冬(天)
第七周期:鍅鐳錒----防雷啊!
縱列
氫鋰鈉鉀銣銫鍅請李娜加入私訪(李娜什麼時候當皇上啦)
鈹鎂鈣鍶鋇鐳媲美蓋茨被累(呵!想和比爾.蓋茨媲美,小心累著)
硼鋁鎵銦鉈碰女嫁音他(看來新郎新娘都改名了)
碳矽鍺錫鉛探歸者西遷
氮磷砷銻鉍蛋臨身體閉
氧硫硒碲釙養牛西蹄撲
氟氯溴碘砹父女繡點愛(父女情深啊)
氦氖氬氪氙氡害耐亞克先動
溶解性口訣
鉀鈉銨鹽溶(鉀鹽鈉鹽銨鹽都溶於水和酸)
硝酸鹽相同(硝酸鹽同上)
鉀鈉鈣和鋇(氫氧化鉀氫氧化鈉氫氧化鈣氫氧化鋇)
溶鹼有四種(上面四種是可溶性的鹼)
氯除銀亞汞(鹽酸鹽除了銀亞汞其他都溶)
硫酸除鉛鋇(硫酸鹽除了鉛和鋇其他都溶)
(請注意,溶解性口訣中,所謂的溶解範圍只在初、高中的課本範圍內適用,也有一部分鉀、鈉、銨鹽,硝酸鹽,氯化物,硫酸鹽難溶而不在口訣中,除上述四種鹼外,也有其他可溶的氫氧化物。)
記憶口訣
一價氫氯鉀鈉銀
二價氧鈣鋇鎂鋅
三鋁四矽五價磷
二三鐵二四碳
一至五價都有氮銅汞二價最常見
正一銅氫鉀鈉銀正二銅鎂鈣鋇鋅
三鋁四矽二四六硫二四五氮三五磷
一五七氯二三鐵二四六七錳為正
碳有正四與正二再把負價牢記心
負一溴碘與氟氯負二氧硫三氮磷
常見原子團
負一硝酸氫氧根,負二硫酸碳酸根,還有負三磷酸根,只有銨根是正一。
金屬活動性
鉀鈣鈉鎂鋁(嫁給那美女)、鋅鐵錫鉛(薪貼七千)【氫】銅汞銀鉑金(童工贏鉑金)
【K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)Cu、Hg、Ag、Pt、Au】
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||