 元素
元素 元素,又稱化學元素,指自然界中一百多種基本的金屬和非金屬物質,它們只由一種原子組成,其原子中的每一核子具有同樣數量的質子,用一般的化學方法不能使之分解,並且能構成一切物質。 一些常見元素的例子有氫,氮和碳。到2007年為止,總共有118種元素被發現,其中94種是存在於地球上。擁有原子序數大於82(即鉍及之後的元素)都是不穩定,並會進行放射衰變。 第43和第61種元素(即鎝和鉕)沒有穩定的同位素,會進行衰變。可是,即使是原子序數高達94,沒有穩定原子核的元素都一樣能在自然中找到,這就是鈾和釷的自然衰變。所有化學物質都包含元素,即任何物質都包含元素,隨著人工的核反應,更多的新元素將會被發現出來。
概述
元素是具有相同核電荷數( 質子數)的同一類 原子的總稱。例如, 氧元素就是所有的 核電荷數為8 的氧原子的總稱。 化學元素能夠互相化合,形成 化合物,它們的數目幾乎是無限的,但組成化合物的元素並不多,到1990年為止,已經確認的化學元素共有109種。其中,常溫下是 氣體的有11種,它們是 氫、 氟、 氯、 氧、 氮、 氦、 氖、 氬、 氪、 氙、 氡;常溫下是 液體的有兩種,即 汞和 溴;其他元素在常溫下都是固體。有28種是 放射性元素 ,其中8種是 天然放射性元素 ,20種是 自然界極少存在或完全沒有的,是用人工核反應製取的元素 。最古老的哲學家都認為所有的物質都是由少數幾種元素組成的,這些元素是空氣、土、火、水 ,有的則認為元素是4種最原始的性質(熱、冷、乾、濕)的組合構成了萬物。第一次為化學元素下了科學定義的是英國R.玻意耳,1661年 ,他在《懷疑派化學家》一書中指出 :“它們(指元素)應當是某種不由任何其他物質所構成的或是互相構成的、原始的和最簡單的物質”;“應該是一些具有確定性質的、實在的、可覺察到的實物,用一般化學方法不能再分解為更簡單的某些實物”。隨著原子學說和原子結構理論的出現,明確了決定化學元素性質的主要因素是核外電子數和核電荷數,才有了闡明元素本質的現代定義:“具有相同核電荷數的同一類原子的總稱。”
歷史起源
 元素周期表
元素周期表 除此之外,希臘哲學家恩培多克勒(Empedocles)在其著作四元素說中,也使用了"元素"一詞。在公元前350年,亞里斯多德構想出五元素說,在柏拉圖的四種元素中再加上空,他將元素定義為:“ one of those bodies into which other bodies can be decomposed and which itself is not capable of being divided into other. ” —Partington, J.R.(1937).A Short History of Chemistry.New York:Dover Publications, Inc..ISBN 0486659771.建基於以上的理論,在公元790年,阿拉伯化學家賈比爾(Jabir ibn-Hayyan (Geber)) 假設出金屬由兩種元素組成:硫,作為"火石",用以解釋其可燃性,和水銀,用以解釋理想中的金屬性質。總括而言,這逐步形成了三個原理:硫使金屬有可燃性,水銀使金屬有揮發性和穩定性,而鹽使金屬有固體性。
存在
只有少數化學元素以游離狀態存在於地殼中,例如氧、氮、氦、氖、氬、氪、氙、氡、硫、銅、銀、金、鉑。大多數化學元素都以化合物(氧化物、硫化物、含氧酸鹽)狀態存在。對太陽和行星的光譜分析和對隕石組分的分析所得結果說明,宇宙中含量最多的元素是氫,占99%左右,其次是氦。地殼中含量最多的元素是氧。原子序數為偶數的元素比原子序數為奇數的相鄰元素的含量為高。
中文命名
 碳纖維
碳纖維 “釒”為固體金屬。例: 銅、 銠
“石”為類金屬。例: 矽、 碳
“氣”為氣體。例:氧、氟
“氵”和“水”為液體。例:汞、溴
除了從古代中國就發現而且常用的元素(金、銀、銅、鐵、鉑、錫、硫、碳、硼、汞、鉛),元素的名稱是十九、二十世紀創造的,組成由個部首和表示讀音的部分。讀音部分幾乎全部是大約根據歐洲和北美洲現代或中古化學家或地方的名稱的第一個音節,例如:
Er(Erbium)=釒+耳→鉺
Nd(Neodymium,)=釒+女→釹
Eu(Europium)=釒+有→銪
Ka(Kalium)=釒+甲→鉀
Na(Natrium)=釒+內→鈉
Sb(Stibium)=釒+弟→銻(用第一音節的一部分)
I(Iodine)=石+典→碘(用最後音節)
Ar(Argon)=-{氣}-+亞→氬(用第一音節的一部分)
少數部分元素中文名字是描述特色:
溴:味道臭
氯:顏色綠
氫:重量輕
氮:“淡”取沖淡空氣之意
磷:發磷光或磷火
氧:“養”取支持生命之意
鉑:白色的金
元素簡介
前8號元素
1.氫(qīng)H 1.00794(7)
氫[hydrogen],金屬氫[Hydrogenium]。氣體元素符號。無色無臭無味。是元素中最輕的。工業上用途很廣。{氫氣}
1H氕[protium]。原子核中有一個質子,是氫的主要成分,普通的氫中含有99.98%的氕。
D 或21H氘[deuterium]。原子核中有一個質子和一個中子,普通的氫中含有0.02%的氘。
用於熱核反應。{重氫}
T或31H氚[tritium]。原子核中有一個質子和兩個中子。有放射性。{超重氫}
2. 氦(haì)He 4.002602(2)
氦[helium]。氣體元素符號。無色無臭無味,在大氣層含量極少,化學性質極不活潑。
用來填充燈泡和霓虹燈管,也用來製造泡沫塑膠。液態的氦常用做製冷劑。{氦氣}
3. 鋰(lǐ)Li 6.941(2)
鋰[lithium]。金屬元素符號。銀白色,在空氣中易氧化而變黑,質軟,是金屬中最輕的
化學性質活潑。用於原子能工業和冶金工業,也用來制特種合金、特種玻璃等。
4. 鈹(pí)Be 9.012182(3)
鈹[beryllium]。金屬元素符號。灰白色,質硬而輕。用於原子能工業中,鈹鋁合金用來制
飛機、火箭等。
5. 硼(péng)B10.811 (5)
硼[Boron]。金屬元素符號。黑色或銀灰色固體。晶體硼為黑色,熔點約2300°C,沸點3658°C,密度2.34克/厘米³,硬度僅次於金剛石,較脆。
6. 碳( tan)C 12.011 (6)
碳[Carbonium]。碳是一種非金屬元素。碳是一種很常見的元素,它以多種形式廣泛存在於大氣和地殼之中。碳單質很早就被人認識和利用,碳的一系列化合物——有機物更是生命的根本。
7. 氮 (dàn)N 14.007 (7)
氮[nitrogen]。氣體元素符號。元素名來源於希臘文,原意是“硝石”。1772年由瑞典藥劑師舍勒和英國化學家盧瑟福同時發現,後由法國科學家拉瓦錫確定是一種元素。氮在地殼中的含量為0.0046%,自然界絕大部分的氮是以單質分子氮氣的形式存在於大氣中,氮氣占空氣體積的78%。氮的最重要的礦物是硝酸鹽。氮有兩種天然同位素:氮14和氮15,其中氮14的豐度為99.625%。
8.氧 (yǎng)O 15.9994
氧[Oxygenium]。氣體元素。舊譯作氱。希臘文的意思是“酸素”,該名稱是由法國化學家拉瓦錫所起,原因是拉瓦錫錯誤地認為,所有的酸都含有這種新氣體。2013年日文里氧氣的名稱仍然是“酸素”。而台語受到台灣日治時期的影響,也以“酸素”之日語發音稱呼氧氣。
周期規律
 元素分析儀
元素分析儀 周期律在使化學知識特別是無機化學知識的系統化上起了重要作用,對於研究無機化合物的分類、性質、結構及其反應方面起了指導作用。周期律在指導原子核的研究上也有深刻的影響,放射性的位移定律就是以周期律為依據的,原子核的種種人工蛻變也都是按照元素在周期表中的位置來實現的。20世紀以後,新元素的不斷發現,填充了周期表中的空位,科學家在周期律指導下,還合成了超鈾元素,並發展了錒系理論。在原子結構的研究上,也獲得了殼層結構的周期規律。
同位素
其後,英國物理學家阿斯頓在1921年證明大多數化學元素都有不同的同位素。元素的原子量是同位素質量按同位素在自然界中存在的質量分數求得的平均值。
在這同一時期里英國物理學家莫塞萊在1913年系統地研究了由各種元素製成的陰極所得的X射線的波長,指出元素的特徵是這個元素的原子的核電荷數,也就是後來確定的原子序數。
這樣,如果把同位素看作是幾種不同的單獨的元素,這顯然是不合理的。因為決定元素的原子的特徵不是原子量,而是它的核電荷數。
1923年,國際原子量委員會作出決定:化學元素是根據原子核電荷的多少對原子進行分類的一種方法,把核電荷數相同的一類原子稱為一種元素
世界觀點
國內歷史
公元前403一公元前221年,我國戰國時代又出現一些萬物本源的論說,如《老子道德經》中寫道:"道生一,一生二,二生三,三生萬物。"又如《管子·水地》中說:"水者,何也?萬物之本原也。"
我國的五行學說是具有實物意義的,但有時又表現為基本性質。我國的五行學說最早出現在戰國末年的《尚書》中,原文是:"五行:一曰水,二曰火,三曰木,四曰金,五曰土。水曰潤下,火曰炎上,木曰曲直,金曰從革,土曰稼穡。"譯成今天的語言是:"五行:一是水,二是火,三是木,四是金,五是土。水的性質潤物而向下,火的性質燃燒而向上。木的性質可曲可直,金的性質可以熔鑄改造,土的性質可以耕種收穫。"在稍後的《國語》中,五行較明顯地表示了萬物原始的概念。原文是:"夫和實生物,同則不繼。以他平他謂之和,故能豐長而物生之。若以同稗同,盡乃棄矣。故先王以土與金、木、水、火雜以成百物。"譯文是:"和諧才是創造事物的原則,同一是不能連續不斷永遠長有的。把許多不同的東西結合在一起而使它們得到平衡,這叫做和諧,所以能夠使物質豐盛而成長起來。如果以相同的東西加合在一起,便會被拋棄了。所以,過去的帝王用土和金、木、水、火相互結合造成萬物。"
西方的自然學派
13-14世紀,西方的鍊金術士們對亞里士多德提出的元素又作了補充,增加了3種元素:水銀、硫磺和鹽。這就是鍊金術士們所稱的三本原。但是,他們所說的水銀、硫磺、鹽只是表現著物質的性質:水銀--金屬性質的體現物,硫磺--可燃性和非金屬性質的體現物,鹽--溶解性的體現物。
到16世紀,瑞士醫生帕拉塞爾士把鍊金術士們的三本原套用到他的醫學中。他提出物質是由3種元素--鹽(肉體)、水銀(靈魂)和硫磺(精神)按不同比例組成的,疾病產生的原因是有機體中缺少了上述3種元素之一;為了醫病,就要在人體中注人所缺少的元素
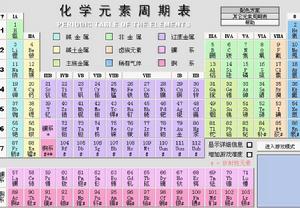
元素周期表
元素周期表是1869年俄國科學家門捷列夫(Dmitri Mendeleev)首創的,後來又經過多名科學家多年的修訂才形成當代的周期表。
元素周期表中共有118種元素。每一種元素都有一個編號,大小恰好等於該元素原子的核內電子數目,這個編號稱為原子序數。
原子的核外電子排布和性質有明顯的規律性,科學家們是按原子序數遞增排列,將電子層數相同的元素放在同一行,將最外層電子數相同的元素放在同一列。
元素周期表有7個周期,16個族。每一個橫行叫作一個周期,每一個縱行叫作一個族。這7個周期又可分成短周期(1、2、3)、長周期(4、5、6)和不完全周期(7)。共有16個族,又分為7個主族(ⅠA-ⅦA),7個副族(ⅠB-ⅦB),一個第ⅧB族,一個零族。
元素在周期表中的位置不僅反映了元素的原子結構,也顯示了元素性質的遞變規律和元素之間的內在聯繫。
同一周期內,從左到右,元素核外電子層數相同,最外層電子數依次遞增,原子半徑遞減(零族元素除外)。失電子能力逐漸減弱,獲電子能力逐漸增強,金屬性逐漸減弱,非金屬性逐漸增強。元素的最高正氧化數從左到右遞增(沒有正價的除外),最低負氧化數從左到右遞增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外層電子數相同,核外電子層數逐漸增多,原子序數遞增,元素金屬性遞增,非金屬性遞減。
同一族中的金屬從上到下的熔點降低,硬度減小,同一周期的主族金屬從左到右熔點升高,硬度增大。
元素周期表的意義重大,科學家正是用此來尋找新型元素及化合物
1 H氫1.0079
2 He氦4.0026
3 Li鋰6.941
4 Be鈹9.0122
5 B硼10.811
6 C碳12.011
7 N氮14.007
8 O氧15.999
9 F氟18.998
10 Ne氖20.17
11 Na鈉22.9898
12 Mg鎂24.305
13 Al鋁26.982
14 Si矽28.085
15 P磷30.974
16 S硫32.06
17 Cl氯35.453
18 Ar氬39.94
19 K鉀39.098
20 Ca鈣40.08
21 Sc鈧44.956
22 Ti鈦47.9
23 V 釩50.94
24 Cr鉻51.996
25 Mn錳54.938
26 Fe鐵55.84
27 Co鈷58.9332
28 Ni鎳58.69
29 Cu銅63.54
30 Zn鋅65.38
31 Ga鎵69.72
32 Ge鍺72.5
33 As砷74.922
34 Se硒78.9
35 Br溴79.904
36 Kr氪83.8
37 Rb銣85.467
38 Sr鍶87.62
39 Y 釔88.906
40 Zr鋯91.22
41 Nb鈮92.9064
42 Mo鉬95.94
43 Tc鎝(99)
44 Ru釕161.0
45 Rh銠102.906
46 Pd鈀106.42
47 Ag銀107.868
48 Cd鎘112.41
49 In銦114.82
50 Sn錫118.6
51 Sb銻121.7
52 Te碲127.6
53 I碘126.905
54 Xe氙131.3
55 Cs銫132.905
56 Ba鋇137.33
57-71La-Lu鑭系
57 La鑭138.9
58 Ce鈰140.1
59 Pr鐠140.9
60 Nd釹144.2
61 Pm鉕(147)
62 Sm釤150.3
63 Eu銪151.96
64 Gd釓157.25
65 Tb鋱158.9
66 Dy鏑162.5
67 Ho鈥164.9
68 Er鉺167.2
69 Tm銩168.9
70 Yb鐿173.04
71 Lu鑥174.967
72 Hf鉿178.4
73 Ta鉭180.947
74 W鎢183.8
75 Re錸186.207
76 Os鋨190.2
77 Ir銥192.2
78 Pt鉑195.08
79 Au金196.967
80 Hg汞200.5
81 Tl鉈204.3
82 Pb鉛207.2
83 Bi鉍208.98
84 Po釙(209)
85 At砹(201)
86 Rn氡(222)
87 Fr鍅(223)
88 Ra鐳226.03
89-103Ac-Lr錒系
89 Ac錒(227)
90 Th釷232.0
91 Pa鏷231.0
92 U鈾238.0
93 Np鎿(237)
94 Pu鈽(239,244)
95 Am鎇(243)
96 Cm鋦(247)
97 Bk錇(247)
98 Cf鐦(251)
99 Es鑀(252)
100 Fm鐨(257)
101 Md鍆(258)
102 No鍩(259)
103 Lr鐒(260)
104 Rf釒盧(257)
105 Db釒杜(261)
106 Sg釒喜(262)
107 Bh釒波(263)
108 Hs釒黑(262)
109 Mt釒麥(265)
110 Ds釒達(266)
111 Rg釒侖(272)
112 Uub(285)
113 Uut(284)
114 uuq(289)
116 Uuh(292)
118 Uuo(293)
……
元素金屬性的強弱
金屬性--金屬原子在氣態時失去 電子能力強弱(需要吸收能量)的性質金屬活動性--金屬原子在水溶液中失去電子能力強弱的性質
☆註:“金屬性”與“金屬活動性”並非同一概念,兩者有時表示為不一致,如Cu和Zn:金屬性是:Cu>Zn,而金屬活動性是:Zn>Cu
1.在一定條件下金屬單質與水反應的難易程度和 劇烈程度。一般情況下,與水反應越容易、越劇烈,其金屬性越強。
2.常溫下與同濃度酸反應的難易程度和劇烈程度。一般情況下,與酸反應越容易、越劇烈,其金屬性越強。
3.依據最高價氧化物的水化物鹼性的強弱。鹼性越強,其元素的 金屬性越強。
4.依據金屬單質與鹽溶液之間的置換反應。一般是活潑金屬置換不活潑金屬。但是ⅠA族和ⅡA族的金屬在與鹽溶液反應時,通常是先與水反應生成對應的強鹼和氫氣,然後強鹼再可能與鹽發生複分解反應。
5.依據金屬活動性順序表(極少數例外)。
6.依據 元素周期表。同周期中,從左向右,隨著核電荷數的增加,金屬性逐漸減弱;同主族中,由上而下,隨著核電荷數的增加,金屬性逐漸增強。
7.依據原電池中的電極名稱。做負極材料的金屬性強於做正極材料的金屬性。
8.依據電解池中陽離子的放電(得電子,氧化性)順序。優先放電的陽離子,其元素的金屬性弱。
9.氣態金屬原子在失去電子變成穩定結構時所消耗的能量越少,其金屬性越強。
![元素[化學名詞] 元素[化學名詞]](/img/9/1db/nBnauM3XwITMxgDNxMDO2ITO5MTM4QTOwITNyQTNwAzMwIzLzgzL2YzLt92YucmbvRWdo5Cd0FmLwE2LvoDc0RHa.jpg)
