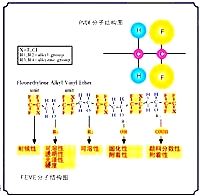
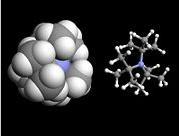
 空間位阻效應
空間位阻效應基本介紹
 空間位阻效應
空間位阻效應類型分析
 空間位阻效應
空間位阻效應空間位阻禁止時發生收費組的分子似乎是削弱或禁止的空間少收費(或生地收費)原子,包括抗衡離子在溶液中(德拜禁止)。在某些情況下,一個原子的互動空間位阻禁止原子,就必須從一個辦法附近那裡不到禁止,從而控制下,從什麼方向的分子相互作用才能進行。
空間位阻吸引力時,就會發生分子形狀或幾何形狀的最佳化的互動合作。在這些案件中的分子反應,將對方往往是在具體安排。
鏈跨越-以無規捲曲不能改變從一個象一個密切相關的形狀由一個小型的位移,如果它需要一個高分子鏈通過他人,或通過本身。
電子影響
 | |
| 空間位阻效應 | |
科技運用
 | |
| 空間位阻效應 | |
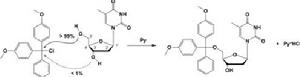
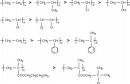
胺醚的製備
 | |
| 空間位阻效應 | |
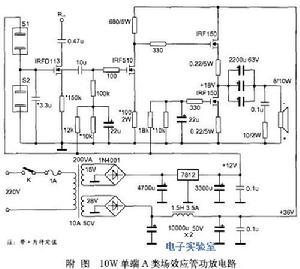
現實意義
 | |
| 空間位阻效應 | |
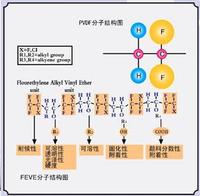
例子分析
 | |
| 空間位阻效應 | |