定義
 離子鍵
離子鍵簡介
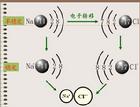
 電子、原子核(含中子 質子)-模型圖
電子、原子核(含中子 質子)-模型圖 此類化學鍵往往在金屬與非金屬間形成。失去電子的往往是金屬元素的原子,而獲得電子的往往是非金屬元素的原子。通常,活潑金屬與活潑非金屬形成離子鍵,如鉀、鈉、鈣等金屬和氯、溴等非金屬化合時,都能形成離子鍵。
形成
 電子-模型圖
電子-模型圖 研究認為,在分子或晶體中的原子決不是簡單地堆砌在一起,而是存在著強烈的相互作用。化學上把這種分子或晶體中原子間(有時原子得失電子轉變成離子)的強烈作用力叫做化學鍵。鍵的實質是一種力。所以有的又叫鍵力,或就叫鍵。
離子鍵的形成
以鈉與氯化合生成氯化鈉為例:
從原子結構看,鈉原子最外電子層上有1個電子,容易失去;氯原子在外電子層有7個電子容易得到一個電子。當鈉原子與氯原子相遇時,鈉原子失去最外層的一個電子,成為鈉離子,帶正電,氯原子得到鈉失去的電子,成為帶負電的氯離子,陰陽離子的異性電荷的吸引作用,與原子核之間、電子之間的排斥作用達到平衡,形成了穩定的離子鍵。
成鍵微粒
陰離子和陽離子
鍵的本質
陰離子和陽離子之間的靜電作用
影響因素
陰陽離子的半徑的大小;陰陽離子電荷的多少
電子式
在元素符號周圍用“·”或“×”來表示原子最外層電子的式子
性質
離子鍵的作用力強,無飽和性,無方向性。
離子鍵存在於離子化合物中,離子化合物在室溫下是以晶體形式存在。
離子鍵較氫鍵強,其強度與共價鍵接近。
陰陽離子是否中和
也許有人會問,陰陽離子結合在一起,彼此電荷是否中和呢?鈉離子和氯離子之間除了有靜電相互吸引作用外,還有電子與電子,原子核與原子核之間的相互排斥作用。當兩種離子接近到某一定距離時,吸引與排斥達到了平衡,於是陰陽離子之間就形成了穩定的化學鍵。所以,所謂陰陽離子電荷相互中和的現象是不會發生的。
晶格能
離子鍵的鍵能比較大,反映在離子化合物中就是高熔沸點,離子鍵的鍵能被稱作晶格能,晶格能的符號與離子晶體解離過程焓變的符號保持一致。晶格能可以通過玻恩-哈勃循環(Bōrn-Habercycle)或玻恩-蘭德公式(Bōrn-Landé)計算得出,也可以通過實驗測量測量。

