基本定義
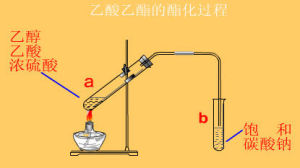
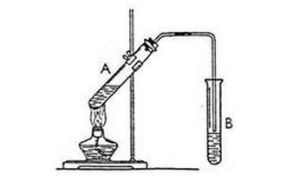 酯化反應裝置
酯化反應裝置分兩種情況:羧酸跟醇反應和無機含氧酸跟醇反應。羧酸跟醇的反應過程一般是:羧酸分子中的羥基與醇分子中羥基的氫原子結合成水,其餘部分互相結合成酯。這是曾用示蹤原子證實過的。如羧酸跟醇的酯化反應是可逆的,並且一般反應極緩慢,故常用濃硫酸作催化劑。多元羧酸跟醇反應,則可生成多種酯。如乙二酸跟甲醇可生乙二酸氫甲酯或乙二酸二甲酯。
HOOC—COOH+CH3OHHOOC—COOCH3+H2O
無機強酸跟醇的反應,其速度一般較快,如濃硫酸跟乙醇在常溫下即能反應生成硫酸氫乙酯。
C2H5OH+HOSO2OH→C2H5OSO2OH+H2O
硫酸氫乙酯
C2H5OH+C2H5OSO2OH→(C2H5O)2SO2+H2O
硫酸二乙酯
多元醇跟無機含氧強酸反應,也生成酯。
一般來說,除了酸和醇直接酯化外能發生酯化反應的物質還有以下三類:
醯鹵和醇、酚、醇鈉發生酯化反應;
酸酐和醇、酚、醇鈉發生酯化反應;
烯酮和醇、酚、醇鈉發生酯化反應。
反應特點
屬於可逆反應,一般情況下反應進行不徹底,依照反應平衡原理,要提高酯的產量,需要用從產物分離出一種成分或使反應物其中一種成分過量的方法使反應正方向進行。
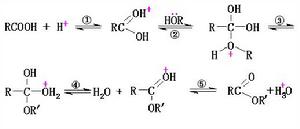
反應機理
在酯化反應中,存在著一系列可逆的平衡反應步驟。步驟②是酯化反應的控制步驟,而步驟④是酯水解的控制步驟。這一反應是SN2反應,經過加成-消除過程。
原理反應式採用同位素標記醇的辦法證實了酯化反應中所生成的水是來自於羧酸的羥基和醇的氫。但羧酸與叔醇的酯化則是醇發生了烷氧鍵斷裂,中間有碳正離子生成。
在酯化反應中,醇作為親核試劑對羧基的羰基進行親核攻擊,在質子酸存在時,羰基碳更為缺電子而有利於醇與它發生親核加成。如果沒有酸的存在,酸與醇的酯化反應很難進行。
典型反應
乙醇和醋酸進行酯化生成具有芳香氣味的乙酸乙酯,是製造染料和醫藥的原料。在某些菜餚烹調過程中,如果同時加醋和酒,也會進行部分酯化反應,生成芳香酯,使菜餚的味道更鮮美。如果要使反應達到工業要求,需要以硫酸作為催化劑,硫酸同時吸收反應過程生成的水,以使酯化反應更徹底。反應方程式如下:
乙酸的酯化反應制乙酸乙酯的方程式:CH3COOH+CH3CH2OH≈(△,濃硫酸)≈CH3COOC2H5+H2O (可逆反應、加熱、濃硫酸催化劑)
 原理反應式
原理反應式甲醇和對苯二甲酸進行酯化反應,會生成對苯二甲酸二甲酯,而對苯二甲酸二甲酯與乙二醇發生酯交換反應,可以生成聚對苯二甲酸乙二酯,即滌綸。
醇類和無機酸也能進行酯化反應,例如甲醇和硫酸反應生成硫酸二甲酯,是一種甲基化試劑,可以為碳水化合物引入甲基。
反應類型
酯化反應一般是可逆反應。傳統的酯化技術是用酸和醇在酸(常為濃硫酸)催化下加熱回流反應。這個反應也稱作費歇爾酯化反應。濃硫酸的作用是催化劑和失水劑,它可以將羧酸的羰基質子化,增強羰基碳的親電性,使反應速率加快;也可以除去反應的副產物水,提高酯的產率。
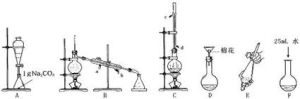 酯化反應
酯化反應如果原料為低級的羧酸和醇,可溶於水,反應後可以向反應液加入水(必要時加入飽和碳酸鈉溶液),並將反應液置於分液漏斗中作分液處理,收集難溶於水的上層酯層,從而純化反應生成的酯。碳酸鈉的作用是與羧酸反應生成羧酸鹽,增大羧酸的溶解度,並減少酯的溶解度。如果產物酯的沸點較低,也可以在反應中不斷將酯蒸出,使反應平衡右移,並冷凝收集揮發的酯。
但也有少數酯化反應中,酸或醇的羥基質子化,水離去,生成醯基正離子或碳正離子中間體,該中間體再與醇或酸反應生成酯。這些反應不遵循“酸出羥基醇出氫”的規則。
羧酸經過醯氯再與醇反應生成酯。醯氯的反應性比羧酸更強,因此這種方法是製取酯的常用方法,產率一般比直接酯化要高。對於反應性較弱的醯鹵和醇,可加入少量的鹼,如氫氧化鈉或吡啶。 H3C-COCl + HO-CH2-CH3 → H3C-COO-CH2-CH3 + H-Cl 羧酸經過酸酐再與醇反應生成酯。 羧酸經過羧酸鹽再與鹵代烴反應生成酯。反應機理是羧酸根負離子對鹵代烴α-碳的親核取代反應。
Steglich酯化反應
羧酸與醇在DCC和少量DMAP的存在下酯化。這種方法尤其適用於三級醇的酯化反應。DCC是反應中的失水劑,DMAP則是常用的酯化反應催化劑。
山口酯化反應
2,4,6-三氯苯甲醯氯與羧酸底物作用生成混酐使羧酸活化,繼而與醇順利作用成酯。DMAP為酯化的催化劑。