 海洋物理化學
海洋物理化學海洋物理化學是海洋化學的理論核心。它套用物理化學的理論、觀點和方法,來研究海洋中的化學問題和地球化學過程,包括海水、懸浮粒子和沉積物、微表層海水和沉積物間隙水等海洋體系的組成、物理化學性質和結構、海洋及其環境(大氣、洋底、河口、洋底火山等)所組成的體系中發生的一切物理化學過程。
研究簡史
 海洋
海洋1959年在紐約召開的國際海洋會議上,L.G.西倫作了題為“海水物理化學”的演講。以後,“海水物理化學”這一名稱便被廣泛採用。海洋物理化學的發展初期,研究對象主要是海水、嗣後研究範圍逐漸推廣到海底沉積物和海洋的其他界面上,就發展成了海洋物理化學。
海洋物理化學的先驅性工作在20世紀初已有報導。1901~1908年,M.H.C.克努曾和V.W.埃克曼建立了經典的海水狀態方程式,它是聯繫海水的密度、溫度、鹽度和壓力等的一種數學表達式。二氧化碳-碳酸鹽體系,是海洋中控制海水的pH值、決定海洋沉積物的沉積過程等的複雜的平衡體系,雖已研究了幾十年,但直到20世紀50年代末才初具雛型。60年代初,西倫、R.M.加勒爾斯等人把化學平衡理論等物理化學原理,嚴格、系統和定量地套用到海洋中,研究海水中元素的存在形式,建立海水化學模型,為海洋物理化學的建立和發展奠定了基礎。在這以後的一段時間內,海水化學模型(包括微量元素的溶存形式)的研究,成了海洋化學中眾所矚目的一個研究內容。
自60年代以來,人們又把電化學、化學動力學、膠體和表面化學、量子和統計化學的理論和實驗方法套用到海洋中,不僅研究了海洋水體,而且涉及海洋懸浮體、海水微表層、海洋沉積物等,使海洋物理化學具有如下一些特點:①所研究的海水體系是地球上極其複雜的化學平衡體系之一。②所研究的化學過程,許多是陸地上少見的低濃底(1ppm以下)化學過程。③視海水為多組分電介質溶液,其活度係數理論已有較深入的研究。④海水是具有膠體化學特性的水溶液,其中存在著一定量的固體懸浮粒子,海水中“微量元素-有機物質-固體粒子”的相互作用及其液-固分配理論的研究,是現時海洋化學研究的新動向之一。⑤在海洋中進行的化學反應,壓力範圍很寬,可自 1個大氣壓至1000大氣壓左右,因此必須考慮化學過程的壓力效應。
研究內容
 地球化學循環
地球化學循環海洋物理化學的基本內容包括:海水活度係數,海水化學模型,海水中微量元素在固體粒子上液-固分配的理論,壓力和溫度對海洋中化學平衡的影響,海水的pE和pH圖,海洋中化學過程的動力學研究,海洋中元素的逗留時間和海洋化學微觀研究等。
海水各組分之間存在著錯綜複雜的相互關係,如果把海水劃成“海鹽”和水兩種組分,則主要考慮下述3種關係:①水分子之間的相互作用,即液態水的結構問題。液態水理論眾說紛紜,例如扭變氫鍵模型(連續體理論),它假設冰變水時,氫鍵變得更加易被彎曲、扭轉和變型,但尚未拆開,氫鍵扭變可用經典統計方法處理;籠合體模型,它假設液態水成為一種自籠合體,即是許多由帶氫鍵分子形式的五邊形十二面體籠子組成的網路,籠子空腔中包藏著水分子,但它們不與籠結構鍵合;閃動簇團模型,它將液態水視為氫鍵結合的水分子的“閃動簇團”在略為“自由”的水中游泳的混合體,這一模型與分配函式聯繫起來,可用統計力學方法計算熱力學性質,經再三改進後,計算得出的自由能、內能、熵和熱容之值,與實測值基本一致。後面兩種理論均屬混合型模型理論。②海水中“海鹽”離子與水的相互作用,即離子水化作用。其結果將對離子的電導和溫度係數、熱力學性質和動力學性質、海水中元素的存在形式及其穩定性等都有不同程度影響。③海水中“海鹽”離子之間的相互作用。可用海水活度係數和海水滲透係數加以表達。這三種關係中,最重要的特徵量是活度係數。
海水活度係數 與一般的水溶液或天然水(河、湖、泉、雨之水)相比,海水的一個重要特徵是含有眾多的鹽類。例如,大洋水的鹽度約為S=35,結果使海水與鹽度極低的無限稀溶液之間的物理-化學性質有很大的差異。為了表達兩者的這種差異程度,在海洋物理化學中使用了海水活度係數(主要用於溶質)和海水滲透係數(主要用於溶劑)。
計算海水組分平均活度係數和單獨離子活度係數的理論模型和公式很多,有離子締合理論、特殊相互作用模型、斯卡特查爾德公式、水化模型、靜電模型(包括戴維斯公式)、簇積分展開理論、皮策公式等。雖然使用離子選擇電極可求得單獨離子的活度係數,但其精確值的測定和理論計算,特別是對海水這樣的高鹽度體系,尚未徹底解決。在實際工作中,可用特殊相互作用公式,如斯卡特查爾德公式和皮策公式等計算海水的活度係數。總結起來,上述各計算公式可用下述公式概括之: 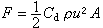 式中德拜-休克爾項是指德拜-休克爾理論的極限定律計算所得之值。在上述諸理論中,以簇積分展開理論和皮策公式最優,計算結果與實測值之差在實驗誤差範圍之內。皮策公式不僅可計算海水中常量組分離子的活度係數,而且在皮策公式問世後不久即被海洋化學家套用于海水中微量組分離子活度係數的計算,結果與用特殊相互作用模型計算的更加一致。1982年,此式已成功地套用於死海水(離子強度(±)埄10)中主要離子的活度係數的計算上。皮策公式的提出,使得具體計算活度係數的工作大體上得到解決。
式中德拜-休克爾項是指德拜-休克爾理論的極限定律計算所得之值。在上述諸理論中,以簇積分展開理論和皮策公式最優,計算結果與實測值之差在實驗誤差範圍之內。皮策公式不僅可計算海水中常量組分離子的活度係數,而且在皮策公式問世後不久即被海洋化學家套用于海水中微量組分離子活度係數的計算,結果與用特殊相互作用模型計算的更加一致。1982年,此式已成功地套用於死海水(離子強度(±)埄10)中主要離子的活度係數的計算上。皮策公式的提出,使得具體計算活度係數的工作大體上得到解決。
海水化學模型
研究海水中元素的存在形式。元素的存在形式是元素海洋地球化學的一個研究內容,又是影響海水中元素遷移變化規律的一個重要因素,因此海水化學模型是元素海洋地球化學的一個重要組成部分。它對海水分析、海水中微量元素提取機理、海水中微量元素與懸浮粒子相互作用等,均是常常需要考慮的前提。
1962年,加勒爾斯和M.E.湯普森為研究海水中常量元素的溶存形式,提出了離子對模型。後來這種海水化學模型的套用範圍已不限於常量元素,而且推廣到微量元素和有機物質,並提出絡合物模型、HSAB(硬軟酸鹼)模型、活度係數模型和微觀結構參數模型等。這些化學模型大致可分為3類:
① 用活度係數和滲透係數來描述離子之間的相互作用(例如M.惠特菲爾德用皮策公式),由此推斷海水及其組分的若干性質。但這類方法缺乏一般海洋化學工作者所習慣的形象化的結構圖式。
② 離子對模型或絡合物模型。西倫、加勒爾斯和湯普森等首先提出。在已知海水化學組成、絡合物的穩定常數和活度係數的基礎上,套用化學平衡理論進行計算,可得常量元素和微量元素的化學模型。
③ 微觀結構參數模型,是由張正斌、劉蓮生、陳鎮東提出的。由海水中微量元素的化學模型與結構參數 的關係可見屬軟酸和中間酸的元素主要形成M-Cl型絡合物,屬硬酸的元素則主要形成M-OH型絡合物。CA/EA值在0.1左右的元素的溶存形式比較複雜,M-Cl,M-OH,M-CO3,M-SO4等形式絡離子都可能存在。在河口區,元素的溶存形式原則上也可用上述方法計算,但具體運算時需注意到河口水體的成分、pH、氧化-還原條件、離子強度、有機物的成分和含量、懸浮物質的種類和含量等因素的影響。 不同學者提出的海水常量組分的化學模型將近十種,結論大體類似,但對"M-Cl”型離子對是否生成這一點,有兩種相反的見解,多數模型不考慮"M-Cl”型離子對生成,但一些實驗和理論計算認為不僅要考慮"M-Cl”型離子對的生成,而且其生成率(%)可能比"M-SO42-ν”高些。這兩種見解尚未統一。在海水中微量元素的存在形式方面,也存在著不同模型結論不同的情況。例如文獻上一般報導的U(Ⅵ)在海水中的溶存形式為UO2(CO3)嬈3,但中國一些學者經實驗和理論計算證明了主要的存在形式為UO2(OH)婣,UO2(CO3)嬈3為次。此外,目前有機絡合物的重要性日漸重要,例如銅、鋅等的有機存在形式占總分配50%以上,考慮了有機絡合物生成的海水化學模型的研究,已列入研究日程。
的關係可見屬軟酸和中間酸的元素主要形成M-Cl型絡合物,屬硬酸的元素則主要形成M-OH型絡合物。CA/EA值在0.1左右的元素的溶存形式比較複雜,M-Cl,M-OH,M-CO3,M-SO4等形式絡離子都可能存在。在河口區,元素的溶存形式原則上也可用上述方法計算,但具體運算時需注意到河口水體的成分、pH、氧化-還原條件、離子強度、有機物的成分和含量、懸浮物質的種類和含量等因素的影響。 不同學者提出的海水常量組分的化學模型將近十種,結論大體類似,但對"M-Cl”型離子對是否生成這一點,有兩種相反的見解,多數模型不考慮"M-Cl”型離子對生成,但一些實驗和理論計算認為不僅要考慮"M-Cl”型離子對的生成,而且其生成率(%)可能比"M-SO42-ν”高些。這兩種見解尚未統一。在海水中微量元素的存在形式方面,也存在著不同模型結論不同的情況。例如文獻上一般報導的U(Ⅵ)在海水中的溶存形式為UO2(CO3)嬈3,但中國一些學者經實驗和理論計算證明了主要的存在形式為UO2(OH)婣,UO2(CO3)嬈3為次。此外,目前有機絡合物的重要性日漸重要,例如銅、鋅等的有機存在形式占總分配50%以上,考慮了有機絡合物生成的海水化學模型的研究,已列入研究日程。
作用
海洋中化學元素與固體粒子的相互作用
 海水含有大量固體粒子
海水含有大量固體粒子海水含有大量固體粒子,具有膠體化學或表面化學特徵。這些固體粒子上微量元素的液-固分配,遵循著低濃度的界面化學和膠體化學的規律。這方面的研究是探討海洋中元素遷移變化規律的理論基礎,是河口化學的重要內容,也是海洋污染和防污、海水化學資源提取的基礎研究。這方面研究雖然多數針對著微量元素,但常量元素在海水-洋底界面間的離子交換作用,也屬於這種作用範圍,例如碳酸鹽沉積物的鈣-鎂交換
Mg2++2CaCO3匑Ca2++MgCa(CO3)2
又如對海水pH的形成可能有重要作用的K+-H+交換:
3Al2Si2O5(OH)4(固)+2K+匑 2KAl3Si3O10(OH)2(固)+3H2O
海水中元素與固體粒子相互作用的理論主要有3種:①R.O.詹姆斯和T.W.希利等提出的化學吸附理論;②W.施圖姆、P.W.欣德勒、C.W.戴維斯、J.O.萊基等提出的表面絡合理論;③張正斌、劉蓮生提出的表面分級離子(配位子)交換理論。三者各有所長,都尚在發展中。在具體研究中,進行得最早和最多的是離子交換率(或吸著率)和pH的關係。研究得最多的無機離子交換劑是水合氧化物,其次是粘土礦物、氟石等,涉及的微量元素20多種。由離子交換率-pH關係研究得到的圖形呈S型或反S型,可推斷作用過程為陽離子交換還是陰離子交換;由曲線的位置和範圍大小可推斷相互作用的強弱和交換離子的價數。
海水中微量元素在固體粒子上的作用等溫線,常見報導的有:①用相應的弗羅因德利希經驗公式表達,即ε=ɑ(M)b。式中ε為交換量(或吸著量),(M)為溶液中元素的平衡濃度,ɑ和b為係數。石橋雅義等證明海水中微量元素(20個左右)在水合氧化鐵上的作用遵循此式。這是海洋化學中最流行的等溫式。②用相應的朗繆爾公式表達。例如Zn、Pb、Cu、Cd在SiO2和γ-Al2O3上的作用,Co、Zn、Ca、Na在δ-MnO2上的作用等。此式不如弗羅因德利希公式用得普遍。③用兼具弗羅因德利希和朗繆爾兩式特點的公式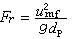 表達(式中N 為最大交換量)。可得與實驗很好相符合的結果。上述三式都只能解釋簡單的等溫線。為了推廣套用到比較複雜的等溫式的場合,上式又改進為 式中為可調參數。④用固體表面分級離子交換理論的公式 表達。式中Ki是i級離子交換產物的生成常數,Kj是生成不溶物的生成常數。這是一種普遍的等溫式。它不僅可表達海洋化學上已有的等溫線,而且可以表達所測得的“台階式”的和“離子交換-沉積式”的新型等溫線。
表達(式中N 為最大交換量)。可得與實驗很好相符合的結果。上述三式都只能解釋簡單的等溫線。為了推廣套用到比較複雜的等溫式的場合,上式又改進為 式中為可調參數。④用固體表面分級離子交換理論的公式 表達。式中Ki是i級離子交換產物的生成常數,Kj是生成不溶物的生成常數。這是一種普遍的等溫式。它不僅可表達海洋化學上已有的等溫線,而且可以表達所測得的“台階式”的和“離子交換-沉積式”的新型等溫線。
海洋固體粒子主要由粘土礦物、金屬氧化物和有機物質三者組成。此三者分別與微量元素的作用均有大量的實驗結果報導,但三者中何種成分對金屬的交換起決定性作用,則各家說法不一。一般認為粘土礦物含量百分比最大,本身對微量元素雖有離子交換作用,但交換量不大,主要起“載體”的作用;水合氧化物含量百分比雖小,但離子交換量較大,一些學者認為它可能是與微量元素作用的主角;有機物一般與微量元素有強的絡合(或螯合)作用。在有機物同時易與固體粒子結合的情況下,則它可能是海水中微量元素與固體粒子作用中的關鍵物質。一些學者提出海水中存在的固體粒子可分別由無機物和有機物所組成,相應地建立了無機物模型和有機物模型,再同上述元素與固體粒子相互作用的理論及元素在海洋中的逗留時間相結合,經定量處理後,可得出海水中有機物起主要作用的結論。然而,有機物所起作用的本質和定量規律,尚待進一步研究。
關於海水中微量元素與固體粒子相互作用的動力學研究,就海水中鈾(Ⅵ)在水合氧化鈦上的提取機理來說,有一種看法為:①可用“擴散-表面吸著和轉形-化學反應-解吸-擴散”的五步機理表達;②在天然海水條件下,過程速率由液膜擴散所控制;實驗測得過程活化能Ea為8.5(千卡/克分子)左右,適與其他文獻報導的擴散活化能接近;③通水過程的pH研究和紅外光譜研究皆說明,機理中“化學反應”一步是陽離子交換或者“絡合縮水”反應,反應級數n=1。
影響
溫度和壓力對海洋中化學平衡的影響
 對海水化學資源的開發
對海水化學資源的開發海洋往往被人們形容為一個恆溫箱,在不同的季節,溫度的垂直變化很少超過30°C,這是生命可能起源於海洋的一個重要條件。但溫度的這種周期性變化,已足使海水的一些物理-化學性質,例如溶解氧等發生顯著的變化。另一方面,海洋作為化學環境的又一特徵,是靜壓力。從表面的1大氣壓到最深洋底的1000大氣壓左右,它影響著海洋中各種化學平衡。溫度和壓力不僅對海水的活度係數、海水中元素的存在形式及其與固體粒子的作用,有不可忽視的影響,而且對海洋中的氧化-還原作用,海水擴散係數、溶度積等,都有一定的影響。溫度和壓力對海水中硫酸根分配的影響,就是一個例子。
溫度和壓力對平衡常數的影響可用下式估算: 由此可見有兩種研究壓力對平衡影響的方法,①偏克分子體積法,由產物和反應物的偏克分子體積計算-Δ堸;②平衡常數法,即直接通過的測量而求得之。
對海水中的主要鹽類和離子,不僅已測得比較精確的實驗值,而且在理論上一些學者分別提出了不同的定量計算方法和公式,得到了與實驗值比較一致的結果。再通過上述公式,即可估計出壓力對所研究體系的影響。
海洋中的氧化—還原作用
海水中元素的化學模型,除了與海水中的無機配位體、有機配位體和海水的pH三因素密切相關外,還被海水體系的氧化 -還原環境所決定,作為體系氧化-還原能力的量度,海洋化學上使用pE,它被定義為:pE=-log{e}。e代表電子,{e}代表活度,即pE為電子活度的負對數。表層海水pE的理論最高值為12.5±0.2,這是假設體系達到氧化-還原平衡的理論值。實際海水情況決非如此簡單,各家見解不一,尚待探討。
pH和pE都對海水中元素的溶存形式有顯著影響,故用海洋中元素的pE-pH圖,可以研究元素的存在形式(圖3),由此可判斷在具體研究的海水條件下,元素處於氧化-還原狀態。海水中氧化-還原態變化的元素主要有H、O、C、N、Fe、Mn、S、Cr、I等,它們在各種狀態(含氧、缺氧等狀態)的海水中存在的形式,對海洋生物和海洋地質等有重要的參考價值。
海水中金屬和合金的電化學位是研究海洋環境中金屬腐蝕和保護的一個最基本的物理-化學量(見海水中金屬的腐蝕),其中純金屬的電化學位有明顯的規律性。例如可把它們分成 3類:①Zr、Ta、Nb、Ti、Pt、Pd、Mo、V、W;②Au、Ag、Cu、Fe、Cd、Zn、Mg;③Ni、Bi、In、Pb、Sn、Al。通過設計兩套哈伯-玻恩循環可以證明:這與它們在海水中生成的絡合物MLn中n=0,1,2的情況是一一對應的(其中L為Cl-、OH-、SO娺-、CO卲-等)。
海洋中化學過程的動力學研究
這方面的研究是比較複雜的。例如:存在於海水中的多種配位體和絡合物,對金屬在海洋中的腐蝕反應及磷酸鹽、矽酸鹽、碳酸鹽等的沉澱溶解反應的過程和速率,都有明顯的影響。此外,海水中固體的成核作用,晶體的生長,物質的水化和脫水作用,無機物和有機物的氧化-還原作用,吸著和解吸作用等化學反應的速率,也往往在一定條件下對某些化學過程有關鍵性的影響。還有一些化學過程,例如某一無機物、有機物或核素的反應過程,同時受到大洋表層流、深層環流、大洋湍流,或者近岸海域和河口海灣的潮流、密度流和港灣環流等的顯著影響。因此,成功地研究現場海洋中化學過程動力學的範例很少。然而海洋中一些重要體系,例如碳酸鹽體系中的一些重要反應的速率和機理,已有比較深入的研究。包括:①CO2在海水中溶解和垂直遷移。其中起控制速率作用的是 CO2穿過界面和 CO2的水化和脫水反應 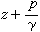 其中第一步的速率很小,故成為控制整個過程的速率的關鍵,其他均相化學反應則均較快,關鍵反應的反應級數和反應速率常數已經測定。②碳酸鈣的沉澱和溶解。對 CaCO3而言世界大洋上層大部分是飽和或過飽和的,而下層往往是不飽和的。海水恰好飽和的深度叫飽和深度。在飽和深度以下2000米或更深處,沉積物中CaCO3的豐度銳減。此外的深度稱為補償深度,它受動力學因素所決定。
其中第一步的速率很小,故成為控制整個過程的速率的關鍵,其他均相化學反應則均較快,關鍵反應的反應級數和反應速率常數已經測定。②碳酸鈣的沉澱和溶解。對 CaCO3而言世界大洋上層大部分是飽和或過飽和的,而下層往往是不飽和的。海水恰好飽和的深度叫飽和深度。在飽和深度以下2000米或更深處,沉積物中CaCO3的豐度銳減。此外的深度稱為補償深度,它受動力學因素所決定。
海水中元素的逗留時間
海水中某一元素的現有總量A,除以單位時間內河水補充的量ΔQ或沉澱為沉積物的量ΔQ′,其商稱為該元素在海水中的逗留時間τ ,即 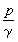 這一定義基於如下的簡化假設:①就化學組成而言,世界海洋可視為一穩恆體系,故單位時間內輸入的物質的量,相當於析出沉積物的量。②進入海洋中的元素達到和海水完全混合的時間與逗留時間相比是短暫的。1952年,T.F.W.巴爾特利用河水流量,E.D.戈德堡和G.O.S.阿倫尼烏斯等曾分別於1958年和1975年利用向海底沉澱的沉積物量,研究和計算了逗留時間。這兩種方法的結果大體一致。 利用每種元素在海洋中逗留的平均時間τ ,可研究該種元素在海洋中的相對活潑性和它們的環境性質,進而解釋海洋中發生的重要無機反應。τ 也是研究海底礦物(例如太平洋底錳結核等錳鐵礦物等等)的形成和組成的一個重要的海洋物理化學參數。元素海洋地球化學的重要內容之一,是研究海水中元素含量與河水中元素含量的比值(濃縮比
這一定義基於如下的簡化假設:①就化學組成而言,世界海洋可視為一穩恆體系,故單位時間內輸入的物質的量,相當於析出沉積物的量。②進入海洋中的元素達到和海水完全混合的時間與逗留時間相比是短暫的。1952年,T.F.W.巴爾特利用河水流量,E.D.戈德堡和G.O.S.阿倫尼烏斯等曾分別於1958年和1975年利用向海底沉澱的沉積物量,研究和計算了逗留時間。這兩種方法的結果大體一致。 利用每種元素在海洋中逗留的平均時間τ ,可研究該種元素在海洋中的相對活潑性和它們的環境性質,進而解釋海洋中發生的重要無機反應。τ 也是研究海底礦物(例如太平洋底錳結核等錳鐵礦物等等)的形成和組成的一個重要的海洋物理化學參數。元素海洋地球化學的重要內容之一,是研究海水中元素含量與河水中元素含量的比值(濃縮比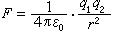 ) 和洋底沉積物中元素含量與海水中元素含量之比值(被清除率
) 和洋底沉積物中元素含量與海水中元素含量之比值(被清除率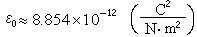 )。它們與τ的關係可通過圖5表達,並可導出下述關係式: τ=K
)。它們與τ的關係可通過圖5表達,並可導出下述關係式: τ=K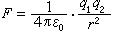
τ=K′/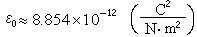
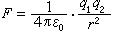 成正比;τ與該元素的
成正比;τ與該元素的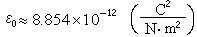 成反比,其中元素比例常數K或K′與水化能等海洋化學參數有關。用上述公式計算的τ 值,與巴爾特、戈德堡和阿倫尼烏斯的τ 值一致。
成反比,其中元素比例常數K或K′與水化能等海洋化學參數有關。用上述公式計算的τ 值,與巴爾特、戈德堡和阿倫尼烏斯的τ 值一致。 微觀研究
用組成海洋物質的原子與分子的結構觀點,用量子化學的理論與方法,運用物質的某些結構參數,或通過大量實驗結果和自然現象的歸納,或通過理論上的演繹,從定性和定量兩方面來研究海洋化學的問題。
海洋化學的微觀研究,大體上可分成兩類:①定性研究。例如通過
“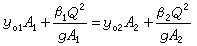 圖”
圖”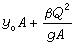 ,
,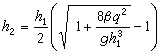 對海洋化學現象或海水物理-化學性質進行分類。又如通過“某一物理化學性質
對海洋化學現象或海水物理-化學性質進行分類。又如通過“某一物理化學性質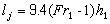 或圖”,對φ 的規律性進行研究。②定量研究。即通過諸如 定量計算φ值。例如:海水中各種元素在水合氧化鐵上的無機離子交換作用、氯化鉀在各種無機離子交換劑上的作用、海水和河水中元素含量的濃縮比效應、海水中元素的清除作用、海水中主要鹽類和離子的偏克分子體積、海水中純金屬的電化學位、離子的水化能、氫氧化物的溶解度、海水中元素的逗留時間、海水中的直線自由能關係、酸鹼硬軟度的定量標度、海水化學模型的微觀定量計算等,張正斌、劉蓮生等提出均可用上述形式的公式計算出相應的φ 值。
或圖”,對φ 的規律性進行研究。②定量研究。即通過諸如 定量計算φ值。例如:海水中各種元素在水合氧化鐵上的無機離子交換作用、氯化鉀在各種無機離子交換劑上的作用、海水和河水中元素含量的濃縮比效應、海水中元素的清除作用、海水中主要鹽類和離子的偏克分子體積、海水中純金屬的電化學位、離子的水化能、氫氧化物的溶解度、海水中元素的逗留時間、海水中的直線自由能關係、酸鹼硬軟度的定量標度、海水化學模型的微觀定量計算等,張正斌、劉蓮生等提出均可用上述形式的公式計算出相應的φ 值。
發展
海洋化學正處於由定性描述向定量推理,由巨觀向微觀,由可逆平衡態熱力學方法向不可逆、非平衡態、統計化學方法的方向發展的變革之中,它已經初步建立了自己的理論體系和實驗方法,成為海洋科學中的一門嚴格而系統的分支學科。20多年來海洋物理化學的發展,對海水化學資源開發,海洋污染和防污染,海水腐蝕和防腐蝕等實驗性較強的分支的發展,也起到積極的推動作用。
