海水二氧化碳系統
正文
包括溶解在海水中的二氧化碳、碳酸、碳酸氫根離子和碳酸根離子的平衡物系。這些成分之間的化學反應和平衡關係,二氧化碳在大氣和海洋之間的交換,懸浮顆粒中的碳酸鹽與海水二氧化碳系統之間的化學平衡,海洋生物的生長繁殖與二氧化碳的循環,海水中二氧化碳含量的分布及其變化,都是這方面的主要研究內容。海水二氧化碳系統的研究工作,雖然在18世紀就已經開始,但直到1915年,K.布赫才首次研究海水二氧化碳系統中各種成分之間的平衡理論。20世紀30年代初,根據國際海洋考察理事會(ICES)的建議,由K.布赫、H.W.哈維、H.瓦滕貝格和S.格里彭貝格組成的專業小組,測定了不同溫度和不同鹽度下碳酸的第一級和第二級表觀解離常數。50年代以後,各國學者分別測定此解離常數。由於測定的方法和所依據的標準不同,所得的結果就不一致。為此,J.M.吉斯克於1978年在“海洋表和標準”聯合專家小組(JPOTS)的會議上,建議對測定標準和有關常數進行統一。
總二氧化碳 二氧化碳在海水中有如下的化學反應和平衡關係:
CO2(溶解態)+H2O匑H2CO3
H2CO3匑H+HCO婣
HCO婣匑H++CO2-3
在溶解態的二氧化碳與碳酸的平衡中,後者的量與前者相比甚小。通常把這兩者的濃度之和表示為【CO2】T,【CO2】T=【CO2】+【H2CO3】
以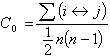 表示海水中二氧化碳系統各成分的總濃度,稱為總二氧化碳。
表示海水中二氧化碳系統各成分的總濃度,稱為總二氧化碳。 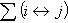
考慮碳酸在海水中的一級解離和二級解離時,通常以氫離子的活度αH+代替濃度【H+】,二氧化碳各分量用濃度,並稱所得解離常數為表觀解離常數K′。因此,碳酸的一級和二級表觀解離常數為
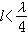
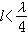
它們是海水的溫度、鹽度和壓力的函式。
海水中二氧化碳的含量,與海洋生物的分布、大陸徑流、 海-氣交換、固體懸浮物質和海洋沉積物等有密切的關係,因而有明顯的區域分布和垂直分布。
二氧化碳的海-氣交換 海洋表層水和大氣之間的二氧化碳交換,處於動態平衡。
CO2(大氣)匑CO2
由於工業和交通的發展,燃料燃燒後排放到大氣中的二氧化碳不斷增加。例如夏威夷的冒納羅亞觀測站的觀測結果說明:空氣中二氧化碳平均含量,每年大約以0.68ppm的速度增長。當表層海水中二氧化碳的分壓大於大氣中二氧化碳的分壓時,海水向大氣放出二氧化碳,反之亦然。
通常高緯度海域的海水吸收大氣的二氧化碳,低緯度海域相反。總的結果是海洋吸收大氣的二氧化碳。
二氧化碳的海-氣交換主要在海洋表層進行,其速率除與風力、海洋環流和垂直對流等物理過程有關外,與溫度、二氧化碳的分壓等化學過程和生物過程,都有密切的關係。
碳酸鈣的沉澱和溶解與二氧化碳系統的關係 海水中的鈣離子和碳酸根離子,可以形成碳酸鈣沉澱;反之,固體碳酸鈣也可以溶解並解離成鈣離子和碳酸根離子:
Ca2++CO卲匑CO3↓
碳酸鈣的表觀溶度積K▂p為海水呈飽和狀態時其中Ca2+和CO卲的濃度的乘積:K▂p=【Ca2+】【CO卲】
K▂p 隨溫度的升高而降低,隨鹽度和壓力的增加而變大。若海水中的鈣離子濃度與碳酸根離子濃度的乘積小於碳酸鈣的溶度積,則稱此海水呈不飽和狀態,其飽和度為 它代表飽和的程度。在不飽和狀態下,固體中的碳酸鈣將逐漸溶入海水中,使海水的二氧化碳總量增加。當飽和度超過1時,說明此海水處於過飽和狀態,通常有碳酸鈣逐漸從海水中析出,使海水二氧化碳的總量減少。對碳酸鈣而言,所有大洋的表層水都處於飽和或過飽和狀態,其原因是碳酸鈣的沉澱速度除與飽和度有關外,還與海水中的有機物,磷化合物和鎂離子等的存在有關,而深層水則處於不飽和狀態,因此在表層之下,存在著飽和度等於 1的深度,稱為飽和深度。碳酸鈣有兩種晶體:①文石,或稱霰石;②方解石,它們的溶度積不同,故有不同的飽和深度。例如北大西洋,文石和方解石的飽和深度分別為3200米和4600米;又如在北太平洋,它們分別為600米和800米。
海洋生物對海水二氧化碳含量的影響 在真光層內,海洋植物進行光合作用時吸收二氧化碳、合成有機物;有的動物和植物,還利用海水中的二氧化碳和鈣,生成軀體的碳酸鈣質的組織。因此,在真光層海水中,二氧化碳的含量較低。另一方面,這些含有機碳和碳酸鈣的生物殘骸下沉至中層和深層之後,一部分有機碳被氧化,分解出的二氧化碳溶入海水中,使pH降低,有利於碳酸鈣的溶解;由於深層海水的溫度低,壓力大,使碳酸鈣的溶解度增大。因此碳酸鈣的飽和度小於 1,即處於不飽和狀態,生物殘骸中的一部分碳酸鈣就逐漸溶解于海水之中。然而上升流又把這部分二氧化碳帶到上層,形成了二氧化碳在海洋中的循環。
總二氧化碳的分布 海水總二氧化碳的含量,除了上述原因形成的垂直分布之外,還因海流的搬運作用和大陸徑流的影響,而有區域性的分布。大陸徑流不斷向海洋輸送含有機碳和碳酸鈣等物質,使河口和近海海水的總二氧化碳的氯度比值(見海水主要溶解成分)常常比大洋高。
二氧化碳系統與海水的酸鹼性 從碳酸的兩級解離來看,海水二氧化碳系統各種成分的含量之間的比例,和氫離子的濃度有密切的關係,即與海水的pH有很大的關係。海水的pH一般為8.1,其變化範圍為7.8~8.4,即略帶鹼性。在這種pH條件下,海水中的二氧化碳主要以碳酸氫根的形態存在,約占90%;其次是碳酸根;溶解態二氧化碳的含量很低(圖1)。 研究海水二氧化碳系統時,常引用總鹼度 ALK。其定義為:“每千克(或每升)海水中所含的弱酸根離子,全部轉化成游離酸所需的氫離子的毫克當量數(或微克當量數,以μeq表示)。”通常可表示為:
Alk=【HCO婣】+2【CO卲-】+【H2BO婣】
實際上,海水中除這三種弱酸根離子之外,通常還含有HPO娺-等弱酸根離子,後者的含量很低,在海水的總鹼度中可不計算在內。不過在特殊情況下,例如在缺氧海水中,硫化物、氨和磷酸鹽也必須考慮在內。就西太平洋海水總鹼度的斷面分布(圖2)而言,表層較低,深層較高,其分布與水團的運動有關。 利用總鹼度在海洋中的分布研究海水二氧化碳系統時,有時也應考慮總鹼度對於含鹽量的相對量。所以引用總鹼度的氯度比值Alk/Cl,稱其為比鹼度。在總鹼度中,直接與海水二氧化碳有關的是碳酸鹼度:
CA=【HCO婣】+2【CO卲-】=Alk-【H2BO婣】
根據海水的碳酸鹼度和其他一些參數(pH、溫度、鹽度和壓力等),可以計算出海水二氧化碳系統各成分的含量。參考書目
J.P.Riley,G.Skirrow,eds,ChemicalOceanography,2nded.,Vol.1,2,Academic Press, London,1975.

