概述
 聚合酶鏈式反應
聚合酶鏈式反應聚合酶鏈式反應(PCR)擴增樣品中的DNA量和富集眾多DNA分子中的一個特定的DNA序列的一種技術。在該反應中,使用與目的DNA序列互補的寡核苷酸作為引物,進行多輪的DNA合成。其中包括DNA變性,引物退火和在TapDNA聚合酶催化下的DNA合成。
作用
聚合酶鏈式反應是體外酶促合成、擴增DNA片段的一種方法,該方法可以使目標DNA在幾個小時內擴增千百萬倍,由於它的擴增能力強大,並且可與其他分子生物學方法相結合廣泛套用於生命科學各個領域,已經成為近十幾年來發展和普及最迅速的分子生物學新技術之一,其發明者KaryMullis和Saiki分別獲得了1994和1992年諾貝爾獎。聚合酶鏈式反應(PolymeraseChainReaction,PCR)是體外酶促合成特異DNA片段的一種方法,為最常用的分子生物學技術之一。典型的PCR由(1)高溫變性模板;(2)引物與模板退火;(3)引物沿模板延伸三步反應組成一個循環,通過多次循環反應,使目的DNA得以迅速擴增。其主要步驟是:將待擴增的模板DNA置高溫下(通常為93℃-94℃)使其變性解成單鏈;人工合成的兩個寡核苷酸引物在其合適的復性溫度下分別與目的基因兩側的兩條單鏈互補結合,兩個引物在模板上結合的位置決定了擴增片段的長短;耐熱的DNA聚合酶(Taq酶)在72℃將單核苷酸從引物的3’端開始摻入,以目的基因為模板從5’→3’方向延伸,合成DNA的新互補鏈。
PCR能快速特異擴增任何已知目的基因或DNA片段,並能輕易在皮克(pg)水平起始DNA混合物中的目的基因擴增達到納克、微克、毫克級的特異性DNA片段。因此,PCR技術一經問世就被迅速而廣泛地用於分子生物學的各個領域。它不僅可以用於基因的分離、克隆和核苷酸序列分析,還可以用於突變體和重組體的構建,基因表達調控的研究,基因多態性的分析,遺傳病和傳染病的診斷,腫瘤機制的探索,法醫鑑定等諸多方面。通常,PCR在分子克隆和DNA分析中有著以下多種用途:
 聚合酶鏈式反應
聚合酶鏈式反應(2)由少量mRNA生成cDNA文庫;
(3)從cDNA中克隆某些基因;
(4)生成大量DNA以進行序列測定;
(5)突變的分析;
(6)染色體步移;
(7)RAPD、AFLP、RFLP等DNA多態性分析等。
歷史
DNA聚合酶(DNApolymeraseI)最早於1955年發現,而較具有實驗價值及實用性的KlenowfragmentofE.Coli則是於70年代的初期由Dr.H.Klenow所發現,但由於此酶不耐高溫,高溫能使之變性,因此不符合使用高溫變性的聚合酶鏈式反應。現今所使用的酶(簡稱Taqpolymerase),則是於1976年從溫泉中的細菌(Thermusaquaticus)分離出來的。它的特性就在於能耐高溫,是一個很理想的酶,但它被廣泛運用則於80年代之後。PCR最初的原始雛形概念是類似基因修復複製,它是於1971年由Dr.KjellKleppe提出。他發表了第一個單純且短暫性基因複製(類似PCR前兩個周期反應)的實驗。而現今所發展出來的PCR則於1983由Dr.KaryB.Mullis發展出的,Dr.Mullis當年服務於PE公司,因此PE公司在PCR界有著特殊的地位。Dr.Mullis並於1985年與Saiki等人正式表了第一篇相關的論文。此後,PCR的運用一日千里,相關的論文發表質量可以說是令眾多其它研究方法難望其項背。隨後PCR技術在生物科研和臨床套用中得以廣泛套用,成為分子生物學研究的最重要技術。Mullis也因此獲得了1993年諾貝爾化學獎。實驗操作
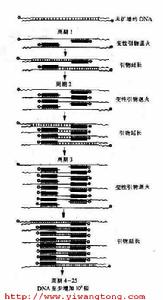 聚合酶鏈式反應
聚合酶鏈式反應2、加如10μl3M乙酸鈉(pH5.2)和250μl無水乙醇,顛倒混勻
3、12,000rpm高速離心15分鐘,觀察沉澱,棄去上清液
4、加入1ml75%乙醇,顛倒混勻,洗滌沉澱。
5、12,000rpm高速離心2分鐘,徹底棄去上清液
6、室溫或37℃,晾乾
7、加10μlTE(pH8.0)溶液溶解
合成原理
DNA的半保留複製是生物進化和傳代的重要途徑。雙鏈DNA在多種酶的作用下可以變性解鏈成單鏈,在DNA聚合酶與啟動子的參與下,根據鹼基互補配對原則複製成同樣的兩分子挎貝。在實驗中發現,DNA在高溫時也可以發生變性解鏈,當溫度降低後又可以復性成為雙鏈。因此,通過溫度變化控制DNA的變性和復性,並設計引物做啟動子,加入DNA聚合酶、dNTP就可以完成特定基因的體外複製。但是,DNA聚合酶在高溫時會失活,因此,每次循環都得加入新的DNA聚合酶,不僅操作煩瑣,而且價格昂貴,制約了PCR技術的套用和發展。
發現耐熱DNA聚契約酶--Taq酶對於PCR的套用有里程碑的意義,該酶可以耐受90℃以上的高溫而不失活,不需要每個循環加酶,使PCR技術變得非常簡捷、同時也大大降低了成本,PCR技術得以大量套用,並逐步套用於臨床。
反應過程
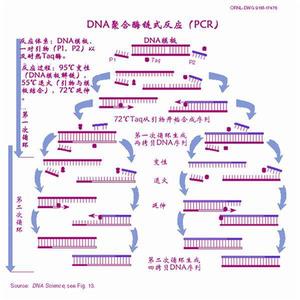 聚合酶鏈式反應
聚合酶鏈式反應2、退火(25℃-65℃):系統溫度降低,引物與DNA模板結合,形成局部雙鏈。
3、延伸(70℃-75℃):在Taq酶(在72℃左右最佳的活性)的作用下,以dNTP為原料,從引物的5′端→3′端延伸,合成與模板互補的DNA鏈。每一循環經過變性、退火和延伸,DNA含量既增加一倍。
現在有些PCR因為擴增區很短,即使Taq酶活性不是最佳也能在很短的時間內複製完成,因此可以改為兩步法,即退火和延伸同時在60℃-65℃間進行,以減少一次升降溫過程,提高了反應速度。
PCR反應擴增出了高的拷貝數,下一步檢測就成了關鍵。螢光素(溴乙錠)染色凝膠電泳是最最常用的檢測手段。電泳法檢測特異性是不太高的,因此引物兩聚體等非特異性的雜交體很容易引起誤判。但因為其簡捷易行,成為了主流檢測方法。近年來以螢光探針為代表的檢測方法,有逐漸取代電泳法的趨勢。
反應特點
特異強
PCR反應的特異決定因素為:
①引物與模板DNA特異正確的結合;
②鹼基配對原則;
③TaqDNA聚合酶反應的忠實;
④靶基因的特異與保守。
其中引物與模板的正確結合是關鍵。引物與模板的結合及引物鏈的延伸是遵循鹼基配對原則的。聚合酶反應的忠實及TaqDNA聚合酶耐高溫,使反應中模板與引物的結合(復)可以在較高的溫度下進行,結合的特異大大增加,被擴增的靶基因片段也就能保持很高的正確度。再通過選擇特異和保守高的靶基因區,其特異程度就更高。
靈敏度高
PCR產物的生成量是以指數方式增加的,能將皮克(pg=10-12)量級的起始待測模板擴增到微克(ug=-6)水平。能從100萬個細胞中檢出一個靶細胞;在病毒的檢測中,PCR的靈敏度可達3個RFU(空斑形成單位);在細菌學中最小檢出率為3個細菌。
簡便、快速
PCR反套用耐高溫的TaqDNA聚合酶,一次地將反應液加好後,即在DNA擴增液和水浴鍋上進行變-退火-延伸反應,一般在2~4小時完成擴增反應。擴增產物一般用電泳分析,不一定要用同位素,無放射污染、易推廣。
對標本的純度要求低
不需要分離病毒或細菌及培養細胞,DNA粗製品及RNA均可作為擴增模板。可直接用臨床標本如血液、體腔液、洗嗽液、毛髮、細胞、活組織等DNA擴增檢測。
引物設計
1、長度15~30個核苷酸,最多到50個核苷酸左右。(50?為什麼?反正太長也沒有必要)
2、儘量避免嘌呤和嘧啶堆積的現象。(其實有時很難避免,不是很重要)。
3、引物內部不應該形成二級結構,如果引物中有酶切位點時,就會出現引物二聚體。(一般不是很重要)
PCR的反應條件
 聚合酶鏈式反應
聚合酶鏈式反應2、引物濃度過高會引起錯配和非特異性產物擴增。
3、TaqDNA聚合酶濃度過高會引起錯配和非特異性產物擴增,低則合成產物量減少。
TaqDNA聚合酶無校正功能,摻入錯誤率達2*E-4個核苷酸,一個30個循環的擴增反應0.1%-0.25%總錯誤率。
4、在90~95度下可使整個基因組的DNA變性為單鏈。一般94~95度30~60s。時間過長使TaqDNA聚合酶失活和dNTP破壞增多。
5、DNA很快冷卻到40~60度使引物和模板結合。引物長度在15~25時退火溫度Tm=4(G+c)+(A+T),一般在45~55度,溫度低容易退火但特異性低;溫度高,不容易退火但特異性高。退火時間30秒。
6、延伸溫度一般在70~75度這是TaqDNA聚合酶活性最高(150個/S),當引物在16個鹼基以下時可採用緩慢升高溫度到70~75度的方法,使在低溫下就開始合成。
7、循環次數25~30次。
無產物時
1、取10ul擴增混合液作模板在進行擴增
2、增加TaqDNA聚合酶濃度
3、增加循環次數
4、降低退火溫度
5、加靶DNA量
套用
 聚合酶鏈式反應
聚合酶鏈式反應2、用聚合酶鏈式反應-溫度梯度凝膠電(PCR-TGGE)和DNA測序技術分析16例SAD患者及16名正常人CHRNA7基因全部10個外顯子及其兩側的部分內含子序列和內含子4的部分基因序列。結果在CHRNA7基因上發現2個新的多態性位點;內含子3區的133418G/C突變,兩組相比差異無顯著性(χ2=4.571,P>0.05);內含子7上的117643+GTG三鹼基插入突變,兩組相比差異無顯著性。
3、利用聚合酶鏈式反應技術對86例冠心病及100例正常對照者的白細胞介素-1受體拮抗劑基因進行擴增。結果冠心病患者IL-1ra基因頻率:IL1RN1/10.8256,IL1RNI/20.1628,IL1RN1/30.0116,IL-1ra等位基因頻率:IL1RN*10.9127,IL1RN*20.0814,IL1RN*30.0059,與對照組無差異(P>0.05)。
4、根據不同物種間同一基因核苷酸序列的保守性及相似性的特點,在人和鼠的Pit-1基因第三外顯子上設計上游引物,而將下游引物設計在豬Pit-1基因第四外顯子上.利用聚合酶鏈式反應(PCR)技術,擴增出豬Pit-1基因第三內含子序列,並經由酶切及序列同源性比對確認該序列即為豬Pit-1基因第三內含子序列。 此序列的確定為下一步進行遺傳變異分析的研究奠定了基礎。
儀器
pcr儀器的發展pcr溫度循環至關重要,pcr擴增儀各參數必須準確。自perkpcr儀in–elmercetus公司第一台pcr擴增儀問世以來,現已有幾十家不同的廠家在國內外生產和銷售pcr擴增儀。在短短的幾年間,擴增儀經過幾代的發展,不斷採用新技術,並且進一步朝方便、實用、高智慧型化和自動化的方向發展。
為了便於了解和選購適宜的pcr實驗設備,現將部分國內外pcr擴增儀列表如下;這些儀器主要用變溫鋁塊、變溫水浴及變溫氣流的方式達到熱循環的目的,各有其優缺點。國產1109型dna擴增儀則是用恆溫浴機械手移位式。更接近於手工操作。ptc-51a/b體積小,智慧型化與自動化程式高,可以兼做套式pcr,方便實用。以上各種儀器一般都配有微電腦自動控制溫度、時間及循環數,可以達到節省勞動力的目的。在採用這些儀器作pcr試驗之前,一般均應實測管內溫度變化循環情況,以了解升、降溫時管內因熱傳導造成的溫度滯後情況和實際到達的最高、最低溫度,用於修正設計的循環參數。溫度滯後受到所用eppendorf管材料、壁厚及形狀(與鋁塊孔匹配程度)的影響,這對變溫鋁塊式儀器影響更大些。對於配用制冷機式半導體元件致冷的儀器,在使用低於室溫的溫度來保冷pcr反應後小管時,應注意冷凝水的問題,勿使流入儀器內浸濕半導體元件而損壞儀器。
國內dna擴增儀
:1109型,90a/b型,ptc-51a/b型
1109型
北京新技術所與軍科院聯合
機械臂
變溫水浴
電子調溫
40×0.5ml
16400元/台
90a/b型
中科院遺傳所
機械臂
變溫水浴
電熱
14000元/台
ptc-51a/b型
軍事醫學科學院
變溫氣流
電子調兼作套式
30×0.5ml
12000元/台
國外dna擴增儀
:dnathermalcyclerperkin–elmercetus(美),thermocyclerb..braunbiotech(德),automatictemperaturecy-clersingleblocktwinblockericompinc.(美),grantautogengrantinstrumantltd(美),technephc-1/phc-2techneltd.(英),bioovenbiothrmcorp(美),trio-thermo-blocktb-1biomertra(德),microcyclereeppendorf(美)變溫鋁塊
dnathermalcyclerperkin–elmercetus(美)
變溫鋁塊
壓縮機致冷
48×0.5ml
us$20000.-
therocyclerb..braunbiotech(德)
變溫水浴98℃四檔
電熱,來水冷卻
60×1.5ml
100×1.5ml
180×1.5ml
dm30000.-
automatictemperaturecy-clersingleblocktwinblockericompinc.(美)
塊25~100℃
電熱,自來水冷卻
29×1.5ml
58×1.5ml
us$4985.-
us$7980.-
grantautogengrantinstrumantltd(美)
變溫水浴0~99℃
電熱,自來水冷卻或加冷循環器
50×1.5ml
or
50×1.5ml
us$250.–plus
us$15.-for
rack(x2)
technephc-1(phc-2)techneltd.(英)
變溫鋁塊0~99℃三檔
電熱500w水冷100w
54×0.5ml
54×0.5ml
24×1.5ml
£333.–
£3997.-
biovenbiothrmcorp(美)
變溫氣流
-150℃
115v11a
200’sof4×96plate
us$2990.-
trio-thermo-blocktb-1biomertra(德)
半導體變溫
220v
3×20管
分別控溫
dm1200.-
microcyclereeppendorf(美)變溫鋁塊
常見問題
假陰性
不出現擴增條帶。 PCR反應的關鍵環節有①模板核酸的製備,②引物的質量與特異性,③酶的質量及溴乙錠的使用,④PCR循環條件。尋找原因亦應針對上述環節進行分析研究。 模板:①模板中含有雜蛋白質,②模板中含有Taq酶抑制劑,③模板中蛋白質沒有消化除淨,特別是染色體中的組蛋白,④在提取製備模板時丟失過多,或吸入酚。⑤模板核酸變性不徹底。在酶和引物質量好時,不出現擴增帶,極有可能是標本的消化處理,模板核酸提取過程出了毛病,因而要配製有效而穩定的消化處理液,其程式亦應固定不宜隨意更改。
陰性
需注意的是有時忘加Taq酶或溴乙錠。 引物:引物質量、引物的濃度、兩條引物的濃度是否對稱,是PCR失敗或擴增條帶不理想、容易彌散的常見原因。有些批號的引物合成質量有問題,兩條引物一條濃度高,一條濃度低,造成低效率的不對稱擴增,對策為:①選定一個好的引物合成單位。②引物的濃度不僅要看OD值,更要注重引物原液做瓊脂糖凝膠電泳,一定要有引物條帶出現,而且兩引物帶的亮度應大體一致,如一條引物有條帶,一條引物無條帶,此時做PCR有可能失敗,應和引物合成單位協商解決。如一條引物亮度高,一條亮度低,在稀釋引物時要平衡其濃度。③引物應高濃度小量分裝保存,防止多次凍融或長期放冰櫃冷藏部分,導致引物變質 電泳檢測[6] 降解失效。④引物設計不合理,如引物長度不夠,引物之間形成二聚體等。 Mg2+濃度:Mg2+離子濃度對PCR擴增效率影響很大,濃度過高可降低PCR擴增的特異性,濃度過低則影響PCR擴增產量甚至使PCR擴增失敗而不出擴增條帶。 反應體積的改變:通常進行PCR擴增採用的體積為20ul、30ul、50ul。或100ul,套用多大體積進行PCR擴增,是根據科研和臨床檢測不同目的而設定,在做小體積如20ul後,再做大體積時,一定要模索條件,否則容易失敗。 物理原因:變性對PCR擴增來說相當重要,如變性溫度低,變性時間短,極有可能出現假陰性;退火溫度過低,可致非特異性擴增而降低特異性擴增效率退火溫度過高影響引物與模板的結合而降低PCR擴增效率。有時還有必要用標準的溫度計,檢測一下擴增儀或水溶鍋內的變性、退火和延伸溫度,這也是PCR失敗的原因之一。 靶序列變異:如靶序列發生突變或缺失,影響引物與模板特異性結合,或因靶序列某段缺失使引物與模板失去互補序列,其PCR擴增是不會成功的。 假陽性 出現的PCR擴增條帶與目的靶序列條帶一致,有時其條帶更整齊,亮度更高。 引物設計不合適:選擇的擴增序列與非目的擴增序列有同源性,因而在進行PCR擴增時,擴增出的PCR產物為非目的性的序列。靶序列太短或引物太短,容易出現假陽性。需重新設計引物。 靶序列或擴增產物的交叉污染:這種污染有兩種原因:一是整個基因組或大片段的交叉污染,導致假陽性。這種假陽性可用以下方法解決:操作時應小心輕柔,防止將靶序列吸入加樣槍內或濺出離心管外。除酶及不能耐高溫的物質外,所有試劑或器材均應高壓消毒。所用離心管及樣進槍頭等均應一次性使用。必要時,在加標本前,反應管和試劑用紫外線照射,以破壞存在的核酸。二是空氣中的小片段核酸污染,這些小片段比靶序列短,但有一定的同源性。可互相拼接,與引物互補後,可擴增出PCR產物,而導致假陽性的產生,可用巢式PCR方法來減輕或消除。 出現非特異性擴增帶 PCR擴增後出現的條帶與預計的大小不一致,或大或小,或者同時出現特異性擴增帶與非特異性擴增帶。非特異性條帶的出現,其原因:一是引物與靶序列不完全互補、或引物聚合形成二聚體。二是Mg2+離子濃度過高、退火溫度過低,及PCR循環次數過多有關。其次是酶的質和量,往往一些來源的酶易出現非特異條帶而另一來源的酶則不出現,酶量過多有時也會出現非特異性擴增。其對策有:必要時重新設計引物。減低酶量或調換另一來源的酶。降低引物量,適當增加模板量,減少循環次數。適當提高退火溫度或採用二溫度點法(93℃變性,65℃左右退火與延伸)。 出現片狀拖帶或塗抹帶 PCR擴增有時出現塗抹帶或片狀帶或地毯樣帶。其原因往往由於酶量過多或酶的質量差,dNTP濃度過高,Mg2+濃度過高,退火溫度過低,循環次數過多引起。其對策有:減少酶量,或調換另一來源的酶。②減少dNTP的濃度。適當降低Mg2+濃度。增加模板量,減少循環次數。s$3500.-臨床套用
用於治療感染性疾病,腫瘤及遺傳病
感染性疾病
PCR在醫學檢驗學中最有價值的套用領域就是對感染性疾病的診斷。理論上,只要樣本有一個病原體存在,PCR就可以檢測到。一般實驗室也能檢出10~100基因拷貝,而目前病原體抗原檢測方法一般需要105-7個病原體才可檢測到。PCR對病原體的檢測解決了免疫學檢測的“視窗期”問題,可判斷疾病是否處於隱性或亞臨床狀態。
定量PCR研究資料已表明,病原體數量與感染性疾病病情的輕重程度、傳染性及治療效果均有相關性。許多研究表明,人類免疫缺陷病毒(HIV)感染後,潛伏期長短和臨床症狀輕重與血液中的病毒量顯著相關;也有研究表明,HIV病毒載量低於一定值時,沒有傳染性。
在B型肝炎病毒、C型肝炎病毒定量研究中發現,病毒的數量與某些藥物的療效相關。例如,干擾素治療對肝炎病毒高拷貝者不敏感,低拷貝者敏感;而有些藥物則具有顯著降低病毒高拷貝的作用。
腫瘤
癌基因的表達增加和突變,在許多腫瘤早期和良性的階段就可出現。PCR技術不但能有效的檢測基因的突變,而且能準確檢測癌基因的表達量,可據此進行腫瘤早期診斷、分型、分期和預後判斷。
幾乎所有慢性骨髓性白血病患者都可檢測到原癌基因易位導致的BCR/ABL融合基因形成,定量PCR技術可通過檢測BCR/ABL融合基因的表達確定微量殘餘惡性細胞存在的數量,以此作為治療效果和估計復發的危險性的依據。
一些病毒致癌作用也與病毒載量有關,EB病毒載量的FQ-PCR檢測結果已被用於鼻咽癌早期發現和隨訪。
遺傳病
PCR技術首次臨床套用就是從檢測鐮狀細胞和β-地中海貧血的基因突變開始的。基因的突變和缺失均會引起各種珠蛋白的表達不平衡,用FQ-PCR檢測各種珠蛋白基因表達差異,是地中海貧血診斷的有效手段。[8]
試驗污染編
PCR反應的最大特點是具有較大擴增能力與極高的靈敏性,但令人頭痛的問題是易污染,極其微量的污染即可造成假陽性的產生。污染原因
一、標本間交叉污染:標本污染主要有收集標本的容器被污染,或標本放置時,由於密封不嚴溢於容器外,或容器外粘有標本而造成相互間交叉污染;標本核酸模板在提取過程中,由於吸樣槍污染導致標本間污染;有些微生物標本尤其是病毒可隨氣溶膠或形成氣溶膠而擴散,導致彼此間的污染。二、PCR試劑的污染:主要是由於在PCR試劑配製過程中,由於加樣槍、容器、雙蒸水及其它溶液被PCR核酸模板污染。
三、PCR擴增產物污染:這是PCR反應中最主要最常見的污染問題。因為PCR產物拷貝量大(一般為1013拷貝/ml),遠遠高於PCR檢測數個拷貝的極限,所以極微量的PCR產物污染,就可形成假陽性。還有一種容易忽視,最可能造成PCR產物污染的形式是氣溶膠污染。在空氣與液體面摩擦時就可形成氣溶膠,在操作時比較劇烈地搖動反應管,開蓋時、吸樣時及污染進樣槍的反覆吸樣都可形成氣溶膠而污染。據計算一個氣溶膠顆粒可含48000拷貝,因而由其造成的污染是一個值得特別重視的問題。
四、實驗室中克隆質粒的污染:在分子生物學實驗室及某些用克隆質粒做陽性對照的檢驗室,這個問題也比較常見。因為克隆質粒在單位容積內含量相當高,另外在純化過程中需用較多的用具及試劑,而且在活細胞內的質粒,由於活細胞的生長繁殖的簡便性及具有很強的生命力。其污染可能性也很大。
污染的監測
一個好的實驗室,要時刻注意污染的監測,考慮有無污染是什麼原因造成的污染,以便採取措施,防止和消除污染。對照試驗
一、陽性對照:在建立PCR反應實驗室及一般的檢驗單位都應設有PCR陽性對照,它是PCR反應是否成功、產物條帶位置及大小是否合乎理論要求的一個重要的參考標誌。陽性對照要選擇擴增度中等、重複性好,經各種鑑定是該產物的標本,如以重組質粒為陽性對照,其含量宜低不宜高(100個拷貝以下)。但陽性對照尤其是重組質粒及高濃度陽性標本,其對檢測或擴增樣品污染的可能性很大。因而當某一PCR試劑經自己使用穩定,檢驗人員心中有數時,在以後的實驗中可免設陽性對照。
二、陰性對照:每次PCR實驗務必做陰性對照。它包括:
1.標本對照:被檢的標本是血清就用鑑定後的正常血清作對照;被檢的標本是組織細胞就用相應的組織細胞作對照。
2.試劑對照:在PCR試劑中不加模板DNA或RNA,進行PCR擴增,以監測試劑是否污染。
三、重複性試驗。
四、選擇不同區域的引物進行PCR擴增。[9]
反應特點
特異性強
聚合酶鏈式反應
PCR反應的特異性決定因素為:
①引物與模板DNA特異正確的結合;
②鹼基配對原則;
③TaqDNA聚合酶合成反應的忠實性;
④靶基因的特異性與保守性。
其中引物與模板的正確結合是關鍵。引物與模板的結合及引物鏈的延伸是遵循鹼基配對原則的。聚合酶合成反應的忠實性及TaqDNA聚合酶耐高溫性,使反應中模板與引物的結合(復性)可以在較高的溫度下進行,結合的特異性大大增加,被擴增的靶基因片段也就能保持很高的正確度。再通過選擇特異性和保守性高的靶基因區,其特異性程度就更高。
靈敏度高
PCR產物的生成量是以指數方式增加的,能將皮克(pg=10-12)量級的起始待測模板擴增到微克(μg=-6)水平。能從100萬個細胞中檢出一個靶細胞;在病毒的檢測中,PCR的靈敏度可達3個RFU(空斑形成單位);在細菌學中最小檢出率為3個細菌。
簡便、快速
PCR反套用耐高溫的TaqDNA聚合酶,一次性地將反應液加好後,即在DNA擴增液和水浴鍋上進行變性-退火-延伸反應,一般在2~4小時完成擴增反應。擴增產物一般用電泳分析,不一定要用同位素,無放射性污染、易推廣。 純度要求低 不需要分離病毒或細菌及培養細胞,DNA粗製品及RNA均可作為擴增模板。可直接用臨床標本如血液、體腔液、洗嗽液、毛髮、細胞、活組織等DNA擴增檢測。