概述
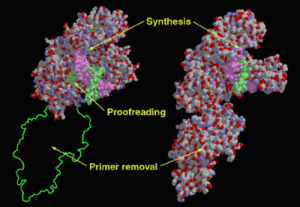
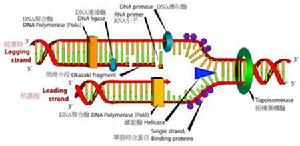
 聚合酶結構圖
聚合酶結構圖 polymerase又稱DNA聚合酶。系專司生物催化合成脫氧核糖核酸(DNA)和核糖核酸(RNA)的一類酶的統稱。1957年,美國科學家阿瑟·科恩伯格(Arthur Kornberg)首次在大腸桿菌中發現DNA聚合酶,這種酶被稱為DNA聚合酶I(DNA polymerase I,簡稱:Pol I)。1970年,德國科學家羅爾夫·克尼佩爾斯(Rolf Knippers)發現DNA聚合酶II(Pol II)。隨後,DNA聚合酶III(Pol III)被發現。原核生物中主要的DNA聚合酶及負責染色體複製的是Pol III。原核生物中主要的DNA聚合酶及負責染色體複製的是Pol III。
分類
 聚合酶醫學用途
聚合酶醫學用途 可分為以下幾個類群:(1)依賴DNA的DNA聚合酶;(2)依賴RNA的DNA聚合酶;(3)依賴DNA的RNA聚合酶;(4)依賴RNA的RNA聚合酶。前兩者是DNA聚合酶,它使DNA複製鏈按模板順序延長。如在原核生物中僅就大腸桿菌中已被發現的就有三種(分別簡稱為PolⅠ,PolⅡ和PolⅢ等);DNA聚合酶只能在有引物的基礎上,即在DNA或RNA引物的3′-OH延伸,這DNA的合成方向記為5′→3′。換言之DNA聚合酶催化反應除底物(αNTP)外,還需要Mg2 、模板DNA和引物,迄今細胞內尚無發現可從單體起始DNA的合成。同樣,上述(3)和(4)是催化RNA生物合成反應中最主要的RNA合成酶,它們以四種三磷酸核糖核苷(NTP)為底物,並需有DNA模板以及Mn2 及Mg2 的存在下,在前一個核苷酸3′-OH與下一個核苷酸的5′-P聚合形成3′,5′-磷酸二酯鍵,其新生鏈的方向也是5′→3′。RNA聚合酶也大量存在於原核和真核生物的細胞中。如大腸桿菌RNA聚合酶分子量4.8×105,由5條多肽鏈組成,分別命名為α,α,β,β′,和γ,全酶可用α2ββ′λ表示。真核生物RNA聚合酶分子大於5×105,由10~12個大小不等亞基組成。聚合酶除作為自然界生命活動中不可缺少的組分外,在實驗室中大多用作生命科學研究的工具酶類之一。
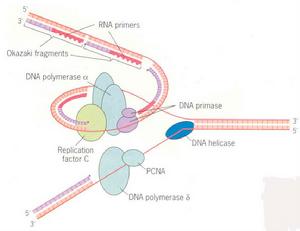
在試管內加入模板、底物和引物,DDDPⅠ就能催化新鏈DNA的生成。這證明DNA是可以脫離細胞環境複製的。由表7-1-1可知,三重DNA聚合酶都能延長子鏈,並具有3′→5′外切酶活性(圖7-1-4),DNA聚合酶I還具有5′→3′外切酶活性(圖7-1-5)。外切酶活性指的是從DNA末端逐個水解釋放核苷酸的能力,3′→5′外切過程可以切除3′末端錯配的核苷酸,它可以防止DNA複製過程中錯誤核苷酸的產生(校讀功能)。5′→3′外切過程使DNA岡崎片段(Okazaki fragments)3′端的RNA引物水解。三種DNA聚合酶中聚合能力最強的是DAN聚合酶III,因此該酶的主要功能是複製(子鏈延長)。
原核生物
細菌中,已有五種DNA聚合酶被發現。
DNA聚合酶I(Pol I):大腸桿菌K-12株的DNA聚合酶I由基因polA編碼,由928個胺基酸組成,分子量103.1kDa,結構類似球狀,直徑約6.5nm,每個細胞約有400個分子。
DNA聚合酶II(Pol II):在DNA穩定期的損傷修復中起作用。
DNA聚合酶III(Pol III):在大腸桿菌DNA複製過程中起主要作用。
DNA聚合酶IV(Pol IV):與DNA聚合酶II一起負責穩定期的損傷修復。
DNA聚合酶V(Pol V):參與SOS修復。
真核生物
Pol α:與引發酶(DNA Primase)形成複合體(Pol α-primase complex),合成約10nt RNA引子,然後做為DNA合成酶延伸此段RNA引子;合成約20個鹼基(iDNA)後,將後續的延伸過程交給Pol δ與ε。
Pol β:在DNA修復中起作用,低保真度的複製
Pol γ:複製線粒體DNA。
Pol δ:Pol δ與Pol ε是真核細胞的主要DNA聚合酶。
Pol ε:填補引物空隙,切除修復,重組
Pol ζ:不詳
性質
共性
此酶最早在大腸桿菌中發現,以後陸續在其他原核生物及微生物中找到。這類酶的共同性質是:以脫氧核苷酸三磷酸(dNTP)為前體催化合成DNA;需要模板和引物的存在;不能起始合成新的DNA鏈;催化dNTP加到生長中的DNA鏈的3'-OH末端;催化DNA合成的方向是5'→3'。下面首先介紹大腸桿菌的DNA聚合酶,然後簡略說明一下其他原核生物的DNA聚合酶和真核生物DNA聚合酶。特性
聚合作用:在引物RNA'-OH末端,以dNTP為底物,按模板DNA上的指令由DNApolⅠ逐個將核苷酸加上去,就是DNApol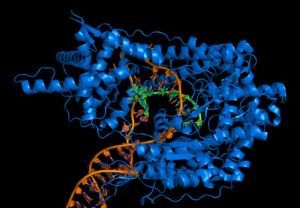 聚合酶結構圖
聚合酶結構圖 3'→5'外切酶活性──校對作用:這種酶活性的主要功能是從3'→5'方向識別和切除不配對的DNA 生長鏈末端的核苷酸。當反應體系中沒有反應底物dNTP時,由於沒有聚合作用而出現暫時的游離現象,從而被3'→5'外切酶活性所降解。如果提高反應體系的溫度可以促進這種作用,這表明溫度升高使DNA生長鏈3'末端與模板發生分離的機會更多,因而降解作用加強。當向反應體系加入dNTP,而且只加放與模板互補的上述核苷酸才會使這種外切酶活性受到抑制,並繼續進行DNA的合成。由此推論,3'→5'外切酶活性的主要功能是校對作用,當加入的核苷酸與模板不互補而游離時則被3'→5'外切酶切除,以便重新在這個位置上聚合對應的 核苷酸。在某些T4噬菌體突變株中DNA複製的真實性降低,而易發生突變,從此突變株分離得到的聚合酶的3'→5'外切酶活性很低。相反,另外一些具有抗突變能力的T4突變株中的聚合酶的3'→5'外切酶活性比野生型高得多,因此,其DNA複製真實性好,變異率低。可見,3'→5'外切酶活性對DNA複製真實性的維持是十分重要的。
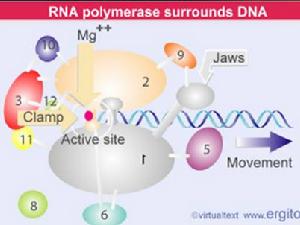
 聚合酶分子反應示意圖
聚合酶分子反應示意圖 焦 磷酸解作用:DNApolⅠ的這種活性可以催化3'末端焦 磷酸解DNA分子。這種作用就是無機焦磷酸分解DNA生長鏈,可以認為是DNA聚合作用的逆反應,而且這種水解DNA鏈作用需要有模板DNA的存在。(dNMP)n XPPi←(dNMP)n-x X(dNPPP)→DNA
焦磷酸交換作用:催化dNTP末端的PPi同無機焦磷酸的交換反應。反應式為32P32Pi dNPPP←dNP32P32P PPi→DNA
最後兩種作用,都要求有較高濃度的PPi,因此,在體內由於沒有足夠高的PPi而無重要意義。DNApolⅠ的DNA聚合酶活性和5'→3'外切酶活性協同作用,可以使DNA鏈上的切口向前推進,即沒有新的DNA合成,只有核苷酸的交換。這種反應叫 缺口平移(Nicktranslation)。當雙鏈DNA上某個磷酸二酯鍵斷裂產生切口時,DNApoIⅠ能從切口開始合成新的NDA鏈,同時切除原來的舊鏈。這樣,從切口開始合成了一條與被取代的舊鏈完全相同的新鏈。如果新摻入的脫氧核苷酸三磷酸為α-32P-dNTP,則重新合成的新鏈即為帶有同位素標記的DNA分子,可以用作探針進行分子雜交實驗。
儘管DNApolⅠ是第一個被鑑定的DNA聚合酶,但它不是在腸桿菌中DNA複製的主要聚合酶。主要證據如下:[1]純化的DNApolⅠ催化dNTP摻入的速率為667鹼基/分,而體內DNA合成速率要比此高二倍數量級;[2]大腸桿菌的一個突變株中,此酶的活力正常,但染色體DNA複製不正常;[3]而在另一些突變株中,DNApolⅠ的活力中只是野生型的1%,但是DNA複製卻正常,而且此 突變株增加了對紫外線、 烷化劑等突變因素的敏感性。這表明該酶與DNA複製關係不大,而在DNA修復中起著重要的作用。
一些特定的DNA聚合酶對於化學修飾性核苷分子顯示出驚人的耐受性,從而為高度功能化的核酸分子的有效合成提供了令人激動的新機遇。
研究成果
 聚合酶結構示意圖
聚合酶結構示意圖 德國波恩大學的MichaelFamulok就是這樣的研究者。他的研究小組已經發表了幾篇文章介紹這種方法的可行性。最近,他們加大研究力度,使用七種不同的細菌性DNA聚合酶,系統檢測了包含有酸性、鹼性和親脂性之類的不同功能基團的多種核苷分子整合到寡核苷酸鏈的情況。一些酶很難對這些異化性底物產生作用,但Pwo和Vent這兩種聚合酶則與眾不同,它們能有效地將所有能檢測到的核苷變異分子進行有效整合。在隨後的實驗中,Famulok的研究小組描述了那些可能影響整合效率的模板順序決定簇;以這兩個包含所有四種核苷類型變異體的寡核苷酸聚合酶為例證,介紹了這些酶的高效合成;同時還介紹了為生產功能相近產物而對一種修飾性模板成功進行的PCR擴增。
 聚合酶分子反應示意圖
聚合酶分子反應示意圖 Famulok最希望他的研究小組能為那些具有創新想法的研究者提供一種有價值的參考。他說:“如果人們想利用功能化的高密度DNA做些事情的話,雖然這些新思路我個人目前因為愚鈍還無法想像的話,但他們能在我們的論文中找到重要啟發,來幫助他們實現夢想。”
 顯微鏡下的聚合酶
顯微鏡下的聚合酶