簡述
 聚合酶鏈反應
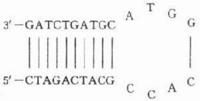
聚合酶鏈反應聚合酶鏈式反應(PCR)是20世紀80年代後期由K.Mullis等建立的一種體外酶促擴增特異DNA片段的技術。PCR是利用針對目的基因所設計的一對特異寡核苷酸引物,以目的基因為模板進行的DNA體外合成反應。由於反應循環可進行一定次數,所以在短時間內即可擴增獲得大量目的基因。 PCR技術具有靈敏度高、特異性性強、操作簡便等特點。雖然PCR技術也存在出錯傾向高、產物大小受到限制和必須預先有目標DNA序列等缺點,但仍被譽為20世紀分子生物學研究領域最重大的發明之一。Mullis也因貢獻卓著而獲得1993年度諾貝爾獎。目前,PCR技術已廣泛套用於分子生物學的各個領域,在分子克隆、法醫學鑑定、DNA序列分析、致病基因的檢測及考古學等方面都發揮著重要作用。
發展歷程
 K.B.Mullis
K.B.Mullis1953年,Watson和Crick提出DNA雙螺鏇結構及半保留複製模型。
1958年,Meselson和Stahl用實驗證實DNA半保留複製模型。
70年代以來,人們採用兩種思路去嘗試建立基因的無性繁殖體系,一是基因克隆技術,二是體外擴增技術。1971年,Khorana(美國MIT教授,1968年諾貝爾醫學獎得主):“經過DNA變性,與合適引物雜交,用DNA聚合酶延伸引物,並不斷重複該過程便可克隆tRNA基因。”但由於很難進行測序和合成寡核苷酸引物,同時1970年Smith等發現了II型限制性內切酶,體外克隆基因已成為可能,核酸體外擴增最早構想被人們遺忘。 1976年,台籍科學家錢嘉韻(Alice Chien)從黃石國家公園的嗜熱菌Thermus aquaticus中分離出熱穩定的Taq DNA聚合酶。
1985年,美國Cetus公司人類遺傳研究室的Mullis發明聚合酶鏈反應(Polymerase Chain Reaction,PCR),Saiki等首次套用PCR法成功地擴增了人β-珠蛋白的DNA,並套用於鐮刀狀紅細胞貧血的產前診斷。
1988年Saiki開始將耐熱性Taq DNA聚合酶套用於PCR,整個反應只加一次酶即可,擴增特異性和效率都明顯改善,操作大為簡化。
1989年被譽為“分子年”,列PCR為十餘項發明之首。
1993年,Mullis榮獲諾貝爾化學獎。
原理
 PCR八聯管
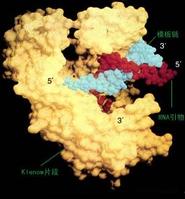
PCR八聯管 DNA的半保留複製是生物進化和傳代的重要途徑。在生物體內,雙鏈DNA在多種酶的作用下可以變性解鏈成單鏈,在DNA聚合酶與啟動子的參與下,根據鹼基互補配對原則複製成同樣的兩分子挎貝。在實驗中發現,DNA在高溫時也可以發生變性解鏈,當溫度降低後又可以復性成為雙鏈。因此,在生物體外,通過溫度變化控制DNA的變性和復性,並設計引物做啟動子,加入DNA聚合酶、dNTP就可以實現特定基因的體外複製。
PCR通過變性、退火、延伸三個基本步驟完成一個循環。多次循環後,目的DNA可得以迅速擴增。理論擴增率為2n遞增(n為循環次數),25~30循環,目標DNA可增加109倍。由於引物和底物的消耗,酶活力的下降等因素,擴增產物的增加,逐漸由指數形式變為線性形式,所以並不是循環次數越多越好。實際進行30個循環後,擴增倍數一般可達106~107。每完成一個循環需2~4分鐘,2~3小時就能將待擴目的基因擴增放大幾百萬倍。
步驟
標準的PCR過程分為三步,每一步的轉換通過溫度的改變控制。
1.DNA模板解鏈(變性)(90℃-96℃):雙鏈DNA模板在熱作用下,氫鍵斷裂,形成單鏈DNA
2.引物與模板結合(退火)(25℃-65℃):系統溫度降低,引物與DNA模板結合,形成局部雙鏈。
3.DNA聚合酶催化新生DNA的合成(延伸)(70℃-75℃):在TaqDNA聚合酶的作用下,以dNTP為原料,從引物的5′端→3′端延伸,合成與模板互補的DNA鏈。
此循環反覆進行,可使目的DNA得以迅速擴增。
反應體系
標準的PCR反應體系
 聚合酶鏈反應
聚合酶鏈反應10×擴增緩衝液10ul
4種dNTP混合物各200umol/L
引物各10~100pmol
模板DNA0.1~2ug
TaqDNA聚合酶2.5u
Mg2+1.5mmol/L
加雙或三蒸水至100ul
參加PCR反應的物質主要有五種即引物、酶、dNTP、模板和緩衝液(其中需要Mg2+)
引物
PCR 產物的特異性取決於寡核苷酸引物與模板DNA互補的程度。引物設計的基本原則是最大限度地提高擴增效率和特異性,同時儘可能抑制非特異性擴增。反應中的引物至少應含有18個與模板序列完全互補的核苷酸(常用軟體通常默認為20個),最大不能多於38個,否則最適延伸溫度會超過TaqDNA聚合酶的最適溫度(74℃),不能保證PCR擴增產物的特異性這樣才能保證擴增反應的特異性。引物擴增跨度以500核苷酸為宜,特定條件下可擴增長至10kb的片段。引物鹼基的G+C含量以40-60%為宜,太少擴增效果不佳,過多易出現非特異條帶。同時ATGC最好隨機分布,避免5個以上的嘌呤或嘧啶核苷酸的成串排列,尤其3′端不應超過3 個連續的G或C,因為這樣會使引物在G+C富集區引發錯誤延伸。控制引物的濃度,避免引物內部出現二級結構和引物間互補。引物 3’端的鹼基要求嚴格配對(不能做任何修飾),引物5′端可修飾,加上限制內切酶位點、啟動子序列或其它序列等,以便於PCR產物的分析克隆。
DNA聚合酶
 DMA聚合酶
DMA聚合酶最常用的是耐熱Taq DNA聚合酶。目前有兩種市面上有兩種Taq DNA 聚合酶供應,一種是從水生嗜熱桿菌中提純的天然酶;另一種是由大腸菌合/成的基因工程酶。一個典型的 PCR反應約需酶量1- 2.5U/100 ul體系,濃度過高可引起非特異性擴增,濃度過低則合成產物量減少。Taq 酶在95℃持續溫育仍能保持活性,因此引物的退火和延伸可以在更高的溫度下進行,使引物與模板的誤配大大減少。然而TaqDNA酶5’→3’聚合酶活性和5’→3’外切酶活性,無3’→5’外切活性,在PCR反應中如發生某些鹼基的錯配,該酶是沒有校正功能的。保真性不如Pfu DNA聚合酶等。
此外還有Vent DNA聚合酶和Pfu DNA聚合酶。
四種dNTP
在PCR反應中,dNTP應為50~200μM,濃度過低會降低PCR產物的產量。配製過程注意4種dNTP的濃度要相等(等摩爾配製 ),如其中任何一種濃度不同於其它幾種時(偏高或偏低),就會引起錯配。而高濃度的dNTP可與Mg2+結合,使游離的Mg2+濃度下降,影響DNA聚合酶的活性。
模板DNA
模板DNA的來源有三種,可從微生物中或血細胞、絨毛、尿樣、毛髮、精斑、口腔上皮細胞等細胞中提取DNA,也可將固定和包埋的組織標本脫蠟、蛋白酶K消化後提取DNA。模板DNA的濃度常為0.1~2ug/100ul體系。PCR產量隨模板DNA濃度的增加而顯著升高。
Mg2+
Mg2+對PCR擴增的特異性和產量有顯著的影響。在一般的 PCR反應中,各種dNTP濃度為200umol/L時,Mg2+濃度為1.5~2.0 mmol/L為宜,Mg2+濃度過高,反應特異性降低,出現非特異擴增, 濃度過低會降低 Taq DNA聚合酶的活性,使反應產物減少。
影響因素
溫度與時間
標準反應中採用三溫度點法,雙鏈DNA在90~95℃變性,再迅速冷卻至40~60℃退火,然後快速升溫至70~75℃延伸,對於較短靶基因(長度100~300bp)可採用二溫度點法, 將退火與延伸溫度合二為一,一般採用94℃變性,65℃左右退火與延伸。變性溫度與時間一般93℃~94℃,1min足以使模板變性。若低於93℃則需延長時間,但溫度不能過高,因為高溫環境對酶的活性有影響。退火溫度是影響PCR特異性的重要因素。退火(復性)溫度與時間取決於引物的長度、鹼基組成及其濃度,還有靶基因序列的長度。對於20個核苷酸,G+C含量約50%的引物,55℃作為選擇最適退火溫度的起點較為理想。一般試驗中退火溫度比擴增引物的融解溫度TTm低5℃,可按公式進行計算:
Ta = Tm -5℃= 4(G+C) 2(A+T)-5℃
其中A,T,G,C分別表示相應鹼基的個數。例如,20個鹼基的引物,如果(G C)%含量為50%時,則Ta的起點可設在55℃。在典型的引物濃度時(如0.2μmol/L),退火反應數秒即可完成,長時間退火沒有必要,一般為30~60s,足以使引物與模板之間完全結合。延伸溫度一般選擇在70~75℃之間,延伸溫度高於90℃時,DNA合成幾乎不能進行。過高的延伸溫度不利於引物和模板的結合。延伸反應時間根據待擴增片段長度而定,1Kb以內的DNA片段,延伸時間1min(足夠),3~4kb的靶序列需3~4min,擴增10kb需延伸至15min。延伸時間過長會導致非特異性擴增。對低濃度模板的擴增,延伸時間要稍長些。
循環次數
PCR反應的循環次數主要取決於模板DNA的濃度,一般為25~35次,此時PCR產物的積累即可達到最大值。
增強劑
PCR反應中加入一定濃度的增強劑如DMSO(1%~10%)、甘油(5%~20%)、非離子去污劑、甲醯胺(1.25%~10%)和牛血清白蛋白(10~100μg/ml)等可提高反應特異性和產量,有些反應只能在這些輔助劑存在時才能進行。但需要注意的是,這些增強劑濃度過高時不僅不能提高PCR反應的特異性和產量,還會對PCR反應產生抑制作用。
熱啟動PCR
即首先將模板變性,然後在較高溫度時加入Taq DNA聚合酶、引物及MgCl2等一些重要成分,這樣使得引物在較高溫度下與模板退火,提高了反應的嚴謹性,使擴增更特異。
檢測
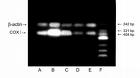 mRNA PCR擴增產物電泳結果
mRNA PCR擴增產物電泳結果PCR反應擴增出了高的拷貝數,下一步檢測就成了關鍵。螢光素(溴乙錠)染色凝膠電泳是最最常用的檢測手段。電泳法檢測特異性是不太高的,因此引物兩聚體等非特異性的雜交體很容易引起誤判。但因為其簡捷易行,成為了主流檢測方法。近年來以螢光探針為代表的檢測方法,有逐漸取代電泳法的趨勢。
套用模式
兼併引物PCR(DegeneratePrimer PCR)
 PCR儀器
PCR儀器密碼子具有兼併性,單以胺基酸順序推測編碼的DNA序列是不精確的,但可以設計成對兼併引物,擴增所有編碼已知順序的核酸序列。用兼併引物時寡核苷酸中核苷酸序列可以改變,但核苷酸的數量應相同。兼併度越低,產物特異性越強,設計引物時應儘量選擇兼併性小的胺基酸,並避免引物3’末端兼併,針對兼併的混合引物已成功地用於未知靶DNA的擴增、克隆和序列分析。現已成功地克隆了豬尿酸氧化酶基因、糖尿病相關肽基因和哺乳動物與禽類的嗜肝病毒基因。用脫氧肌苷(deoxyinosine;DI)引物進行PCR,可以代替編碼蛋白的多種兼併密碼子中的兼併鹼基,DI的特異性主要受cDNA濃度影響。
套式引物(NestedPrimer)PCR
用第一套引物擴增15~30個循環,再用擴增DNA片段內設定的第二套引物擴增15~30個循環,這樣可使待擴增序列得到高效擴增,而次級結構卻很少擴增。用起始引物限量方法或Centricon30(Amicon)分子濾過器離心,在第二套引物加入前去除第一引物。此方法已成功地用來分析中國倉鼠卵巢細胞AS52的分子突變。AS52細胞含有單拷貝的細胞gpt(guanine phos-phribosytransferase)基因,與哺乳動物具有同源性。套式引物PCR減少了引物非特異性退火,從而增加了特異性擴增,提高了擴增效率。對環境樣品中微生物檢測和單拷貝的基因靶DNA的擴增是非常有效的。
若將套式PCR的內外引物稍加改變,延長外引物長度(至25~30bp),同進縮短內引物長度(15~17bp),使外引物先在高溫退火溫度下做雙溫循環擴增,然後改換至三溫循環,使內引物在外引物擴增的基礎上作低溫火溫度的三溫循環直到擴增完成,這樣就可以使兩套引物一次同時加入,兩種循環一氣呵成,等於只做一次PCR,而靈敏度與套式二次PCR無異,在我們最近推出的PTc 51氣流式DNA熱循環儀上就可以完成全部程式。套式一次PCR的成功,使PCR檢測的全過程可以在5h內完成,使當天出檢驗報告成為現實,也使PCR檢測走入臨床有了現實的基礎。
複合PCR(Multiplex PCR)
用多對引物同時擴增幾條DNA片段的方法稱為複合PCR。這一方法最初是由Chanberlain 等檢測人的基因發展而來。Bej等隨之發展了對環境樣品中不同屬細菌相關基因序列同時PCR擴增的檢測方法。兩種不同的軍團菌(legionella)基因,一為特異嗜肺L基因(mip),另一種為L-5SrRNA基因,通過引物搖擺(staggered)添加進行複合PCR。首先mip引物PCR擴增7個循環,然後加入5SrRNA引物PCR擴增38個循環。加入不同量的LacZ和LacB基因引物進行PCR擴增可以檢測大腸桿菌和與人類糞便污染有關的細菌包括E.coli大腸菌、腸源致病沙門氏菌和志賀氏菌。
在複合PCR中,所有引物Ta值應相近。如果兩對引物Tq值差異超過±℃10%,會使擴增產物的量明顯不同,其中一種擴增產物或目的DNA很難觀察到。另外,靶DNA的長度也應相近,差別大時短片的靶DNA會優先擴增,因此,會產生不同產量的擴增產物,為此,須採用DNA搖擺擴增或加入不等量的引物方法進行解決。
反向PCR(Inverse PCR或Reverse PCR)
反向PCR的目的在於擴增一段已知序列旁側的DNA,也就是說這一反應體系不是在一對引物之間而是在引物外側合成DNA。反向PCR可用於研究與已知DNA區段相連線的未知染色體序列,因此又可稱為染色體緩移或染色體步移。這時選擇的引物雖然與核心DNA區兩末端序列互補,但兩引物3’端是相互反向的。擴增前先用限制性內切酶酶切樣品DNA,然後用DNA連線酶連線成一個環狀DNA分子,通過反向PCR擴增引物的上游片段和下游片段;現已製備了酵母人工染色體(YAC)大的線狀DNA片段的雜交探針,這對於轉座子插入序列的確定和基因庫染色體上DNA片段序列的識別十分重要。
該方法的不足是:①需要從許多酶中選擇限制酶,或者說必須選擇一種合適的酶進行酶切才能得到合理大小的DNA片段。這種選擇不能在非酶切位點切斷靶DNA。②大多數有核基因組含有大量中度和高度重複序列,而在YAC或Cosmid中的未知功能序列中有時也會有這些序列,這樣,通過反向PCR得到的探針就有可能與多個基因序列雜交。
利用反向PCR可對未知序列擴增後進行分析,探索鄰接已知DNA片段的序列,並可將僅知部分序列的全長cDNA進行分子克隆,建立全長的DNA探針。適用於基因遊走、轉位因子和已知序列DNA旁側病毒整合位點分析等研究。
不對稱PCR(Asymmetric PCR)
不對稱PCR的基本原理是採用不等量的一對引物產生大量的單鏈DNA(ss-DNA)。這兩種引物分別稱為限制性引物與非限制性引物;其最佳比例一般為1:50~1:100,關鍵是限制引物的絕對量。限制性引物太多太少,均不利於製備ss-DNA。也可用普通PCR製備靶DNA雙鏈DNA(ds-DNA),再以ds-DNA為模板,只用其中一種過量引物進行單引物PCR製備ss-DNA。產生的ds-DNA與ss-DNA由於分子量不同可以在電泳中分開,而得到純ss-DNA。不對稱PCR主要為測序製備ss-DNA,尤為用cD-NA經不對稱PCR進行DNA序列分析是研究真核DNA外顯子的好方法。
標記PCR(LP-PCR)和彩色PCR
LP-PCR(Labelled Primers PCR)是利用同位素、螢光素等對PCR引物5’端進行標記,據此檢測目的基因的存在與否,與常規PCR相比更為直觀,省去了限制性內切酶酶切及分子雜交等繁瑣步驟,而且一次可以同時分析多種基因成分,因而特別適合於大量臨床標本的基因診斷。該方法只對PCR產物進行定性鑑定。
彩色PCR(Colorcomplement assay)直譯為“著色互補性檢測”,是LP-PCR的一種,彩色PCR意譯更為明確:它用螢光染料標記引物的5’端。 螢光染料JOE和FAM呈綠色螢光;TAMRA呈紅色螢光;COUM呈藍色螢光。不同螢光標記的引物同時參加反應,擴增後的目的基因會分別帶有引物5’端的染料,通過電泳或離心沉澱,肉眼就可以根據不同螢光的色澤判斷目標基因是否存在及擴增基因的類型。通常僅需2種不同顏色的引物,一種作為基因檢測引物;另一種作為控制條件的內對照,即可診斷基因缺失、染色體易位或感染某種病毒。檢測多種點突變時,可用更多的色彩,如多點突變的遺傳病、幾種可疑病毒感染、HLA位點分析都可以用彩色PCR同時檢測多個位點。
加端PCR
加端PCR(add-PCR)是使擴增產物的5’-末端加一段DNA順序的PCR。設計加端PCR的引物時,除與模板配對的那一部分外再加上若干鹼基,這樣使擴增產物的末端加上額外一段DNA,如加上一個限制酶的識別順序或特定功能的DNA片段。Stoflet等報導在結構基因前加上噬菌體T7的啟動子,當然也可用於DNA片段的末端標記或引入特定的點突變。末端可加鹼基的數量與引物的長短有關,當引物足夠長時擴增產物或末端甚至可以加上十幾個到幾十個鹼基。
錨定PCR或固定PCR
錨定PCR(AnchoredPCR,A-PCR)主要用於分析具有可變末端的DNA序列,Loh等用A-PCR對人外周血淋巴細胞T細胞受體α-鏈的mRNA的多變性進行了分析。先合成cDNA,並用末端脫氧核苷酸轉移酶在其3’-可變區末端加上一個PolyG尾巴。Loh等恆定區與可變區連線部位設一個引物,另一個引物是一個具5’-polyG尾巴的引物。帶有PolyG尾巴的引物是一個固定點,它可以並與PolyG尾巴結合,無論其餘部分序列如何,只識別片段末端,利用此法可從前述mRNA中檢出至少20種不同序列,每一種都是獨特的,表明A-PCR不對任何特殊序列有傾向性結果,可用於T細胞、腫瘤及其它部位抗體基因的研究。
玻片PCR
在聚丙烯管中可以對多種含膜板材料進行PCR,而在顯微玻片上用組織細胞塗片或切片直接進行DNA擴增的方法就稱為玻片PCR(Slide-PCR)。先將細胞塗片或呈單層細胞,然後用甲醇/醋酸(3:1,V/V)、Carnoy溶液、無水乙醇或4%多聚甲醛溶液固定5~15min。用蒸餾水沖洗,乾燥,直接使用或保存於-20℃備用。在玻片上劃20mm×28mm為免疫組化反應區。加入30μl PCR反應混合液,其中含10mmol/L TrispH8,3,50mmol/L KCl,1.5mmol/L MgCl2,200μmol/l dNTPs,100nmol/L引物,0.01%(V/V)明膠,0.2%BSA,2.5u/100μl Taq酶。然後蓋上22mm×40mm的蓋玻片,邊緣用石蠟油封好。把玻片放入PCR熱循環儀金屬塊上,使金屬塊與樣品呈最大程度接觸,同在聚丙烯管中一樣,進行30~40個循環。對於較短的擴增片段在後期循環中變性溫度可降低。反應後,將致冷玻片放在氯仿中除去大部分石蠟油,但不取出蓋玻片,用一個尖鑷子輕輕拈起蓋玻片一角,在相對的一角中PCR反應混合液呈半月形液面,用移液器回收。一般可回收25μl混合液,將反應產物進行瓊脂糖電泳或用套式PCR引物按標準PCR進行重新擴增。片上擴增物可做原位雜交顯示。
在Slide-PCR中,需0.1%~1%的BSA。加入BSA可以保證擴增結果,但效率不一定很高。明膠(至少0.0001%),對擴增1kb左右的靶DNA十分重要。但對小片段擴增結果影響不大。不同的樣品提取方法或固定法對Slide-PCR都可行。
Silde-PCR的機理可能是在起始變性過程中一部分DNA從細胞中洗提出來,然後在細胞和玻片的水相中進行PCR。用地高辛標記的人全基因組DNA探針雜交表明在起始循環中DNA極微量,而30個循環後很豐富。常規細胞染色表明只有少量的形態改變。
Silde-PCR對於玻片上的細胞樣品提供了一種較好的方法,而不必再把這些樣品從玻片上括下來,使操作簡便,污染減少。本方法對於原樣品量極微且需病史追蹤保存的(如子宮頸塗片或塗片)具有實用價值。
反轉錄PCR方法檢測RNA
RNA的多聚酶鏈式反應(RT-PCR)是以RNA為模板,聯合逆轉錄反應(reverse transcrip-tion, RT)與PCR,可用於檢測單個細胞或少數細胞中少於10個拷貝的特異DNA,為RNA病毒檢測提供了方便;並為獲得與擴增特定的RNA互補的cDNA提供了一條極為有利和有效的途徑。RNA擴增包括兩個步驟:①在單引物的介導下和逆轉錄酶的催化下,合成RNA的互補鏈cDNA;②加熱後cDNA與RNA鏈解離,然後與另一引物退火,並由DNA聚合酶催化引物延伸生成雙鏈靶DNA,最後擴增靶DNA。
在RT-PCR中關鍵步驟是RNA的逆轉錄,cDNA的PCR與一般PCR條件一樣。由於引物的高度選擇性,細胞總RNA無需進行分級分離,即可直接用於RNA的PCR。但RT-PCR對RNA製品的要求極為嚴格,作為模板的RNA分子必須是完整的,並且不含DNA、蛋白質和其它雜質。RNA中即使含有極微量的DNA,經擴增後也會出現非特異性擴增;蛋白質未除淨,與RNA結合後會影響逆轉錄和PCR;殘存的RNase極易將膜板RNA降解掉。硫氰酸胍(GaSCN)-CsCl法或酸性硫氰酸胍-酚-氯仿法可提得理想的RNA製品,尤以後者方法為佳,適合一般實驗室進行。
常用的逆轉錄酶有兩種,即禽類成髓細胞性白血病病毒(Avianmyeloblastosis virus, AMV)和莫洛尼鼠類白血病病毒(Moloney murineleukemia virus, MO-MLV)的逆轉錄酶(RT)。一般情況下用Mo-MLV-RT較多,但模板RNA的二級結構嚴重影響逆轉錄時,可改用AMV-RT ,因後者最適溫度為72℃,高於Mo-MLV-RT的最適溫度(37℃),而較高的反應溫度有助於消除RNA的二級結構。
一步法擴增(one step amplification)是為了檢測低豐度mRNA的表達,利用同一種緩衝液,在同一體系中加入逆轉錄酶、引物、Taq酶、4種dNTP直接進行mRNA反轉錄與PCR擴增。發現Taq酶不僅具有DNA多聚酶的作用,而且具有反轉錄酶活性,可利用其雙重作用在同一體系中直接以mRNA為模板進行反轉錄和其後的PCR擴增,從而使mRNA的PCR步驟更為簡化,所需樣品量減少到最低限度,臨床小樣品的檢測非常有利。用一步法擴增可檢測出總RNA中小於1ng的低豐度mRNA。該法還可用於低豐度mRNA的cDNA文庫的構建及特異cD-NA的克隆,並有可能與Taq酶的測序技術相組合,使得自動反轉錄、基因擴增與基因轉錄產物的測序在一個試管中進行。
定量PCR
1.DNA-PCR定量用同位素標記的探針與電泳分離後的PCR擴增產物進行雜交,根據放射自顯影后底片曝光強弱可以對模板DNA進行定量。Abbot等利用這種方法對人類T細胞白血病反轉錄基因進行了定量研究。
PCR擴增產物用專為檢測ds-DNA而設計的微量螢光計定量,利用染料H33258專與雙鏈DNA結合而使螢光增強50倍的特性。可以從標準模板系列稀釋擴增產物量曲線上讀出樣品中模板DNA的量或拷貝數,達到PCR定量的目的。
利用倍比稀釋模板作系列稀釋PCR,求出最低(PCR-EB)檢測限來比較,也是常用的半定量PCR方法。
2.mRNA-PCR定量由於MRNA-PCR定量需經兩個酶(RT和Taq)催化,因而影響因素較多。1989年Wang等報導了低豐度mRNA絕對定量方法。利用濃度已知且與待測靶mR-NA序列相同的內對照mRNA(其片段長短不同,便於PCR擴增後產物的分離),在同一體系中,用相同的由32P標記的引物與待測mRNA一同進行逆轉錄和PCR擴增,擴增產物電泳後,分別測定二者產物放射性強度,由預先製備的標準曲線推算出每個樣本特異mRNA的量。Gilliland等的結果表明,在1ng總RNA中可以對小於1pg的特異mRNA進行定量。這一定量方法在腫瘤、代謝失調、基因表達調控等研究中均有重要意義。
技術套用
 指紋鑑定
指紋鑑定由於PCR技術具有快速、簡便、靈敏等特點,已被廣泛地套用於臨床醫學、遺傳諮詢、司法鑑定、考古學及分子生物學等各個領域,有的替代了原有的方法,有的大大簡化和方便了原有的方法。現將最常用的套用領域及研究方法介紹如下。
基因分析
PCR技術能夠快速、靈敏地放大被測試的目的基因,所以可用於鑑定由於基因缺失、突變、轉位及外源基因進入(如病毒感染)所引起的各種疾病。PCR技術已廣泛地用於遺傳病的基因分析、產前診斷、傳染病病原體檢測、癌基因臨床分析等方面。PCR結合分子雜交等分析方法可進一步提高檢測的靈敏度和準確性。
定位克隆
只要知道目的基因兩端的序列,就可通過RT-PCR和重組PCR等技術進行基因克隆,這不僅省略了通常製備DNA片段的繁瑣步驟,也避免了進行亞克隆的經典程式。
序列分析
PCR技術使DNA測序大為簡化,因此現在幾乎都採用PCR法進行序列測定。
除了上述三個方面的套用外,PCR還可用來製備高比活性標記探針,利用重組PCR可進行基因的人工定位突變和基因表達調控的研究。利用錨定PCR、反向PCR等還可對求知序列的基因進行分析。利用差示PCR、競爭PCR可進行DNA及mRNA的定量分析。法醫學中套用PCR還可精確地選擇出組織器官移植的合適配型。