探針種類
 分子雜交
分子雜交分子雜交基因探針根據標記方法不同可粗分為放射性探針和非放射性探針兩大類,根據探針的核酸性質不同又可分為DNA探針,RNA探針,cDNA探針,cRNA探針及寡核苷酸探針等幾類,DNA探針還有單鏈和雙鏈之分。下面分別介紹這幾種探針。 (一)DNA探針
DNA探針是最常用的核酸探針,指長度在幾百鹼基對以上的雙鏈DNA或單鏈DNA探針。現已獲得DNA探針數量很多,有細菌、病毒、原蟲、真菌、動物和人類細胞DNA探針。這類探針多為某一基因的全部或部分序列,或某一非編碼序列。這些DNA片段須是特異的,如細菌的毒力因子基因探針和人類Alu探針。這些DNA探針的獲得有賴於分子克隆技術的發展和套用。以細菌為例,目前分子雜交技術用於細菌的分類和菌種鑑定比之G+C百分比值要準確的多,是細菌分類學的一個發展方向。加之分子雜交技術的高敏感性,分子雜交在臨床微生物診斷上具有廣闊的前景。細菌的基因組大小約5×106bp,約含3000個基因。各種細菌之間絕大部分DNA是相同的,要獲得某細菌特異的核酸探針,通常要採取建立細菌基因組DNA文庫的辦法,即將細菌DNA切成小片段後分別克隆得到包含基因組的全信息的克隆庫。
然後用多種其它菌種的DNA作探針來篩選,產生雜交信號的克隆被剔除,最後剩下的不與任何其它細菌雜交的克隆則可能含有該細菌特異性DNA片段。將此重組質粒標記後作探針進一步鑑定,亦可經DNA序列分析鑑定其基因來源和功能。因此要得到一種特異性DNA探針,常常是比較繁瑣的。探針DNA克隆的篩選也可採用血清學方法,所不同的是所建DNA文庫為可表達性,克隆菌落或噬斑經裂解後釋放出表達抗原,然後用來源細菌的多克隆抗血清篩選陽性克隆,所得到多個陽性克隆再經其它細菌的抗血清篩選,最後只與本細菌抗血清反應的表達克隆即含有此細菌的特異性基因片段,它所編碼的蛋白是該菌種所特有的。用這種表達文庫篩選得到的顯然只是特定基因探針。
對於基因探針的克隆尚有更快捷的途徑。這也是許多重要蛋白質的編碼基因的克隆方法。該方法的第一步是分離純化蛋白質,然後測定該蛋白的氨基或羥基末端的部分胺基酸序列,然後根據這一序列合成一套寡核苷酸探針。用此探針在DNA文庫中篩選,陽性克隆即是目標蛋白的編碼基因。值得一提的是真核細胞和原核細胞DNA組織有所不同。真核基因中含有非編碼的內含子序列,而原核則沒有。因此,真核基因組DNA探針用於檢測基因表達時雜交效率要明顯低於cDNA探針。DNA探針(包括cDNA探針)的主要優點有下面三點:①這類探針多克隆在質粒載體中,可以無限繁殖,取之不盡,製備方法簡便。②DNA探針不易降解(相對RNA而言),一般能有效抑制DNA酶活性。③DNA探針的標記方法較成熟,有多種方法可供選擇,如缺口平移,隨機引物法,PCR標記法等,能用於同位素和非同位素標記。
 分子雜交
分子雜交(二)cDNA探針
cDNA(complementaryDNA)是指互補於mRNA的DNA分子。cDNA是由RNA經一種稱為逆轉錄酶(reversetranscriptase)的DNA聚合酶催化產生的,這種逆錄酶是Temin等在70年代初研究致癌RNA病毒時發現的。該酶以RNA為模板,根據鹼基配對原則,按照RNA的核苷酸順序合成DNA(其中U與A配對)。這一途徑與一般遺傳信息流的方向相反,故稱反向轉錄或逆轉錄。攜帶逆轉錄酶的病毒侵入宿主細胞後,病毒RNA在逆轉錄酶的催化下轉化成雙鏈cDNA,並進而整合人宿主細胞染色體DNA分子,隨宿主細胞DNA複製同時複製。這種整合的病毒基因組稱為原病毒。在靜止狀態下,可被複製多代,但不被表達,故無毒性。一旦因某種因素刺激而被活化,則該病毒大量複製,如其帶有癌基因,還可能誘發細胞癌變,後來發現逆轉錄酶不僅普遍存在於RNA病毒中,而且哺乳動物的胚胎細胞和正在分裂的淋巴細胞也含有逆轉錄酶。逆轉錄酶的作用是以dNTP為底物,RNA為模板,tRNA(主要是色氨酸tRNA)為引物,在Trna3’-OH末端上,5’-3’方向,合成與RNA互補的DNA單鏈,稱為互補DNA(cDNA),單鏈cDNA與模板RNA形成RNA-DNA雜交體。隨後在逆轉錄酶的RNaseH活性作用下,將RNA鏈水解成小片段。cDNA單鏈的3’末端回折形成一個小引物末端,逆轉錄酶又以第一條cDNA鏈為模板再合成第二第cDNA鏈,至此,完成逆轉錄全過程,合成雙鏈cDNA。 逆轉錄現在已成為一項重要的分子生物學技術,廣泛用於基因的克隆和表達。從逆轉錄病毒中提取的逆轉錄酶已商品化,最常用的有AMV逆轉錄酶。利用真核Mrna3’末端存在一段聚腺苷酸尾,可以合成一段寡聚胸苷酸(oligo(dT))用作引物,在逆轉錄酶催化下合成互補於mRNA的cRNA鏈,然後再用RNaseH將mRNA消化掉,再加入大腸桿菌的DNA聚合酶I催化合成另一條DNA鏈,即完成了從mRNA到雙鏈DNA的逆轉錄過程。所得到的雙鏈cDNA分子經S1核酸酶切平兩端後接一個有限制酶切點的接頭(linker),再經特定的限制酶消化產生粘性末端,即可與含互補末端的載體進行連線。常用的克隆載體是λ噬菌體DNA,如λgt,EMBL和Charon系列等。用這類載體可以得到包含104以上的轉化子的文庫,再經前面介紹的篩選方法篩選特定基因克隆。用這種技術獲得的DNA探針不含有內含子序列。因此尤其適用於基因表達的檢測。
(三)RNA探針
 分子雜交
分子雜交RNA探針是一類很有前途的核酸探針,由於RNA是單鏈分子,所以它與靶序列的雜交反應效率極高。早期採用的RNA探針是細胞mRNA探針和病毒RNA探針,這些RNA是在細胞基因轉錄或病毒複製過程中得到標記的,標記效率往往不高,且受到多種因素的制約。這類RNA探針主要用於研究目的,而不是用於檢測。例如,在篩選逆轉錄病毒人類免疫缺陷病毒(HIV)的基因組DNA克隆時,因無DNA探針可利用,就利用HIV的全套標記mRNA作為探針,成功地篩選到多株HIV基因組DNA克隆。又如進行中的轉錄分析(nuclearrunontranscrip-tionassay)時,在體外將細胞核分離出來,然後在α-32P-ATP的存在下進行轉錄,所合成mR-NA均摻入同位素而得到標記,此混合mRNA與固定於硝酸纖維素濾膜上的某一特定的基因的DNA進行雜交,便可反映出該基因的轉錄狀態,這是一種反向探針實驗技術。 近幾年體外轉錄技術不斷完善,已相繼建立了單向和雙向體外轉錄系統。該系統主要基於一類新型載體pSP和pGEM,這類載體在多克隆位點兩側分別帶有SP6啟動子和T7啟動子,在SP6RNA聚合酶或T7RNA聚合酶作用下可以進行RNA轉錄,如果在多克隆位點接頭中插入了外源DNA片段,則可以此DNA兩條鏈中的一條為模板轉錄生成RNA。這種體外轉錄反應效率很高,在1h內可合成近10μg的RNA產生,只要在底物中加入適量的放射性或生物素標記的NTP,則所合成的RNA可得到高效標記。該方法能有效地控制探針的長度並可提高標記物的利用率。
值得一提的是,通過改變外源基因的插入方向或選用不同的RNA聚合酶,可以控制RNA的轉錄方向,即以哪條DNA鏈以模板轉錄RNA。這種可以得到同義RNA探針(與mRNA同序列)和反義RNA探針(與mRNA互補),反義RNA又稱cRNA,除可用於反義核酸研究外,還可用於檢測mRNA的表達水平。在這種情況下,因為探針和靶序列均為單鏈,所以雜交的效率要比DNA-DNA雜交高几個數量級。RNA探針除可用於檢測DNA和mRNA外,還有一個重要用途,在研究基因表達時,常常需要觀察該基因的轉錄狀況。在原核表達系統中外源基因不僅進行正向轉錄,有時還存在反向轉錄(即生成反義RNA),這種現象往往是外源基因表達不高的重要原因。另外,在真核系統,某些基因也存在反向轉錄,產生反義RNA,參與自身表達的調控。在這些情況下,要準確測定正向和反向轉錄水平就不能用雙鏈DNA探針,而只能用RNA探針或單鏈DNA探針。
綜上所述,RNA探針和cRNA探針具有DNA探針所不能比擬的高雜交效率,但RNA探針也存在易於降解和標記方法複雜等缺點。
 分子雜交
分子雜交(四)寡核酸探針
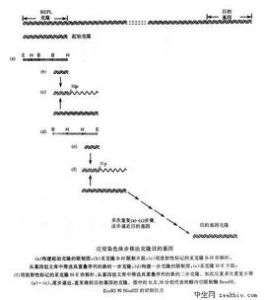
前述三種探針均是可克隆的,一般情況下,只要有克隆的探針,就不用寡核苷酸探針。在DNA序列未知而必須首先進行克隆以便繪製酶譜和測序時,也常套用克隆。克隆探針一般較寡核苷酸探針特異性強,複雜度也高,從統計學角度而言,較長的序列隨機碰撞互補序列的機會較短序列少,克隆探針的另一優點是,可獲得較強的雜交信號,因為克隆探針較寡核苷酸探針摻入的可檢測標記基因更多。但是,較長的探針對於靶序列變異的識別能力又有所降低。對於僅是單個鹼基或少數鹼基不同的兩序列,克隆探針不能區分,往往雜交信號相當。這既是其優點,又是其缺點。優點是當用於檢測病原微生物時,不會因病毒或細菌DNA的少許變異而漏診,缺點則是不能用於點突變的檢測。這種情況下,通常要採用化學合成的寡核苷酸探針。 合成的寡核苷酸探針具有一些獨特的優點:①由於鏈短,其序列複雜度低,分子量小,所以和等量靶位點完全雜交的時間比克隆探針短,如20nt的寡核苷酸探針在濃度為100ng/ml,靶序列為1~100pg、1kb片段或3×10-18~3×10-16mol/L時,達到最大程度的雜交只需10min,而用2kb的克隆探針在同樣條件下達到完全雜交則需16h。②寡核苷酸探針可識別靶序列內1個鹼基的變化,因為短探針中鹼基的錯配能大幅度地降低雜交體的Tm值。③一次可大量合成寡核苷酸探針(1~10mg),使得這種探針價格低廉,與克隆探針一樣,寡核苷酸探針能夠用酶學或化學方法修飾以進行非放射性標記物的標記。儘管克隆探針較特異,但通過細心篩選序列和/或選擇相對長的序列(>30nt)亦可設計出非常特異的寡核苷酸探針。最常用的寡核苷酸探針有18~40個鹼基,目前的合成儀可有效地合成至少50個鹼基的探針。下面是篩選寡核苷酸針的一些原則。
①長18~50nt,較長探針雜交時間較長,合成量低;較短探針特異性會差些。②鹼基成分:G+C含量為40%~60%,超出此範圍則會增加非特異雜交。③探針分子內不應存在互補區,否則會出現抑制探針雜交的“髮夾”狀結構。④避免單一鹼基的重複出現(不能多於4個),如-CCCCC-。⑤一旦選定某一序更符合上述標準,最好將序列與核酸庫中核酸序列比較,探針序列應與含靶序列的核酸雜交,而與非靶區域的同源性不能超過70%或有連續8個或更多的鹼基的同源,否則,該探針不能用。
按上述原則選出的探針會增加成功的機會,選定後進行合成與標記,並摸索合適的雜交條件。方法是製備幾張點有特異靶DNA和不相關DNA的膜,各膜分別在不同溫度下與探針雜交,特異靶DNA雜交信號強而非特異DNA不產生任何雜交反應的就是最適雜交溫度。在進行點突變檢測雜交的反應時,洗膜條件和溫度物選擇往往更為重要。所選漂洗條件必需使野生型靶DNA與探針產生強的雜交信號而突變型靶DNA則不產生雜交信號,這可以通過逐漸提高洗膜溫度來完成。
 分子雜交
分子雜交寡核苷酸探針還有一個重要用途。在用於檢測單個鹼基差異時尚可採用一種稱為寡核苷酸限制(oligonucleotiderestriction)的技術。該技術只有在突變點位於某一限制性內切酶識別位點時才有效。例如,鐮刀狀紅細胞貧血是因β珠蛋白基因的第6個寡碼子由GAG變成GTG,從而導致所編碼胺基酸由酪氨酸變成纈氨酸。突變的β-珠蛋白功能異常,稱作S珠蛋白,而野生型稱為A珠蛋白,其基因型分別為βS和βA。恰好突變點A→T位於DelI的識別序列CT-NAG之內,這就為設計寡核苷酸限制實驗創造了條件。方法是合成一個長40個鹼基的寡核苷酸探針,其5’末端距突變鹼基有11個鹼基,該探針與βA基因的非編碼鏈互補。將此探針的5’末端標記上32P。雜交方法採用液相雜交法,即在液相中將靶DNA變性解鏈,然後與探針退火,產生雜交體。如靶DNA為βA型,則兩條鏈完全互補,並產生DdeI的酶切位點;如待檢DNA為βS型,則所形成的雜交體中兩條鏈在突變鹼基處不配對,從而不能被DelI所識別。用DelI消化雜交DNA,顯然βA會被切開而βS不被切開。 βADNA雜交體被切開後,5’端探針序列因只有8個鹼基,與雜交鏈結合不緊而解離,從而產生游離的5’端標記8核苷酸單鏈。不被切開的βS雜交體尚可被另一個限制酶HinfI消化,該酶的識別位點緊靠DelI識別位點上游。βS雜交DNA經HinfI消化後,將釋出探針DNA的5’末端3核苷酸小片段。βADNA雜交體因已無HinfI識別序列,故而不能被HinfI消化。這樣βA和βSDNA經此寡核苷酸探針雜交和DelI及HinfI消化後,分別產生游離的8核苷酸(8nt)和3核苷酸(3nt)片段,它們可以經電泳分離後進行放射自顯影而獲證實。藉此策略,可輕易將各種β珠蛋白突變型鑑別開,如純合野生型AA結果為僅有8nt片段,純合突變型SS則僅可檢出3nt片段,而雜合子AS型則兩種片段均存在。
