 縱原子、分子或原子團、分子團,使其重新排列組合,形成新的具有納米尺度的物質或結構,進而研究其特性及其實際套用的一門新興科學與技術。納米科技自上世紀被提出之後,在材料、冶金、化學化工、醫學、環境、食品等各領域均表現出巨大的套用前景。在藥物研究領域,由於納米技術的不斷滲透和影響,引發了藥物領域一場深遠的革命,從而出現了納米藥物這一新名詞。納米藥物是指以納米級高分子納米粒(nano-particles,NP)、納米球 (nano.spheres NS)、納米囊(nano-capsules,NC)等為載體,與藥物以一定方式結合在一起後製成的藥物,其粒徑可能超過100nm,但通常應小於500nm。納米藥物也可以是直接將原料藥物加工製成的納米粒。
縱原子、分子或原子團、分子團,使其重新排列組合,形成新的具有納米尺度的物質或結構,進而研究其特性及其實際套用的一門新興科學與技術。納米科技自上世紀被提出之後,在材料、冶金、化學化工、醫學、環境、食品等各領域均表現出巨大的套用前景。在藥物研究領域,由於納米技術的不斷滲透和影響,引發了藥物領域一場深遠的革命,從而出現了納米藥物這一新名詞。納米藥物是指以納米級高分子納米粒(nano-particles,NP)、納米球 (nano.spheres NS)、納米囊(nano-capsules,NC)等為載體,與藥物以一定方式結合在一起後製成的藥物,其粒徑可能超過100nm,但通常應小於500nm。納米藥物也可以是直接將原料藥物加工製成的納米粒。 由於藥物作用於人,所以要求載藥材料無毒、生物相容性好、可生物降解。載藥材料分為兩大類:一類是天然材料如脂類、糖類、蛋白質等;另一類是合成的高分子材料 ,如聚氰基丙烯酸烷酯(PACA,包括甲酯、乙酯、丁酯、異酯 、己酯及異己酯、十六烷基酯)和聚酯 [主要有聚乳酸(PLA)、聚丙交酯 、聚己內酯(PCL)、聚己醇酯、聚羥丁酸、聚羥戊酸等]及其衍生物與共聚物。由這些材料製得的載藥納米粒主要有以下幾種。
納米脂質體(nanolilmsome)
 脂質體 (脂質小囊)是近年研究較多的一種劑型,它製備簡單,套用方便,可多用途給藥,是一種具有同生物膜性質類似的磷脂雙分子層結構載體。脂質體作為藥物載體有其獨特的優勢,包括可保護藥物免受降解 、達到靶向部位和減少毒副作用。但是它也存在許多缺陷,如包封率低、脂質體膜易破裂、藥物易滲漏 、重複性差、體內不穩定和釋藥快等。納米脂質體的製備方法主要有超聲分散法、逆相蒸發法等,張磊等用逆相蒸發一超聲法製備了胰島素納米脂質體,平均粒徑為 83.3nm,包封率78.5%。
脂質體 (脂質小囊)是近年研究較多的一種劑型,它製備簡單,套用方便,可多用途給藥,是一種具有同生物膜性質類似的磷脂雙分子層結構載體。脂質體作為藥物載體有其獨特的優勢,包括可保護藥物免受降解 、達到靶向部位和減少毒副作用。但是它也存在許多缺陷,如包封率低、脂質體膜易破裂、藥物易滲漏 、重複性差、體內不穩定和釋藥快等。納米脂質體的製備方法主要有超聲分散法、逆相蒸發法等,張磊等用逆相蒸發一超聲法製備了胰島素納米脂質體,平均粒徑為 83.3nm,包封率78.5%。 固體脂質納米粒(solid lipid nanoparticles,SLN)
SLN是以多種類脂材料如脂肪酸、脂肪醇及磷脂 等為載體,將藥物包裹於類脂材料中製成固體顆粒。SLN具有一定的緩釋作用,主要適合於難溶性藥物的包裹,被用作靜脈注射或局部給藥達到靶向定位和控釋作用的載體,能避免藥物的降解和泄漏。SLN主要適用於親脂性藥物,用於親水性藥物時存在包封率較低的缺陷。SLN常用高壓乳勻法和微乳法製備。楊時成等用高壓乳勻法研製的喜樹鹼固體脂質納米粒,其平均粒徑為196.8nm,載藥量為4.77%,包封率 為99.51%。由於植物中提取的喜樹鹼脂溶性高,製備理想的製劑較困難,而且用乳勻法製備的SLN還普遍存在藥物的突釋現象,其產生的主要原因是現有高壓乳勻法製備時的高溫和使用高濃度的表面活性劑。張惠宏等用溶劑擴散法製備了丙酸倍氯米松固體脂質納米粒,雖在最初3h台藥物的突釋現象但在隨後4d藥物的釋放明顯緩慢,每天釋放約為藥物總量的6%。實現了藥物的控釋 。納米囊和納米球
主要由聚乳酸、聚丙交酯一乙交酯、殼聚糖和明膠等能夠生物降解的高分子材料製備,可用於包裹米水性或疏水性藥物不同材料的性能適合於不同的給藥途徑,如靜脈注射的靶向作用、肌內或皮下注射的緩控釋作用,口服給藥的納米囊和納米球也可用非降解性材料.如乙基纖維素、丙烯酸樹脂等此類載體的製備方法主要有沉澱法 、乳化一溶劑揮發法等 Maria等一7以乳酸一羥基乙酸共聚物(PLA)為載體,用雙乳化一溶劑揮發法製備了載有L一門冬醯胺酶的納米球,在製備過程中採用超聲乳化技術將納米球粒徑控制在 200nm左右,包封率達40%:聚合物膠束
這是近幾年正在發展的一類新型的納米載體,它同時具有親水性基團及疏水性基團,在水中溶解後自發形成高分子膠束,並完成對藥物的增溶和包裹它具有親水性外殼及疏水性核心,適合於攜帶不同性質的藥物,且可使藥物能逃避單核巨噬細胞的吞噬,即具有“隱形”性 。親水鏈 段常用聚乙二醇(PEG)、聚氧乙烯(PEO)、聚氧丙稀等,而疏水鏈段常 用的有聚乳酸(P)、聚丙交酯一乙交酯、殼聚糖等目前研究較多的是PLA與PEG的嵌段共聚物PLA—PEG,而殼聚糖及其衍生物因其優良的生物降解特性正在受到密切關注等8一採用雙乳化法製備了粒徑200nm左右的載牛血清白蛋 白納米粒 ,所用材料為PLA—PEG雙親性共聚物,包封率達48.6%
用的有聚乳酸(P)、聚丙交酯一乙交酯、殼聚糖等目前研究較多的是PLA與PEG的嵌段共聚物PLA—PEG,而殼聚糖及其衍生物因其優良的生物降解特性正在受到密切關注等8一採用雙乳化法製備了粒徑200nm左右的載牛血清白蛋 白納米粒 ,所用材料為PLA—PEG雙親性共聚物,包封率達48.6% 納米藥物的套用
納米藥物的粒徑使它具有特殊的表面效應和小尺寸效應等,與常規藥物相比,它傾粒小、表面反應活性高 、活性中心多、催化效率高 、吸附能力強,因此它具有許多常規藥物不具備的優點,它的套用主要在如下方面作為生物大分子的載體 ,改善難溶性藥物的口服吸收
蛋白質 、多肽這類大分子藥物 口服後易被胃酸破壞,且在腸道中很容易發生蛋白水解,故難以透過腸壁被機體吸收,現在多採用注射給藥,但這常常使病人產生不適,且費用高昂。為此gunia—KubikK等將這一類的藥物與VitBl:共價結合.利用VitBl吸收的機制來促進藥物從腸道中達到血循環 ,從而促進丁其吸收。納米技術的套用則更好地解決這個問題,如將VitB ,或葉酸修飾過的納米粒再與藥物結合,不僅能避免藥物在腸道中發生蛋白水解,還能使藥物在體內循環時增加,從而大大增加了藥物的吸收度。納米載體可攜帶各種大分子藥物,可有口服、注射、吸入等多種給藥途徑
提高生物利用度,減少用藥量,減輕或消除毒副作用

 當藥物顆粒粒徑達到納米水平時,藥物的總表面積大大增加,藥物的溶出速率隨之提高,與給藥部位接觸面積增大,提高了單位面積藥物濃度。同時由於載藥納米粒較好的黏附性及小粒徑,藥物與吸收部位的接觸時間延長,增加了藥物在吸收部位上皮組織黏液層中的濃度,並延長了藥物的半衰期,因此提高了藥物的生物利用度。載藥納米粒子還可以改變膜運轉機制,增加藥物對生物膜的通透性,藥物有可能通過簡單擴散或滲透形式進入生物膜,使溶解度增加。此外,可 對藥物進行靶向引導,目標攻擊效率的提高會使用藥量減少,有可能使得人體對藥物的副反應減少到忽略不計的程度,從而在保證藥效的條件下有效減少藥物的毒副作用。眾所周知,阿黴素(DXR)作為一常用抗腫瘤藥因其較大的心臟毒性和骨髓抑制作用而限制了其套用、為減輕這種毒副作用,常將其與一些大分子物質如右鏇糖酐(DEX)相偶聯,但又因這種偶聯劑半衰期很短而使療效大為降低:Mitra等用微乳液法製備了DEX—DXR殼聚糖納米粒,直徑約為(100±10)nm,殼聚糖納米粒在體內具有較好的長循環特徵,利用EPR效應(enhanced permeability and retention ef—fect)可提高藥物對腫瘤組織的選擇性。將此納米粒對 J774A.1鼠巨噬細胞移植瘤鼠進行體外實驗,結果顯示 DEX—DXR殼聚糖納米粒的毒副作用明顯小於單純的DXR(鼠最大耐受劑量為16 mg·kg~,單純DEX 為 8 mg·kg ),且有效增加了DXR的抗腫瘤效應[腫瘤大小由(514±6)mm 減小到(170±7.3)m1,而單純DEX—DXR僅從(453.6±19.99)m1減d,N(284±11.5)mm ]。存活率升高(移植90d後為50%,單純DEX—DXR為25cX))。
當藥物顆粒粒徑達到納米水平時,藥物的總表面積大大增加,藥物的溶出速率隨之提高,與給藥部位接觸面積增大,提高了單位面積藥物濃度。同時由於載藥納米粒較好的黏附性及小粒徑,藥物與吸收部位的接觸時間延長,增加了藥物在吸收部位上皮組織黏液層中的濃度,並延長了藥物的半衰期,因此提高了藥物的生物利用度。載藥納米粒子還可以改變膜運轉機制,增加藥物對生物膜的通透性,藥物有可能通過簡單擴散或滲透形式進入生物膜,使溶解度增加。此外,可 對藥物進行靶向引導,目標攻擊效率的提高會使用藥量減少,有可能使得人體對藥物的副反應減少到忽略不計的程度,從而在保證藥效的條件下有效減少藥物的毒副作用。眾所周知,阿黴素(DXR)作為一常用抗腫瘤藥因其較大的心臟毒性和骨髓抑制作用而限制了其套用、為減輕這種毒副作用,常將其與一些大分子物質如右鏇糖酐(DEX)相偶聯,但又因這種偶聯劑半衰期很短而使療效大為降低:Mitra等用微乳液法製備了DEX—DXR殼聚糖納米粒,直徑約為(100±10)nm,殼聚糖納米粒在體內具有較好的長循環特徵,利用EPR效應(enhanced permeability and retention ef—fect)可提高藥物對腫瘤組織的選擇性。將此納米粒對 J774A.1鼠巨噬細胞移植瘤鼠進行體外實驗,結果顯示 DEX—DXR殼聚糖納米粒的毒副作用明顯小於單純的DXR(鼠最大耐受劑量為16 mg·kg~,單純DEX 為 8 mg·kg ),且有效增加了DXR的抗腫瘤效應[腫瘤大小由(514±6)mm 減小到(170±7.3)m1,而單純DEX—DXR僅從(453.6±19.99)m1減d,N(284±11.5)mm ]。存活率升高(移植90d後為50%,單純DEX—DXR為25cX))。 靶向和定位釋藥(targeting drug system,TDS)
藥物靶向性是指藥物能高選擇地分布於作用對象,從而增強療效,減少副作用。根據靶向機制的不同,靶向製劑包括被動靶向、主動靶向、物理化學靶向三大類
被動靶向是指通過減少藥物在非靶向部位的積聚從而增加靶部位的藥物濃度,即自然靶向。載藥納米粒進入體內後作為異物而被巨噬細胞吞噬,到達網狀內皮系統(RES)分布集中的肝、脾、肺、骨髓、淋巴等靶部位:對於靶向這些器官的藥物來說,這種被動靶向是有利的。但對於靶部位並非這些器官的藥物來說,這就大大降低了藥物的療效,並且增加了藥物的毒副作用這時就需要用主動靶向使藥物能直接到達靶部位,而不被RES所攝取。如抗腫瘤劑可直接作用於癌細胞而不影響正常細胞的功能,心血管用藥可直接用於治療部位而不再通過體循環引起全身反應。
主動靶向的方法主要是利用抗原一抗體或配體一受體結合 ,從而使藥物能到達特異性的部位。主動靶向的方法很早就開始套用於抗腫瘤治療,納米技術的加入更增加 了藥物的主動靶向性。冠脈成形術後再狹窄是一嚴重的併發症 ,主要是由血管平滑肌細胞(VSM—s)的增殖和遷移而引起。Lanza等利用對VSMCs表位具有特殊靶向性的納米粒子包載治療藥物進行體外實驗,結果顯示納米粒顯著抑制了VSMCs的增殖,且藥物持續釋放時間可達到1周。單克隆抗體較多運 用於主動靶向技術,在載體上連線特異性的單抗,使藥物到達期望到達的治療部位。Zhang等製備了含米托葸醌的納米粒,並連線有抗C—erbB一2單克隆抗體:免疫學實驗證實此單抗具生物學活性,體外實驗中能與SK—BR一3人乳腺癌細胞結合。其它一些被認為能與腫瘤發生特異結合的物質如生物素(VitH)、硫胺(VitB )、葉酸等也都能被套用於主動靶向技術。Na等製備了直徑約100nm、連線有 VitH的 PA納米 粒(BPA),用 RITC標記納米粒後進行螢光強度分析, 結果顯示 BPA 比一般 的 PA納米粒更易於被 HepG2 細胞吸收,且這種細胞靶向性與Vit H的量有關。
機體有許多天然的生物屏障保護著機體不受損害,如血腦屏障、血眼屏障、細胞生物膜屏障等,但這些 屏障的存在也給一些病變的治療帶來困難。靶向納米 藥物的套用則能使一些藥物透過上述屏障而到達特定的部位:有報導用聚氰基丙烯酸丁酯為載體製成DXR納米粒,用 Polysorbate一80修飾後能攜帶藥物透過血腦屏障。實驗證實將此種納米粒給顱內膠質細胞瘤荷瘤鼠注射後,藥物在腦內的濃度明顯提高,可達到6g·g,而對照組藥物(DXR溶劑、未經修飾DXR納米粒)腦內濃度小於0.1ttg·g 。此納米粒有效抑制了腫瘤的生長,80%的實驗鼠生存時間超過了半年, 而對照組 鼠在10~20 d內全部死亡。此項技術運用於臨床後有望能用藥物來治療一些目前不得不進行手術的疾病,使病人減輕痛苦,降低治療費用。
主動靶向的方法主要是生物靶向,除此以外還有物理 、化學靶向方法,這些方法主要包括熱導向、磁導向和PH導向等。納米技術結合熱療的新方法已引起廣泛重視,熱療能夠促進脂質體對腫瘤的特異性靶向。Kong等l1 6l研究了不同
 粒徑的納米粒在不同溫度下對SKOV-3卵巢癌移植瘤小鼠的不同作用,結果顯示熱 療(42℃)能明顯增加腫瘤血管的滲透性,使納米粒外滲到腫瘤間質量大大增加。他認為其機制可能是腫瘤血管的通透性要比正常組織高,因為其血管內皮上存 在有孔徑結構,在體溫正常時孔徑大小約為7~100nm,故大於100 nin的納米粒均不能透過腫瘤血管 ;而熱療使這些孔徑的直徑大大增加,使得 400 nm大小的 納米粒也能外滲到腫瘤組織間隙,從而增加了脂質體對腫瘤的靶向性。也有學者發現用磁性脂質體結合熱療以後能誘導 TNF—a基因的表達,從而發揮抑腫 的最新進展,在外加磁場作用下可引導負載物質在體內定向移動、聚集。磁性微粒有獨特的小尺寸效應和界面效應,在體內可逃過吞噬細胞的吞噬,通過其結合的配體的選擇性進一步定位於腫瘤細胞而發揮主動靶向作用、協同磁導向作用,可完成對靶部位的選擇性導 入。
粒徑的納米粒在不同溫度下對SKOV-3卵巢癌移植瘤小鼠的不同作用,結果顯示熱 療(42℃)能明顯增加腫瘤血管的滲透性,使納米粒外滲到腫瘤間質量大大增加。他認為其機制可能是腫瘤血管的通透性要比正常組織高,因為其血管內皮上存 在有孔徑結構,在體溫正常時孔徑大小約為7~100nm,故大於100 nin的納米粒均不能透過腫瘤血管 ;而熱療使這些孔徑的直徑大大增加,使得 400 nm大小的 納米粒也能外滲到腫瘤組織間隙,從而增加了脂質體對腫瘤的靶向性。也有學者發現用磁性脂質體結合熱療以後能誘導 TNF—a基因的表達,從而發揮抑腫 的最新進展,在外加磁場作用下可引導負載物質在體內定向移動、聚集。磁性微粒有獨特的小尺寸效應和界面效應,在體內可逃過吞噬細胞的吞噬,通過其結合的配體的選擇性進一步定位於腫瘤細胞而發揮主動靶向作用、協同磁導向作用,可完成對靶部位的選擇性導 入。 藥物靶向性包括靶器官、靶細胞到最為先進的細胞內靶結構,而這3級靶向治療的方法均可通過納米控釋系統得以完成。在基因治療中必須要達到最高的第3層次,即基因治療必須靶向於細胞核。基因治療的主要過程是將正常的基因或經修復的基因導向靶部位,來替代原來體內異常的基因。這種療法從根本上消除了病因,而不像大多數傳統的藥物只是治療症狀。基因治療在許多疾病如癌症、感染、心血管病、單基因病(如血友病等)、風濕性關節炎等治療中有良好的套用前景。納米技術在基因治療方面的套用,主要是以納米粒子作為非病毒性基因載體替代傳統的病毒性載體,從而消除了病毒性載體潛在的危險性。此外,在DNA疫苗這一研究領域,納米粒子也有巨大的套用前景。有報導以殼聚糖納米粒作為載體替代傳統的病毒,它可將質粒DNA製成片劑、乳劑、凝膠,可有各種給藥途徑如皮內針注射、基槍注射等,從而改善了傳統的DNA疫苗只能行肌肉注射的限制。 藥物控釋
控制釋放給藥系統(controlled release drug deliv—ery system,CRDDS)是指通過物理、化學等方法改變製劑結構 ,使藥物在預定時間內主動按某一速度從制 劑中恆速釋放於作用器官或特定靶組織,並使藥物濃度較長時間維持在有效濃度內的一類製劑,即具備緩釋、控釋兩大特性。這兩種特性可克服普通製劑的“峰谷”現象,使體內藥物濃度保持平穩,減少給藥次數,提高藥效和安全度。

納米藥物要實現緩釋,延長體內的循環時間,可通過表面修飾來改變微粒 的表面性質,以達到長循環的效果:納米粒表面的親水性與親脂性將影響到納米粒與調理蛋白的吸附結合力的大小,從而影響到吞噬細胞對其吞噬的快慢。一般而言,納米粒的表面親脂性越大,其對調理蛋白的結合力越強,故要延長納米粒在體內的循環時間需增加其表面的親水性,這是對納米粒進行表面修飾時選擇材料的一個必要條件。常用表面活性劑主要是 poloxamer/poloxamine、polymrbates (聚山梨醇酯 )、lmlyoxyethyiencether等_l 。納米粒的表面電荷影響到納米粒與體內物質如調理素等的靜電作用力,負電荷表面往往使納米粒相對於正電荷或中性表面在體內更易被清除,而中性表面更適合於延長納米粒在體內的循環時間,故常用非離子表面活性劑。這類非離子表面活性劑包衣納米粒長循環的機制被認為是不帶電荷,親水表面的包衣層以及聚合物的立體排阻效應,有效地阻斷了巨噬細胞對納米粒的吞噬過程親水性的包衣能減少納米粒對血中成分的吸附,從而降低血漿蛋白的調理作用。表面活性劑吸附層度增加使吞噬細胞的吞噬功能下降,一般認為表面層的厚度大於10nm 能有效發揮空間位阻作用l20]。抗腫瘤藥紫杉醇用於臨床注射常很困難,因為它水溶性很差 ,故常需使用佐劑,但這樣又會引起很大的副作用。有學者將紫杉醇製成兩種硬脂酸SLN:Brij78一SL 、F68一SLN,其直徑分別在100nm和200nm左右:測得其24 h藥物釋放緩慢且呈線性,分別為總量的8%和24%,並且藥物在血液循環中具長循環性。親水性材料用於控釋藥物運輸之後,許多聚合物賦行物也被用來研究控制藥物釋放,如愛蘭苔膠能控制藥物從親水性材料中釋放的速率。
納米中藥的研究
近年來 ,納米技術在我國傳統的中藥研究和套用中已開始受到廣泛重視,並誕生了納米中藥這一新概念,在採用納米技術製造的中藥有效成分、有效部位 、原藥、複方和新型製劑等方面已取得 了一定的進展。徐輝碧等研究了不同粒徑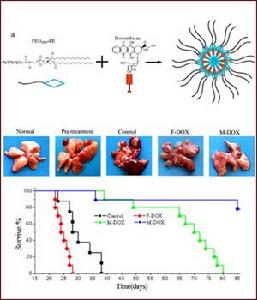 的石決明(納米 、微米、常態)的血清微量元素變化,結果顯示處於納米狀態(≤100nm)的石決明其性質與微米粒徑比較有極顯著的差異。他們還研究了不同粒徑(≤100 nm、200nm、500nm)的雄黃顆粒對小鼠肉瘤S180的抑制作用,結果示100nm及200nm的雄黃對腫瘤細胞的毒殺作用明顯強於500 nm的雄黃,不同粒徑(≤100nm、150nm、200nm、500nm)的雄黃顆粒對人臍靜脈內皮細胞系EV一304的存活率及誘導凋亡作用也存在明顯的尺寸效應。張東生等將中藥砒霜(As203)製備成砒霜磁性納米微球,微球粒徑 80~140 nm,藥物微球的中心為一磁性微載體,外有用明膠包覆的As203,此種新型中藥運載系統可通過區域或介入途徑對實體瘤進行治療,因此克服了目前As203 注射液不適宜治療實體瘤的缺陷。不僅如此,砒霜磁性納米微球還具有磁導向功能及有待開發的磁感應控溫加熱治療作用。以上研究表明,納米技術的發展已為我國傳統中藥的研究帶來了新的契機和方法 。
的石決明(納米 、微米、常態)的血清微量元素變化,結果顯示處於納米狀態(≤100nm)的石決明其性質與微米粒徑比較有極顯著的差異。他們還研究了不同粒徑(≤100 nm、200nm、500nm)的雄黃顆粒對小鼠肉瘤S180的抑制作用,結果示100nm及200nm的雄黃對腫瘤細胞的毒殺作用明顯強於500 nm的雄黃,不同粒徑(≤100nm、150nm、200nm、500nm)的雄黃顆粒對人臍靜脈內皮細胞系EV一304的存活率及誘導凋亡作用也存在明顯的尺寸效應。張東生等將中藥砒霜(As203)製備成砒霜磁性納米微球,微球粒徑 80~140 nm,藥物微球的中心為一磁性微載體,外有用明膠包覆的As203,此種新型中藥運載系統可通過區域或介入途徑對實體瘤進行治療,因此克服了目前As203 注射液不適宜治療實體瘤的缺陷。不僅如此,砒霜磁性納米微球還具有磁導向功能及有待開發的磁感應控溫加熱治療作用。以上研究表明,納米技術的發展已為我國傳統中藥的研究帶來了新的契機和方法 。