簡介
 核糖體
核糖體核糖體可在mRNA上移動。
結構
核糖體無膜結構,主要由蛋白質(40%)和RNA(60%)構成。核糖體按沉降係數分為兩類,一類(70S)存在於細菌等原核生物中,另一類(80S)存在於真核細胞的細胞質中。他們有的漂浮在細胞內,有的結集在一起。
發展歷史
在1953年由Ribinson和Broun用電鏡觀察植物細胞時發現胞質中存在一種顆粒物質。1955年Palade在動物細胞中也看到同樣的顆粒,進一步研究了這些顆粒的化學成份和結構。1958年Roberts根據化學成份命名為核糖核蛋白體,簡稱核糖體,又稱核蛋白體。核糖體除哺乳類成熟的紅細胞外,一切活細胞(真核細胞、原核細胞)中均有,它是進行蛋白質合成的重要細胞器,在快速增殖、分泌功能旺盛的細胞中尤其多。其主要成分為RNA和蛋白質,是合成蛋白質的場所。
核糖體蛋白
 核糖體
核糖體大腸桿菌核糖體的30S亞基含S1—S21共21種蛋白質,50S亞基含L1—L31共31種蛋白質。這些蛋白質已被全部分離純化。分子量約1萬到3萬。除S6、L7、L12之外全是鹼性蛋白質。這些蛋白質是免疫學上獨立的蛋白質,只有L7、L12顯示出相互交叉反應。已知L7與L12是同一蛋白質,L7的N末端被乙醯化。已經確定了幾種蛋白的一級結構。機能已經明確的蛋白質如下述:
S1:與蛋白質合成的i因子(干擾因子)和Qβ複製酶的亞基Ⅰ為同一物質,可與mRNA結合;
S4:ram(核糖體的雙關性ribosomalambiguity)基因的產物;
S5:SPc〔壯觀黴素(Spectinomycin)抗性〕基因的產物;
S12:str(鏈黴素抗性)基因的產物;
L7、L12:有和多肽鏈延長因子Tu及G間的相互作用,也有和起始因子和終止因子的相互作用。
L11:肽基轉移酶。
組裝
 核糖體
核糖體真核細胞的核糖體的大小亞基是在核中形成的,在核仁部位rDNA經RNA聚合酶Ⅰ轉錄出45SrRNA(纖維部的纖維狀物質),是rRNA的前體分子,與胞質運來的蛋白質結合形成RNP複合體,45SrRNA甲基化以後經RNA酶裂解為2個分子,18SrRNA和32SrRNA,後者再裂解為28SrRNA的5.8SrRNA。成熟的rRNA僅為45SrRNA的一半,丟失的大部分是非甲基化和GC含量較高的區域。5SrRNA的基因並不定位在核仁上,通常定位在常染色體,5SrRNA在核仁外經RNA聚合酶Ⅲ合成後被轉運至核仁區參與大亞基的裝配。28S,5.8S及5SrRNA與蛋白質結合,形成RNP分子團。為大亞基前體,分散在核仁顆粒區,再加工成熟後,經核孔入胞質為大亞基,18SrRNA也與蛋白質結合,經核孔入胞質為小亞基。(圖:核糖體的組裝)大小亞基在胞質中可解離存在,但在需要時可在Mg4<0.001M存在時,合成完整單核糖體,此時才具有合成功能,當Mg4<0.001M時則又重新解離。
與rRNA或核糖體亞基結合的蛋白質有二類:一類與rRNA或核糖體亞基緊密連線,需高濃度鹽和強解離劑(如3mol/LLiCl或4mol/L尿素)才能將其分離,這類蛋白質稱為"真"核糖體蛋白質("realribosomalproteins")或簡稱為核糖體蛋白質。如E.coli30S亞基上的21種蛋白質及50S亞基上的34種蛋白質(共54種,因為小亞基上的S20與大亞基上的L26是相同);或者在真核細胞40S亞基上的30種蛋白質及60S亞基上的45-50種蛋白質(共約80種),即屬此類。而另一類蛋白質則為與有功能的核糖體亞基疏鬆締合,能被0.5mol/L單價陽離子(如K+,NH4+)從亞基上洗脫,並對核糖體循環發揮調節作用的蛋白質,如起始因子(IF或eIF)和延長因子(EF)等,稱為核糖體相關蛋白質(proteinsassociatedwithribosome;簡稱PAR)。PAR不是構成核糖體的固有成分。
分類
 核糖體
核糖體可分為三種類型:細胞質核糖體、線粒體核糖體、葉綠體核糖體。
生物類型
可分為兩種類型:真核生物核糖體和原核生物核糖體。
原核細胞的核糖體
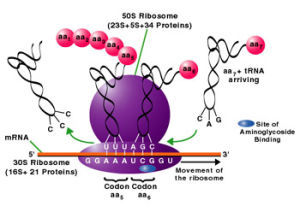
原核細胞的核糖體較小,沉降係數為70S,相對分子質量為2.5MDa,由50S和30S兩個亞基組成;而真核細胞的核糖體體積較大,沉降係數是80S,相對分子質量為3.9~4.5MDa,由60S和40S兩個亞基組成。典型的原核生物大腸桿菌核糖體是由50S大亞基和30S小亞基組成的。在完整的核糖體中,rRNA約占2/3,蛋白質約為1/3。50S大亞基含有34多肽鏈和兩種RNA分子,相對分子質量大的rRNA的沉降係數為23S,相對分子質量小的rRNA為5S。30S小亞基含有21多肽鏈和一個16S的rRNA分子。
真核細胞的核糖體
真核細胞中,核糖體進行蛋白質合成時,既可以游離在細胞質中,稱為游離核糖體(freeribosome)。也可以附著在內質網的表面,稱為膜旁核糖體或附著核糖體。參與構成RER,稱為固著核糖體或膜旁核糖體,是以大亞基圓錐形部與膜接著游離核糖體(freeribosome)。分布線上粒體中的核糖體,比一般核糖體小,約為55S(35S和25S大、小亞基),稱為胞器或線粒體核體。凡是幼稚的、未分化的細胞、胚胎細胞、培養細胞、腫瘤細胞,它們生長迅速,在胞質中一般具有大量游離核糖體。真核細胞含有較多的核糖體,每個細胞平均有106~107個,而原核細胞中核糖體較少每個細胞平均只有15×102~18×103個。真核細胞核糖體的沉降係數為80S,大亞基為60S,小亞基為40S。在大亞基中,有大約49種蛋白質,另外有三種rRNA∶28SrRNA、5SrRNA和5.8SrRNA。小亞基含有大約33種蛋白質,一種18S的rRNA。
無論哪種核糖體,在執行功能時,即進行蛋白質合成時,常3-5個或幾十個甚至更多聚集並與mRNA結合在一起,由mRNA分子與小亞基凹溝處結合,再與大亞基結合,形成一串,稱為多聚核糖體(游離多聚核糖體及固著多聚核糖體),Polyribosome或Polysome。mRNA的長短,決定多聚核糖體的多少,可排列成螺紋狀,念珠狀等,多聚核糖體是合成蛋白質的功能團。此時,每一核糖體上均在以mRNA的密碼為模板,翻譯成蛋白質的胺基酸順序。在活細胞中,核糖體的大小亞基,單核糖體和多聚核糖體是處於一種不斷解聚與聚合的動態平衡中,隨功能而變化,執行功能量為多聚核糖體、功能完成後解聚為大、小亞基。
按在細胞中的分布分類
可分為游離核糖體和附著核糖體。
游離核糖體位於細胞質基質中,主要合成結構性蛋白(內源性蛋白);
附著核糖體主要附著在粗面內質網(RER)上,負責合成膜蛋白和水溶性蛋白(分泌蛋白、膜蛋白、溶酶體蛋白、駐留蛋白)。
測定技術
自六十年代以來,人們運用化學、物理學和免疫學方法,主要對E.coli核糖體進行了大量的研究,完成了對E.coli核糖體54種蛋白質胺基酸序列及三種rRNA一級和二級結構的測定,初步認識了核糖體顆粒的基本建造(architecture)。這些技術主要包括:
⑴電子顯微鏡術(EM);
⑵免疫學方法;
⑶中子衍射技術(neuton scattering);
⑷雙功能試劑交聯法;
⑸不同染料間單態-單態能量轉移(singlet-singlet energytransfer)測定
⑹活性核糖體顆粒重建等方法。
超微結構
非膜相結構,大小10-20nm,可單個或成群分布於細胞質中,也可附著在核外膜、內質網上,或存在於線粒體、葉綠體中,用負染色高分辨電鏡觀察,核糖體不是圓形顆粒,而是由大、小兩個亞基組成的不規則顆粒。
大亞基側面觀是低面向上的倒圓錐形,底面不是平的,邊緣有三個突起,中央為一凹陷,似沙發的靠背和扶手。小亞基是略帶弧形的長條,一面稍凹陷,一面稍外突,約1/3處有一細縊痕,將其分成大小兩個不等部份。小亞基趴在大亞基上,似沙發上趴了一隻小猴。大小亞基凹陷部位彼此對應相結合,就形成了一個內部空間。此部位可容納mRNA、tRNA及進行胺基酸結合等反應。
此外,在大亞基內有一垂直的通道為中央管,所合成的多肽鏈由此排放,以免受蛋白酶的分解。一般真核細胞中,10的6次方到7次方個/細胞,原核細胞中15-18×10的三次方個/細胞,蛋白質合成旺盛的細胞可達1×10的12次方個/細胞。
理化特性
 核糖體
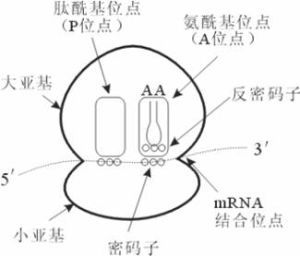
核糖體單個核糖體上存在四個活性部位,在蛋白質合成中各有專一的識別作用。
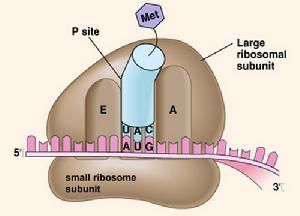
1.A部位:胺基酸部位或受位:主要在大亞基上,是接受氨醯基-tRNA的部位。
2.P部位:肽基部位或供位:主要在小亞基上,是釋放tRNA的部位。
3.肽基轉移酶部位(肽合成酶),簡稱T因子:位於大亞基上,催化胺基酸間形成肽鍵,使肽鏈延長。
4.GTP酶部位:即轉位酶(EF-G),簡稱G因子,對GTP具有活性,催化肽鍵從供體部位→受體部位。
另外,核糖體上還有許多與起始因子、延長因子、釋放因子以及各種酶相結合的位點。核糖體的大小是以沉降係數S來表示,S數值越大、顆粒越大、分子量越大。原核細胞與真核細胞核糖體的大小亞基是不同的。
50S(大亞基)23S,5SRNAS+原核(70S)34種蛋白質55種蛋白質30S(小亞基)21種蛋白質+16SRNA
真核(80S)60S(大亞基)28S5.8S5SRNA+45種蛋白質78種蛋白質40S(小亞基)33種蛋白質,+18SRNA
生物合成
新聞背景:三位科學家因核糖體研究獲諾貝爾化學獎
2009年10月7日,瑞典皇家科學院在斯德哥爾摩宣布,英國劍橋大學科學家文卡特拉曼·拉馬克里希南、美國科學家托馬斯·施泰茨和以色列科學家阿達·約納特因“對核糖體結構和功能的研究”而共同獲得2009年諾貝爾化學獎。這是瑞典皇家科學院在斯德哥爾摩舉行的新聞發布會上展示3位科學家的照片。
生命體就像一個極其複雜而又精密的儀器,不同“零件”在不同崗位上各司其職,有條不紊。而這一切,就要歸功於仿佛扮演著生命化學工廠中工程師角色的“核糖體”:它翻譯出DNA所攜帶的密碼,進而產生不同的蛋白質,分別控制人體內不同的化學過程。
諾貝爾獎評選委員會7日介紹說,三位科學家文卡特拉曼·拉馬克里希南、托馬斯·施泰茨和阿達·約納特因“對核糖體的結構和功能的研究”而獲得今年的諾貝爾化學獎。
DNA(脫氧核糖核酸)是核酸的一類,因分子中含有脫氧核糖而得名。生物體中的每一個細胞里,都有DNA分子,它們對於無論是一個人還是一棵植物或者一個細菌而言,都至關重要,因為這些DNA分子決定了生命體的外貌及功能。DNA是幾乎所有生物的遺傳物質基礎,它存儲了大量的“指令”信息,能引導生物的發育和生命機能的運作。但是在生命體中,DNA所含有的指令就像一張寫滿密碼的圖紙,只有經核糖體的翻譯,每條指令才能得到明確無誤的執行。
具體而言,核糖體的工作,就是將DNA所含有的各種指令翻譯出來,之後生成任務不同的蛋白質,例如用於輸送氧氣的血紅蛋白、免疫系統中的抗體、胰島素等激素、皮膚的膠原質或者分解糖的酶等等。人體內有成千上萬種蛋白質,它們各自擁有不同的形式與功能,在化學層面上構建並控制著生命體。
諾貝爾獎評審會介紹,三位科學家都採用了X射線蛋白質晶體學的技術,標識出了構成核糖體的成千上萬個原子。這些科學家們不僅讓我們知曉了核糖體的“外貌”,而且在原子層面上揭示了核糖體功能的機理。“認識核糖體內在工作的機理,對於科學理解生命非常重要。這些知識可以立刻套用於實際。”
基於核糖體研究的有關成果,可以很容易理解,如果細菌的核糖體功能得到抑制,那么細菌就無法存活。在醫學上,人們正是利用抗生素來抑制細菌的核糖體從而治療疾病的。評審會說,三位科學家構築了三維模型來顯示不同的抗生素是如何抑制核糖體功能的,“這些模型已被用於研發新的抗生素,直接幫助減輕人類的病痛,拯救生命”。
抗體是由核糖體合成
蛋白質合成的細胞內定位
核糖體的功能就是將mRNA上的遺傳密碼(核苷酸順序)翻譯成多肽鏈上的胺基酸順序。因此,它是肽鏈的裝配機,即細胞內蛋白質合成的場所,細胞合成的蛋白質可分為兩類:外輸性蛋白和內源性蛋白。
1.外輸性蛋白:主要在固著核糖體上合成,分泌到細胞外發揮作用,如抗體蛋白、蛋白類激素、酶原、唾液等,也能合成部份自身結構蛋白,如膜嵌入蛋白、溶酶體蛋白。
2.內源性蛋白:又稱結構蛋白,是指用於細胞本身或組成自身結構的蛋白質,主要是在游離核糖體上合成,如紅細胞中的血紅蛋白,肌細胞中的肌纖維蛋白。
蛋白質生物合成的簡要過程
蛋白質生物合成是一個複雜而重要的生命活動,它在細胞中有粗細的結構基礎,進行得十分迅速有效,是依靠分子水平上的嚴密組織和準確控制進行的。
蛋白質合成不僅要有合成的場所,而且還必須有mRNA、tRNA、20種胺基酸原料和一些蛋白質因子及酶。Mg、K+離子等參與,並由ATP、GTP提供能量,合成中mRNA是編碼2合成蛋白質的模板,tRNA是識別密碼子,轉運相應胺基酸的工具。核糖體則是蛋白質的裝配機,它不僅組織了mRNA和rRNA的相互識別,將遺傳密碼翻譯成蛋白質的胺基酸順序,並且控制了多肽鏈的形成。
合成過程
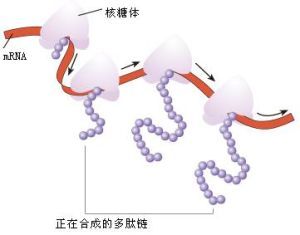 核糖體
核糖體階段在胞質中進行,胺基酸本身不認識密碼,自己也不會到核糖體(Ribosome)上,須靠tRNA。
胺基酸+tRNA→→氨基醯tRNA複合物
每一種胺基酸均有專一的氨基醯-tRNA合成酶催化,此酶首先激活胺基酸的羥基,使它與特定的tRNA結合,形成氨基醯tRNA複合物。所以,此酶是高度專一的,能識別並反應對應的胺基酸與其tRNA,而tRNA能以反密碼子識別密碼子,將相應的胺基酸轉運到核糖體上合成肽鏈。
在多聚核糖體上的mRNA分子上形成多肽鏈
胺基酸在核糖體上的聚合作用,是合成的主要內容,可分為三個步驟:
⑴多肽鏈的起始:mRNA從核到胞質,在起始因子和Mg的作用下,小亞基與mRNA的起始部位結合,甲硫氨醯(蛋氨酸)—tRNA的反密碼子,識別mRNA上的起始密碼AuG(mRNA)互補結合,接著大亞基也結合上去,核糖體上一次可容納二個密碼子(原核生物中為甲醯甲硫氨醯)。
⑵多肽鏈的延長:第二個密碼對應的氨醯基—tRNA進入核糖體的A位,也稱受位,密碼與反密碼的氫鍵,互補結合。在大亞基上的多肽鏈轉移酶(轉肽酶)作用下,供位(P位)的tRNA攜帶的胺基酸轉移到A位的胺基酸後並與之形成肽鍵(—CO-NH—),tRNA脫離P位並離開P位,重新進入胞質,同時,核糖體沿mRNA往前移動,新的密碼又處於核糖體的A位,與之對應的新氨基醯-tRNA又入A位,轉肽鍵把二肽掛於此胺基酸後形成三肽,ribosome又往前移動,由此漸進漸進,如此反覆循環,就使mRNA上的核苷酸順序轉變為胺基酸的排列順序。
注意:P位(供位):供tRNA;供肽鏈
A位(受位):受胺基酸-tRNA;受肽鏈核苷酸與胺基酸相連繫的橋樑是tRNA。
⑶多肽鏈的終止與釋放:肽鏈的延長不是無限止的,當mRNA上出現終止密碼時(UGA,U胺基酸和UGA),就無對應的胺基酸運入核糖體,肽鏈的合成停止,而被終止因子識別,進入A位,抑制轉肽酶作用,使多肽鏈與tRNA之間水解脫下,順著大亞基中央管全部釋放出,離開核糖體,同時大小亞基與mRNA分離,可再與mRNA起始密碼處結合,也可游離於胞質中或被降解,mRNA也可被降解。
這是在一個核糖體上胺基酸聚合成肽鏈,每一個核糖體一秒鐘可翻譯40個密碼子形成40個胺基酸肽鍵,其合成肽鏈效率極高。可見,核糖體是肽鏈的裝配機。
合成的若是結構蛋白,則這些多肽便經過某些修飾、剪接後形成四級結構,投入使用,若是輸出蛋白呢?
我們知道分泌蛋白質是先存在於內質網腔中,後經高爾基體排出,胞吐外排,那么,合成的輸出蛋白是怎樣進入內質網腔的呢?
信號學說
與膜結合的核糖體和游離核糖體在性質上是一樣的,那這種核糖體為什麼會結合到粗面內質網膜上呢?新肽鏈又是怎樣進入RER囊腔的呢?信號學說闡明了固著核糖體上合成蛋白質的特殊性,該學說的基本要點。
⑴分泌蛋白質多肽的合成一開始也在游離多聚核糖體上,但其mRNA在AUG之後有一段45-90bp的信號順序(密碼),由此能翻譯出15-30個胺基酸的多肽(信號肽)SignalPeptide。這種能合成信號肽的核糖體將成為附著核糖體與內質網結合,不能合成信號肽的為游離核糖體,仍散布於胞質中。
⑵近幾年的研究發現,胞質中存在著信號識別顆粒(SignalRecognitionParticle,SRP),它既能識別露出核糖體之外的信號肽,又能識別RER膜上的SRP受體,只有當核糖體出現信號肽時,SRP才與核糖體的親和力增高。
⑶SRP與核糖體一結合,便以tRNA的構型占據了核糖體的“A”位,使核糖體的蛋白質合成暫時停止。
⑷SRP-核糖體複合體與RER上的SRP受體結合核糖體則以大亞基結合於RER上的嵌入蛋白(核糖體結合蛋白Ⅰ和Ⅱ),所以SRP受體又稱停泊蛋白或船塢蛋白(dockingprotein),SRP與SRP受體結合是暫時的,當核糖體附著於內質網膜後,SRP便離去,核糖體結合蛋白只存在於RER上。
⑸信號肽由疏水性胺基酸構成,當能合成信號肽的核糖體與內質網膜結合後,信號肽便經由內質網膜插入膜腔內,(內質網膜中2-多個識別信號肽的受體蛋白側向移動,集中在一起形成臨時性管道與中央管相連線),而先前處於暫停白質合蛋白質合成活動又重新開始。進入內質網腔的信號肽將與之相連的新生肽鏈引入內質網腔。信號肽便被位於內質網內表面的信號肽酶切掉,核糖體繼續合成肽鏈,肽鏈不斷延長,並在內質網腔中保護不被破壞並在網腔中形成具有一定空間構型的蛋白質,當合成終止,受體蛋白重新分散,肽鏈從核糖體脫下,核糖體大小亞基離開,所以,固著核糖體與RER的結合不是結構性的,而是特異性、暫時性、功能性的。
所以,如信號順序發生改變,所合成的信號肽不能被受體識別,核糖體就結合不到膜上。
功能抑制
電鏡下,多聚核糖體的解聚和粗面內質網的脫粒都可看作是蛋白質合成降低或停止的一個形態指標。
多聚核糖體的解聚:是指多聚核糖體分散為單體,失去正常有規律排列,孤立地分散在胞質中或附在粗面內質網膜上。一般認為,游離多聚核糖體的解聚將伴隨著內源性蛋白質生成的減少。脫粒是指粗面內質網上的核糖體脫落下來,分布稀疏,散在胞質中,RER上解聚和脫離將伴隨外輸入蛋白合成。
正常情況下,蛋白質合成旺盛時,細胞質中充滿多聚核糖體,RER上附有許多念珠線狀和螺鏇狀的多原核糖體,當細胞處於有絲分裂階段時,蛋白質合成明顯下降,多聚核糖體也出現解聚原C,逐漸為分散孤立的單體所代替。
在急性藥物中毒性(四氯化碳)肝炎和病毒性肝炎後,以及肝硬化病人的肝細胞中,經常可見到大量多聚核糖體解聚呈離散單體狀,固著多聚核糖體脫落,分布稀疏,導致分泌蛋白合成,所以,病人血漿白蛋白含量。
另外,一些藥物,致癌物可直接抑制蛋白質合成的不同階段,有些抗菌素,如鏈黴素、氯黴素、紅黴素等對原核與真核生物的敏感性不同,能直接抑制細菌核糖體上蛋白質的合成作用。有的抑制在起始階段,有的抑制肽鏈延長和終止階段,有的阻止小亞基與mRNA的起始結合,四環素抑制氨基醯-tRNA的結合和終止因子,氯黴素抑制轉肽酶,阻止肽鏈形成,紅黴素抑制轉位酶,不能相應移位進入新密碼。所以,抗菌素的抗菌作用就是干擾了細菌蛋白合成而抑制細菌生長來起作用的。
1.核糖體的結構特點——暫時的、功能的動態結構。
2.核糖體種類與合成蛋白質種類的關係。
3.留下思考題:核糖體合成的蛋白質之去向(與內膜系統聯繫)。
核糖體不是由生物膜構成的,它是由蛋白質和RNA構成的複合體。由大小兩個亞基組成。核糖體是蛋白質合成的場所。附著在內質網上的核糖體合成的蛋白質主要有兩類:一類是分泌蛋白,通過內質網運輸到高爾基體,經加工包裝後被分泌到細胞外;另一類是排列到質膜內的蛋白質。游離的核糖體合成的蛋白質一般是分布到細胞質基質中的蛋白質,如分布於細胞質基質中的酶等。
化學藥劑師如今已可以利用細菌與真核生物(如人類)細胞中核糖體結構的差異來提取或合成能抵抗細菌感染而不損傷受感染者自身細胞的抗生素(如氨基糖苷類抗生素、四環素類抗生素等蛋白質合成抑制劑類抗生素),這類抗生素能抑制感染患者的病原體微生物的細胞內的蛋白質合成。基於70S核糖體與80S核糖體結構上的不同,細菌細胞中的70S核糖體較容易受到某些抗生素的損害而真核細胞中的80S核糖體卻可以不受影響。雖然一些真核生物的線粒體中也含有類似細菌核糖體的70S核糖體,但線粒體擁有具有一定選擇透過性、使這些抗生素不能隨意透過的雙層磷脂雙分子膜,所以這些細胞器也可以避免該類抗生素對其中核糖體的影響。
生物化學術語(一)
| 我們學習了很多的生物化學的專業術語。現在,我把它們都整理在一起,可以使我們更加全面、完整的學習,認識,了解它們。 |

