流行病學
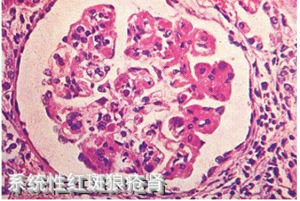
 系統性紅斑狼瘡性腎炎
系統性紅斑狼瘡性腎炎病因
SLE病因尚未闡明,多數學者認為是有一定遺傳特徵的個體。在多種觸發因素(如感染理化環境因素)作用下,發生免疫紊亂所致的自身免疫性損傷,LN具有明顯的免疫複合物性腎炎特徵。遺傳因素
遺傳流行病學資料發現SLE具有家族聚集傾向,同卵雙生子SLE發病一致率達25%——70%,明顯高於異卵雙生子(2%——9%)。本病患者近親發病率也高,國外報導12%SLE患兒近親中患有同類疾病,其他自身免疫性疾病發病率也高於人群總發病率。但大量的遺傳病學研究分析,證實SLE是多基因遺傳,位於第6對染色體中的多個基因位點與發病有關,尤其是遺傳性補體基因缺陷(C1r,C1s,C2及C4等早期補體成分缺陷)。人類白細胞抗原(HLA)基因(HLA-B8、BWl5、DR2、DR3)T細胞表面抗原受體(TCR)基因、免疫球蛋白基因等經典免疫應答基因的多態性也與罹患SLE有關。其中日本人、中國人HLA-DR2位點頻率增高,西歐血統白人HLA-DR2和(或)DR3位點頻率增高中國南方漢人SLE發病與DRBl*0301及DQBl*0608有關,美國黑人與DRB1*1503,DQAl*0102和DQBJ*0602有關。但其他人群研究未發現HLA-Ⅱ類基因與SLE發病有如此相關性。進一步研究發現某些HLA-Ⅱ類基因位點多態性與SLE患者產生自身抗體有關,尤其是不同HLA-DQ等位基因所共有的多態性序列可能導致某種自身抗體的產生。如含高水平dsDNA抗體患者中,96%具有HLA-A-DQBl*0201(與HL,A-DR3和DR7連鎖),DQBl*0602(與DR2和DRw6連鎖)或DQBl*0302(與HLA-DR4單體型連鎖)等位基因。另一些人發現抗心磷脂抗體陽性的SLE患者與HLA-DQBl*0301(DQW7)、*0302(DQW8)、*0303(DQW9)、*0602(DQW6)等位基因密切相關。因此推測SLE患病基因位於MHC區域,與HI,A-Ⅰ類、Ⅱ類基因呈連鎖不平衡性。
正常情況下補體成分在免疫複合物的固定和有效清除中起著關鍵作用,這些成分因遺傳基因缺陷而缺乏時,將導致免疫複合物在腎臟沉積而得病。但資料表明補體缺陷在SLE中並不多見,且補體缺陷者腎病變也常不嚴重,臨床表現不典型,累及男孩多,因此它不代表多數SLE的發病特徵,同時表明致SLE的遺傳基因肯定具有多種複雜特徵。
環境與感染因素
 系統性紅斑狼瘡性腎炎
系統性紅斑狼瘡性腎炎(2)藥物或化學物質:某些藥物可促使SLE患者光過敏,如磺胺藥四環素;有些藥物可誘發產生自身抗體如普魯卡因胺、肼苯達嗪等;有些香料、染料、染髮水,煙火燻烤食品、菌類也可誘發SLE。有人認為這藥物或化學物質與細胞核蛋白結合後,發生抗原性變性,也是引發機體自身免疫損傷的重要原因。
(3)感染:感染誘發SLE也研究較多。近年資料發現人類免疫缺陷病毒(HIV)感染者可發生SLE;感染單純性皰疹病毒可引起患者血清Sm抗原濃度升高;SLE患者血清中常見多種病毒抗體滴度增加(如風疹、EB病毒、流感、麻疹等),尤其是C型RNA病毒。
3.內分泌因素:SLE患者多數為女性,且不論男女患者雌激素水平均增高雄激素水平降低。推測高水平雌激素可直接作用B細胞,使其活化,導致分泌自身抗體的活化B細胞大量擴增。在實驗動物中發現雌激素可使其病情加重,而雄激素可使病情減輕。
4.自身組織抗原變異:紫外線照射、藥物化學物質、病原感染等多種因素均可能破壞自身組織暴露組織隱蔽抗原或使正常組織抗原結構改變,激發機體自身免疫損傷。
發病機制
發病機制
 腎炎
腎炎(2)B細胞多克隆活化:動物實驗研究提示B細胞多克隆活化誘發產生過多的致病性抗DNA抗體,大量資料證明SLE患者在活動期有類似B細胞多克隆活化證據,且預示病情嚴重與疾病進展。
(3)免疫複合物致病:研究表明DNA-抗DNA抗體是引起腎臟損害的一對主要抗原抗體複合物(免疫複合物),除此之外Sm抗原、SSA抗原、腎小球基底膜(GBM)抗原、腎小管基底膜(TBM)抗原與相應的抗體結合形成的免疫複合物,均可能與腎組織損傷有關。且不同抗體的免疫複合物與不同類型腎損害有關;如抗RNP(核糖核蛋白)及Sm抗體陽性時腎損害者少但另有研究發現抗SSA、RNP及Sm抗體陽性時,多為膜性腎病;瀰漫增殖性狼瘡腎炎上述抗體陽性率均低或滴度低;高親和力DNA抗體陽性及低補體血症者多為瀰漫增殖性腎炎
除T、B細胞功能紊亂產生大量致病性自身抗體的直接損傷外,免疫複合物是一個重要的致病原因,其主要機制是:
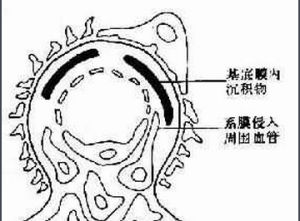
①循環免疫複合物:抗體與各種抗原在循環中形成免疫複合物後,經循環沉積於腎臟由經典途徑激活補體,吸引中性粒細胞,釋放炎症介質,引起腎臟損害。
②原位免疫複合物:實驗發現ssDNA對腎小球基底膜有親和力,經循環ssDNA先植入腎小球,再吸引循環中的抗ssDNA抗體與之結合,在原位形成免疫複合物,激活補體,誘生炎症,這種腎炎常為膜性狼瘡性腎炎。
③抗GBM、抗TBM抗體:這些抗體直接與腎組織(GBM、TBM)反應,引起腎損傷,若發現免疫螢光在GBM呈線樣IgG沉積,提示狼瘡腎炎因抗腎組織抗體介導而致病。
④免疫複合物清除障礙:正常人可以通過多種途徑清除不斷產生的免疫複合物其中補體途徑最為重要SLE患者因C3缺乏或紅細胞膜上C3b受體減少,導致巨噬細胞清除機制減弱,是免疫複合物沉積,致病的重要原因。
病理改變
 醫學常識
醫學常識(1)WHO病理分型:括弧中為國際小兒腎臟病科研協作組(ISKDC)分類法。
①WHOⅠ型(ISKDC1a,1b):本型罕見為正常腎小球或輕微病變,極少部分患兒免疫螢光或電鏡下可見腎小球有少許沉積物。
②WHOⅡ型(ISKDC2a,2b):系膜增殖型腎小球腎炎,病變局限於系膜區,表現為程度不等的系膜細胞和基質增多系膜區免疫沉積物陽性僅有輕度節段性系膜增生者為2a型,系膜和系膜細胞增生為2b型。本型多表現為輕度血尿或蛋白尿,很少發生腎功能不全。
③WHOⅢ型(ISKDC3a,3b和4a):局灶節段增殖型腎小球腎炎,部分腎小球存在急性或慢性病變,如節段性細胞增生、細胞壞死、內皮細胞增生、纖維素樣壞死、白細胞浸潤、透明血栓、系膜區和毛細血管壁見IgG、IgA、Clq、C3C4、白細胞介素等沉積約半數以上腎小球正常。臨床上可表現為蛋白尿、血尿,高血壓和輕度腎功能不全,亦可為腎病綜合徵。ISKDCAa指50%以上腎小球受累。
④WHOⅣ型(ISKDC5a,5b):瀰漫增生性腎炎、狼瘡腎炎中半數以上是本型,病變廣泛且嚴重,幾乎全部腎小球受累,呈活動性毛細血管內增殖性改變,中性粒細胞滲出,纖維素樣壞死;毛細血管壁顯著增厚,管壁內透明血栓;壞死節段常見細胞性新月體;嚴重病例呈瀰漫性壞死和新月體性腎炎,部分病例呈不同程度腎小球硬化。免疫螢光見所有腎小球、腎小管、包氏囊及球外毛細血管基底膜有各種免疫球蛋白補體沉積,尤其是內皮下沉積明顯,呈“滿堂亮”現象不規則大塊內皮下沉積物使光鏡下見毛細血管襻僵硬毛細血管基底膜增厚呈“白金耳”現象(wireloops)。
本型還存在嚴重的小管間質病變,顯著的單核細胞浸潤,壞死性血管炎臨床上本型患兒多為重症、血尿、蛋白尿、高血壓腎病綜合徵、腎功能不全,如不給予積極治療易進展為終末期腎功能衰竭。
⑤WHOⅤ型(ISKDC6):膜性腎病病變似特發性膜性腎病,表現為毛細血管襻的瀰漫性增厚,後期基底膜增厚呈釘突樣表現,但不同的是同時也見一定程度系膜與內皮細胞增生及系膜基質擴張。本型可進一步分為Ⅴa型:與原發性膜性腎病極似,細胞增生、浸潤不明顯;Ⅴb型:伴瀰漫性系膜病變;Ⅴc型:伴局灶節段性細胞增生,浸潤與硬化;Ⅴd型:伴瀰漫增生性病變或新月體形成。a、b亞型較c、d亞型預後好,表明附加病變影響預後
⑥WHOⅥ型:腎小球硬化型,此型與其他腎小球疾病晚期硬化相似,常伴隨以上各型腎小球病變,如局灶節段或瀰漫增殖性病變。部分人表現為單純腎小球硬化。
狼瘡腎炎可以發生病理類型轉化,如局灶增殖轉化為瀰漫性增殖,膜性腎炎轉化為局灶節段增殖或瀰漫增殖,系膜增殖可轉變為局灶節段增殖等。
(2)腎小管及間質病變:狼瘡腎炎中約50%——70%有腎小管間質病變常見於瀰漫增殖型,也見於局灶型,少見於膜型腎炎,罕見於系膜增生型。病變以小管萎縮,小管基底膜增厚電子緻密物沉積於小管基底膜及間質嚴重者出現小管壞死。
(3)腎小血管病變:常見以下幾種類型:
①高血壓引起的血管病變常見。
②小葉間動脈及出進球小動脈呈內皮細胞腫脹、破壞血管內血栓,IgG、C3沉積於血管壁,無炎症反應。
③壞死性小血管炎抗中性粒細胞質抗體(ANCA)陽性
④腎臟血栓微血管病(renalthromboticmicroangiopathy)在無壞死的基礎上出現腎小動脈及間質毛細血管血栓,繼而發展為腎小球硬化。
(4)活動性與慢性病變的判斷:腎活檢後可用半定量積分子方法評定病變情況,指導治療。
①公認的活動性指標:有活動性病變者主張積極給予皮質激素,免疫抑制劑治療如:
A.腎小球節段性壞死。
B.腎小球細胞明顯增生。
C.基底膜鐵絲圈樣改變。
D.內皮下及系膜區較多電子緻密物沉積核碎片及蘇木素小體
E.細胞新月體
F.腎小血管病變。
G.間質廣泛水腫及單核細胞浸潤。
②慢性病變的證據:如腎小球硬化、纖維新月體腎小管萎縮、腎間質纖維化、腎小囊粘連、腎小血管硬化。
成年病人的資料認為這些慢性化指標,對預後的價值,就Ⅳ型病變而言有用,其五年存活率明顯降低,重複腎活體組織檢查動態觀察意義更大。
(5)Pirani積分法:
①活動性病變:
A.毛細血管內增殖:(1+)<25%的腎小球受累;(2+)25%——50%的腎小球受累;(3+)>50%的腎小球受累。
B.白細胞滲出:(1+)輕度;(2+)中度;(3+)重度。
C.核崩解及纖維素樣壞死:(1+)<25%的腎小球受累;(2+)25%——50%的腎小球受累;(3+)>50%的腎小球受累。
D.細胞性新月體:(1+)<25%的腎小球受累;(2+)25%——50%的腎小球受累;(3+)>50%的腎小球受累。
E.白金耳及透明血栓:(1+)少量;(2+)中等;(3+)重度。
②瘢痕性病變:
A.腎小球硬化:(1+)<25%的腎小球受累;(2+)25%——50%的腎小球受累;(3+)>50%的腎小球受累
B.纖維性新月體:(1+)25%——50%腎小球受累;(2+)25%——50%的腎小球受累;
(3+)>50%的腎小球受累。
C.腎小管萎縮:(1+)輕度;(2+)中度;(3+)重度。
D.間質纖維化:(1+)輕度;(2+)中度;(3+)重度。
臨床表現
全身性表現
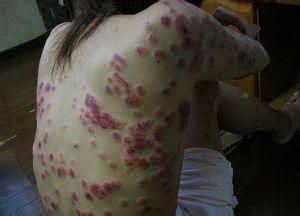 系統性紅斑狼瘡性腎炎臨床表現
系統性紅斑狼瘡性腎炎臨床表現皮膚黏膜症狀
70%——80%狼瘡患兒有皮膚黏膜損害,典型的蝶形紅斑僅見於50%病例,皮疹位於兩頰和鼻樑為鮮紅色邊緣清晰,呈輕度水腫性紅斑可見毛細血管擴張和鱗屑。炎症重時可見水皰、痂皮。紅斑消退後一般無瘢痕,無色素沉著。其他皮膚黏膜症狀
小兒盤狀紅斑較成人少,可見出血疹斑疹、網狀青斑、蕁麻疹、紫癜、口腔潰瘍、鼻黏膜潰瘍患兒日光照射後皮損加重或出現新的皮疹。約10%——20%病兒始終無皮疹表現。肌肉骨骼症狀
約70%——90%病兒有關節、肌肉症狀如關節炎關節痛,約1/3患兒伴有肌痛關節炎既可呈遊走性,也可呈持續性,很少見關節破壞和畸形。心血管症狀
可見心包炎、心肌炎、全心炎及各種小血管炎,雷諾現象在兒科少見。近年已開始注意有病兒發生冠狀動脈炎及心肌梗死的病例。漿膜炎
30%患兒出現多漿膜炎,如無菌性胸膜炎、腹膜炎、急性狼瘡性肺炎及肺出血。上述病變可表現為急性發熱、呼吸困難、咳嗽、胸痛、胸腔積液;腹痛、腹瀉、噁心、嘔吐、腹水症,若發生腸道壞死、穿孔需外科治療;嚴重肺出血可迅速死亡。血液系統症狀
多有不同程度貧血,50%患兒外周血白細胞數減少,15%——30%患兒血小板減少,少數病兒以血小板減少為首發症狀。神經系統症狀
狼瘡腦炎是SLE嚴重的併發症,相對發生率約30%(20%——50%)有5%患兒以神經系統症狀為首發症狀,表現為瀰漫性腦功能障礙(意識、定向障礙,智慧型、記憶力下降,精神異常等)或局限性腦功能障礙,如癲癇腦血管意外偏癱、失語。周圍神經病變少見表現為多發性周圍神經炎。其他症狀
有肝臟腫大(75%)、肝功異常、脾腫大(25%)。淺表淋巴結腫大(約50%)。可出現鞏膜炎、虹膜炎、視網膜炎等眼部症狀。腎臟症狀
狼瘡腎炎在SLE中很常見,且是危及遠期生命質量的關鍵因素。狼瘡腎炎臨床表現主要有以下幾種形式。(1)輕型:無症狀蛋白尿或(及)血尿,約30%——50%LN患兒表現此型,無水腫、無高血壓僅表現為輕——中度蛋白尿(常<2.5g/d)和(或)血尿(2)慢性腎炎型:起病隱匿、緩慢進展的腎炎綜合徵,有不同程度腎功能不全、高血壓
(3)急性腎炎或急進性腎炎綜合徵:其中35%——50%患者有高血壓,不同程度蛋白尿,尿沉渣中有較多紅細胞管型,腎功能不全或衰竭。急性腎炎起病類似鏈球菌感染後急性腎炎。急進性腎炎起病類似其他急進性腎炎表現為急性進展的少尿性急性腎功能衰竭但這兩種起病方式在LN中均少見。
(4)腎病綜合徵:此型約占LN總數的40%,臨床上可表現為單純性腎病綜合徵或腎病綜合徵伴明顯腎炎綜合徵。
(5)腎小管損害型:腎小管酸中毒伴腎鈣化結石、尿鎂丟失,LN病人中約44%有不同程度腎小管功能損害。
臨床類型間也可轉變,當血尿、蛋白尿、腎功能減退、高血壓加重時,均提示臨床類型或病理類型發生轉變,預後不良。
併發症
腎功能衰竭、高血壓、癲癇偏癱、腦血管意外、多發性周圍神經炎、視網膜炎、腹膜炎胸膜炎、肺炎、肺出血、腸道壞死穿孔心包炎,心肌炎等等。診斷
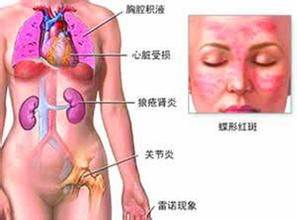 系統性紅斑狼瘡診斷
系統性紅斑狼瘡診斷2.盤狀紅斑:隆起紅斑上覆有角質性鱗屑和毛囊栓塞,舊病灶可有皮膚萎縮性瘢痕。
3.光敏感:日光照射引起皮膚過敏。
4.口腔潰瘍:口腔或鼻咽部無痛性潰瘍。
5.關節炎:非侵蝕性關節炎累及2個或2個以上的周圍關節,特徵為關節的腫、痛或滲液。
6.漿膜炎:①胸膜炎:胸痛胸膜摩擦音或胸膜積液;②心包炎:心電圖異常,心包磨擦音或心包積液。
7.腎臟病變:①蛋白尿>0.5g/d或>+++;②細胞管型:可為紅細胞、血紅蛋白、顆粒管型或混合性管型。
8.神經系統異常:①抽搐:非藥物或代謝紊亂如尿毒症、酮症酸中毒或電解質紊亂所致;②精神病:非藥物或代謝紊亂,如尿毒症、酮症酸中毒或電解質紊亂所致
9.血液學異常:①溶血性貧血伴網織細胞增多;或②白細胞減少<4×109/L至少2次;或③淋巴細胞減少<1500/μl,至少2次;或④血小板減少<100×109/L(除外藥物影響)。
10.免疫學異常:①LE細胞陽性;或②抗dsDNA抗體陽性;或③抗Sm抗體陽性;或④梅毒血清試驗假陽性免疫螢光抗核抗體滴度異常或相當於該法的其他試驗滴度異常,排除藥物誘導的“狼瘡綜合徵”。
11.抗核抗體:免疫螢光抗核抗體滴度異常或相當於該法的其他試驗滴度異常,排除藥物誘導的“狼瘡綜合徵”
鑑別診斷
鑑別診斷注意與其他風濕性疾病如幼年類風濕性關節炎全身型多關節型皮肌炎、硬皮症、混合性結締組織病、多發性血管炎等鑑別。本病也易與各類腎病、心臟病溶血性貧血、血小板減少性紫癜、組織細胞增多症、慢性活動性肝炎及神經系統疾病混淆,注意鑑別。檢查
實驗室檢查:1.尿液檢查:蛋白尿血尿及細胞、蛋白管型常見。
2.血液檢查:大多有不同程度貧血,部分人白細胞減少血小板減少,90%以上患者血沉明顯增快,血白蛋白降低球蛋白升高,以球蛋白升高為主但若有重度蛋白尿,球蛋白絕對值也降低。
3.免疫學檢查
(1)抗核抗體(antinuclearantibodies,ANAAs):若免疫螢光分析ANA呈周邊型對SLE診斷最有意義,提示dsDNA抗體陽性,該抗體對SLE有高度特異性且與疾病活動性相關
(2)抗雙鏈DNA(dsDNA)抗體:直接檢測dsDNA抗體陽性率為50%——80%,但特異性大於90%,且往往提示有腎臟損害,偶見於乾燥綜合徵、類風濕性關節炎及活動性肝炎。
(3)抗Sm抗體:約25%——40%病人抗Sm抗體陽性但其特異性可達99%。
(4)其他自身抗體:抗單鏈DNA(ssDNA)抗體,陽性率高,特異性不強,26%——45%病人抗核糖核蛋白(RNP)抗體陽性但特異性不高抗乾燥綜合徵(SS)A、B抗體敏感性、特異性均差。有壞死性血管炎時抗中性粒細胞質抗體(ANCA)陽性抗心磷脂抗體陽性病例常見病情呈復發性,多發性動靜脈栓塞,血小板減少及流產
(5)補體:C1q、C3、C4CH50在SLE活動期常降低。
(6)循環免疫複合物陽性。
4.狼瘡細胞(lupuserythematosuscell,LEC)LEC在SLE病人中陽性率可達60%——85%,但也可見於其他結締組織病。
5.狼瘡帶試驗取材於暴露在陽光下的正常皮膚用直接免疫螢光檢測表皮與真皮連線處,可見一條IgG和C3沉積的螢光帶,80%活動期SLE病人陽性,其他自身免疫性疾病也可呈陽性。
6.腎臟穿刺檢查:對系統性紅斑狼瘡的確診率達100%,即使臨床上沒有出現腎臟異常,但腎臟活體組織檢查也會發現異常。
7.其他如肝、肺、胃腸周圍神經肌肉、滑膜等活體組織檢查均有助於系統性紅斑狼瘡的鑑別診斷。
其它輔助檢查:
常規做X線、B超心電圖等檢查
1.心電圖有心肌病變,肺動脈高壓病變,心包炎或電解質失調時,心電圖有相應的異常改變。
2.放射線檢查
(1)X線:可檢查出系統性紅斑狼瘡患者的心包炎,胸膜炎,肺炎,肺部感染,肺出血,關節炎
(2)CT掃描和磁共振檢查:對神經系統心、肺縱隔、腹部、盆腔、脊柱關節病變均有診斷或鑑別診斷價值。
3.超音波檢查超音波對系統性紅斑狼瘡患者的漿膜炎、心肌炎、肝、脾、淋巴結腫大,膽囊、胰腺、腎臟,泌尿道、子宮、前列腺病變均有指導意義,也可做血管炎的檢查。
相關檢查:C3、C4、CH50免疫複合物、免疫球蛋白G 、抗Sm抗體、抗心磷脂抗體、抗核抗體、抗細胞胞質抗體、狼瘡細胞、白蛋白、砷、脫氧核糖核酸染色、血小板、血沉。
治療
 糖皮質激素
糖皮質激素1.一般治療:急性期活動期,重症均強調休息、加強營養避免日曬靜止期逐步恢復活動上學服免疫抑制劑期間儘量不到公共場所,減少感染機會,若發生感染應積極治療,要避免使用誘發狼瘡和腎損害的常用藥物(磺胺、肼屈嗪、普魯卡因胺對氨水楊酸、青黴素氨基糖苷類藥物);局部皮損若無繼發感染,可塗潑尼鬆軟膏
2.免疫抑制劑
(1)糖皮質激素:是治療SLE基本藥物,主要作用於G0期淋巴細胞有強烈抗炎作用。常用量為潑尼松1——2mg/(kg·d),總量<60mg/d,3次/d,口服,病情緩解、實驗室檢查基本正常後改為隔天頓服病情穩定後可以減至小劑量(0.5——1mg/kg,隔天)長期用藥,維持療效臨床發現多數狼瘡腎炎患兒單用潑尼松治療無效,尤其是Ⅳ型狼瘡腎炎急進性狼瘡腎炎腎上腺皮質激素治療更不敏感。甲潑尼龍衝擊治療,每次15——30mg/kg,總量<1g/次,1次/d,3次一療程,間隔1——2周可重複一療程,共2——3療程後用中、小劑量潑尼松維持治療,可使部分狼瘡腎炎患兒迅速緩解,腎功能較快好轉。
糖皮質激素長期使用,易發生條件致病菌感染、骨質疏鬆高血壓、水電解質紊亂、精神病、消化道出血等多種毒副作用。
(2)細胞毒類藥物:很多觀察均認為皮質激素聯合細胞毒類藥物治療狼瘡腎炎,療效遠較單用皮質激素或單用細胞毒類藥物好聯合用藥還可大大減少皮質激素的用藥量,提高療效。常用的細胞毒類藥物有環磷醯胺(CTX)、硫唑嘌呤、氮芥其中以環磷醯胺(CTX)使用最廣泛,療效最好。環磷醯胺(CTX)主要作用於S期對整個細胞周期均有作用,能有效抑制抗體產生,抗細胞毒、抗炎症介質作用也很明顯,其免疫抑制效應強烈而持久。皮質激素聯合環磷醯胺(CTX)[2——2.5mg/(kg·d)]對保存腎功能有明顯作用。近年資料表明環磷醯胺(CTX)大劑量衝擊用藥,較口服環磷醯胺(CTX)不良反應更少腎臟保護效果更好。環磷醯胺(CTX)衝擊方案尚未成熟,最積極的方案是每次8——12mg/kg,1次/d,連用2天1療程,總量<1g/療程,至少間隔2周用1療程,連用6療程後改為3月1療程維持2年;也有每月1療程,連用6月後停藥的半年方案以及每月1次連用6月,再3月1次維持2年的長療程治療方案。1992年NIH研究小組報告的前瞻性研究結果認為,長療程較半年療程在保護腎功能方面療效更好只有10%病人進入終末期腎衰環磷醯胺(CTX)大劑量衝擊治療應注意消化道副反應和採取水化措施[60——80ml/(kg·d)或2000ml/m2電解質平衡液持續靜滴],防止出血性膀胱炎。目前尚無資料確切證明口服方案與衝擊方案對性腺影響的大小。
(3)硫唑嘌呤:每天2.5mg/kg治療嚴重瀰漫增殖型LN,可減少皮質激素用量,與皮質激素聯合口服環磷醯胺(CTX)效果相同。甲潑尼龍衝擊治療後可用小劑量潑尼松及硫唑嘌呤維持治療。
(4)苯丁酸氮芥:0.2mg/(kg·d)分3次口服,療程2——3月,其對性腺的不良反應與致癌作用並不比環磷醯胺(CTX)小
(5)環孢素:選擇性作用於輔助性T細胞,間接抑制B細胞產生抗體,但毒副作用大,尤其是腎臟的毒副作用。一般僅在環磷醯胺(CTX)不能使病情緩解者選用環孢素;急性期用藥5——7mg/(kg·d),維持用藥4mg/(kg·d),可作為激素、細胞毒類抗凝劑三聯用藥的候選藥物之一。
 抗凝劑
抗凝劑4.血漿置換:可清除部分致病性抗體抗原及免疫複合物,但價格昂貴,多用於對其他治療無反應的嚴重LN患兒,對狼瘡腦患兒效果較好。也有人主張在急進性LN患兒給甲潑尼龍衝擊治療同時給予血漿置換療法,每天置換2——4L,連續3天。
5.靜脈注射用人血丙種球蛋白(MG):IVIG對部分狼瘡患兒有一定療效、可抑制B細胞產生抗體,可改變抗體、抗原比例,使免疫複合物易於清除可使部分環磷醯胺(CTX)耐藥的患兒病情緩解
6.全身淋巴結X線照射:有報告用X線照射全身淋巴結(20Gy/4——6周),可使部分病人取得一定療效,肌酐清除率好轉,dsDNA抗體減少,甚或停用潑尼松。
7.抗CIM單克隆抗體:可使T細胞數下降,B細胞抑制,蛋白尿減少,血漿蛋白升高
預後預防
預後
 預防
預防1.臨床表現:持續大量蛋白尿血尿、高血壓、貧血血肌酐水平已升高者預後不良反覆感染也影響預後。
2.病理類型:Ⅰ、Ⅱ型一般不發展為終末期腎預後不良者多死於併發症;Ⅲ型可能發展成慢性腎功能衰竭,但5年存活率仍達75.8%Ⅳ型病情危重,預後不良,但及時正確治療5年生存率可從25%提高到80%。Ⅴ型若有附加增生性病變(c、d亞型)預後不良,與Ⅳ型相似。公認有大量內皮下電子緻密物沉著、合併血管病變、腎功能惡化需替代治療者預後惡劣。
3.其他家長、病兒對治療目標的理解和支持以及環境因素也同樣影響預後。
預防
預防紅斑狼瘡性腎炎復發預防復發的主要措施:1.早期明確診斷,及時正確治療,長期定期隨訪,根據病情變化,調整用藥劑量。
2.避免誘發因素
(1)日光曝曬、紫外線照射。
(2)寒冷刺激可導致本病復發避免寒冷刺激以防受涼。
(3)有的藥物與發病明顯有關如青黴素、磺胺類、保泰松、肼屈嗪(肼苯噠嗪)、普魯卡因胺、氯丙嗪、苯妥英鈉、異煙肼、口服避孕藥等,可使處於緩解期的紅斑狼瘡患者進入活動期和實驗室改變。
(4)系統性紅斑狼瘡與妊娠有互相不利影響,如胎兒異常、流產、早產或死胎。反之,妊娠可使患者在懷孕末3個月和產後數月內病情加重或復發
3.及時抓住復發的早期徵兆:如原有的症狀關節痛、發熱、乏力等重新出現應及早就診進行必要的檢查,如有活動應及時採取措施,及早進行藥物治療和給予中藥治療。
4.食物宜清淡、易消化,不宜過食油膩厚味之物;合理採用補益精血的食物,如魚、肉、蛋、鮮果等,有益於本病的治療、康復。病情穩定期間,適當參加體育活動,以增強體質。
5.進行心理治療:保持良好情緒對疾病的轉歸非常重要。保持良好的情緒狀態,維持免疫功能的相對穩定,是避免復發,早日康復的重要保證。
日常注意
 運動
運動飲食狼瘡性腎炎病人應攝取足夠的營養,如蛋白質、維生素、礦物質,以清淡為宜。水份、鹽份宜作適度限制。避免多量的煙、酒或刺激性食物。骨質疏鬆可以使用維生素D。
運動運動可以促進血液循環,增進心肺功能,保持肌肉、骨骼的韌性。但是不要過度疲勞.但關節發炎則不適宜活動。
避免日曬系統性紅斑狼瘡腎炎患者對陽光敏感,是紫外線的β波長所造成的,應儘量避免日照。